- Abstract
- Palavras-chave
- Introdução
- Métodos precoces para a produção de pigmentos
- Método do ácido sulfúrico
- Método de cloração
- Separação do ferro
- O processo de forno elétrico
- Via hidrometalúrgica
- Método de alta pressão
- Processo atmosférico
- Oxyhydrolysis
- Exidrólise de leito fluidizado
- Extrator de oxidrólise de spray
- Produção de titânio
Abstract
Ilmenita de baixo grau pode ser lixiviada com HCl concentrado à pressão atmosférica e a 80oC. Após filtração para separar a matéria insolúvel a solução contendo TiO2+ e Fe2+ é aquecida para precipitar o hidróxido de titânio e recuperar o HCl. O hidróxido de titânio é então calcinado para rutilo sintético contendo 95+%TiO2 enquanto o FeCl2 é submetido a oxidrólise ou fluidizado para recuperar HCl e Fe2O3. O processo pode ser aplicado naturalmente à ilmenita de alto grau. Ele passa por um processo de forno elétrico que se aplica apenas à ilmenita de alto grau e é superior ao processo do ácido sulfúrico, que é altamente poluente. O produto deste processo pode ser usado para preparar o pigmento branco assim como o metal de titânio.
Palavras-chave
Lixiviação de HCl, Processo Magpei, Rutilo sintético, Oxidrólise, Forno elétrico, Cloração, Processo ácido sulfúrico
Introdução
Os principais minerais de titânio são o rutilo, TiO2 e ilmenita, FeTiO3 (Figura 1 e 2). O rutilo é fácil de processar para o metal titânio ou pigmento TiO2 pelo método de cloração, enquanto a ilmenita é mais complicada devido ao seu alto teor de ferro. Como as reservas mundiais de titânio são 90% na forma de ilmenita e apenas 10% na forma de rutilo, o tratamento da ilmenita é evidentemente uma questão importante na metalurgia .

Figure 1: Amostra de rutilo do museu, ~ 90% TiO2

Figure 2: Amostra de ilmenita do museu, FeTiO3 (59.4 % TiO2)
Depósitos de ilmenita podem ser maciços como na Província de Quebec (Figura 3) ou como areias negras (Figura 4) associadas com magnetita, monazita e outros minerais valiosos que são separados por métodos físicos (Figura 5). Na primeira separação magnética é usado um magnetita fraca para separar a magnetita enquanto que na segunda separação magnética é usado um magnetita de alta intensidade para separar a ilmenita.

Figure 3: Uma amostra de ilmenita maciça de Quebec

Figure 4: Areias pretas de praia como na Índia
Métodos precoces para a produção de pigmentos
Método do ácido sulfúrico
Em 1916, a Titanium Pigment Corporation of Niagara Falls, New York e a Titan Company of Norway iniciaram simultaneamente a produção comercial deste novo pigmento branco. Em seguida, os principais pigmentos brancos utilizados nas tintas foram chumbo branco, zinco branco e lithopone. Neste método a ilmenita foi tratada com H2SO4 concentrado a 110-120°C para formar sulfatos ferrosos e titanil:
FeTiO3 + 4H+ → Fe2+ + TiO2+ + 2H2O
A reação é conduzida em grandes tanques de concreto revestidos com tijolo resistente a ácido (Figura 6), aquecidos por injeção direta de vapor de alta pressão ou em um moinho de pug (Figura 7) . A massa solidificada produzida no final da reação no reator foi então descarregada do reator por dissolução em água ou ácido diluído. Após a remoção do resíduo insolúvel por filtração, a solução contendo 120-130 g/L TiO2 e 250-300 g/L FeSO4 foi concentrada sob vácuo a 10°C para cristalizar FeSO4-7H2O que foi então centrifugado. O óxido de titânio é então precipitado da solução por diluição e semeadura resultando na formação de H2SO4 diluído para eliminação (Figuras 8 e 9). No entanto, o maior produtor de pigmento em Salvador, Brasil, ainda utiliza esta tecnologia porque descarta os produtos residuais no oceano que são removidos pela maré.

Figure 5: Beneficiamento de areias negras para recuperar seus valiosos componentes

Figure 6: Grandes tanques de concreto revestidos com tijolo resistente a ácido
Figure 7: Pug mill aquecido

Figure 8: Produção de pigmento TiO2 pelo processo do ácido sulfúrico

Figure 9: Titânio branco, ~ 100% TiO2
Método de cloração
DuPont nos EUA produz o pigmento desde 1950 por cloração direta do minério de ilmenita, separação dos produtos por destilação fracionada, depois oxidação do TiCl4 (Figura 10):

Figure 10: Processo Du Pont simplificado para produção de pigmentos a partir de ilmenita
2FeTiO3 + 7Cl2 + 3C → 2TiCl4 + 2FeCl3 + 3CO2
TiCl4 + O2 → TiO2 + 2Cl2
O problema deste processo é a recuperação do cloro a partir do cloreto férrico ou a comercialização de grandes quantidades deste co-produto.
Separação do ferro
Por causa dos problemas de poluição associados com a disposição do ácido sulfúrico diluído e FeSO4, o ferro no minério é separado em um estágio inicial. Isto é conseguido de duas maneiras: por forno elétrico e por vias hidrometalúrgicas.
O processo de forno elétrico
O método do forno elétrico foi desenvolvido na década de 1950. O minério era misturado com uma certa quantidade de antracite que era suficiente para reduzir o componente de óxido de ferro do minério, então carregado em um forno elétrico a 1 650°C onde o óxido de ferro é reduzido a metal enquanto o titânio é separado como escória (Figura 11). As reações que ocorrem durante a redução são as seguintes:

Figure 11: Processo de forno elétrico para separação de ferro
FeTiO3 + C → Fe + CO + TiO2(escória)
Fe2O3 + 3C → 2Fe + 3CO
Este método é usado pela Rio Tinto QIT em sua planta em Sorel perto de Montreal e na Richards Bay na África do Sul. Também é utilizado na União Soviética em Zaporozhye (Ucrânia) e no Japão.
Titanium slag é principalmente titanato de ferro e magnésio, (Fe,Mg)Ti4O10, e uma pequena quantidade de silicatos; análises típicas são de 72-85% de TiO2 total. Uma pequena quantidade de TiO2 é reduzida para Ti2O3. A redução dos óxidos de ferro não é levada a termo para que algum óxido de ferro seja deixado na escória para diminuir o seu ponto de fusão. Ponto de fusão de TiO2 1840°C e ilmenita 1435°C.
A escória é alta em titânio e baixa em ferro (Figura 12) e é portanto preferível à ilmenita na fabricação do pigmento TiO2 ou do metal de titânio. Contudo, a escória produzida no Quebec não é adequada para a cloração devido ao seu alto nível de impurezas – cerca de 16,6% em comparação com cerca de 6% em outras escórias. Estas impurezas não só consumirão quantidades desnecessárias de cloro, mas também criarão um problema de eliminação. Além disso, algumas destas impurezas, por exemplo cálcio e magnésio irão interferir com o próprio processo de cloração que é conduzido a 800°C, formando uma fase fundida (CaCl2 m.p. 770°C, MgCl2 m.p. 708°C).

Figure 12: escória de titânio moída, FeTi4O10 (70-80 % TiO2)
Por estas razões, a escória de titânio foi usada apenas para fazer pigmento pelo processo do ácido sulfúrico . A escória foi tratada da mesma forma que a ilmenita, com a exceção de que não era necessária a separação do sulfato ferroso, pois a maior parte do ferro já estava separada por redução na etapa anterior (Figura 13). O processo de tratamento do ácido sulfúrico da escória, entretanto, ainda sofria do problema de disposição do ácido residual e, como resultado, foi abandonado na década de 1980 e substituído por uma nova tecnologia baseada na atualização da escória para 94,5% de TiO2 por lixiviação da maioria das impurezas pelo HCl sob pressão para torná-la adequada para a cloração.

Figure 13: Lixiviação de escória de titânio para produção de pigmento TiO2, agora obsoleto
Via hidrometalúrgica
Via hidrometalúrgica foi desenvolvida nos anos 60 e envolveu lixiviação de ferro de ilmenita e obtenção de um resíduo rico em titânio (90-95% TiO2) conhecido como “rutilo sintético” . Em um caso, o processo de Altair, foi obtido um TiO2 de grau de pigmento. Todos estes processos utilizam um processo de oxidrólise para o tratamento do cloreto ferroso para obter HCl para reciclagem e Fe2O3 como subproduto.
Método de alta pressão
Neste método, a ilmenita de alto grau é decomposta em autoclaves em 20% de HCl a 120°C e 200 kPa; o ferro é solubilizado como cloreto ferroso deixando um sólido contendo cerca de 95% de TiO2 que tem a análise química para rutilo que nós chamamos de rutilo sintético (Figura 14):

Figure 14: Rutilo sintético
FeTiO3 + 2H+ → TiO2 + Fe2+ + H2O
Ilmenita de baixo grau não pode ser tratada por este método, pois todos os silicatos e matéria insolúvel contaminarão o produto. O rutilo sintético é então tratado com cloro para preparar o TiCl4 do qual se obtém TiO2 ou titânio metálico sem problemas de poluição. O processo é utilizado nos EUA, Inglaterra, Japão, Taiwan e Austrália. A oxidrólise pode ser conduzida de várias maneiras como descrito abaixo.
Processo atmosférico
Em 2014 foi descoberto pela Magpie Incorporation no Canadá que ilmenita de baixo grau pode ser dissolvida a 80°C com HCl concentrado à pressão atmosférica. Após filtração para remover a matéria insolúvel, a solução é destilada para recuperar o HCl e hidrolisar o íon titanil ao TiO2. Após a filtração, o resíduo é calcinado para produzir rutilo sintético (Figura 16):

Figure 15: Produção de rutilo sintético a partir de ilmenita

Figure 16: Produção de 98+% TiO2 a partir de uma ilmenita de baixo grau
FeTiO3 + 4HCl → TiO2+ + Fe2+ + 4Cl- + 2H2O
TiO2+ + 2Cl- + H2O → TiO2 + 2HCl
É evidente que a nova tecnologia de lixiviação à pressão ambiente é superior à da antiga fundição de fornos eléctricos – actualização de autoclaves.
Oxyhydrolysis
A solução de cloreto de ferro é regenerada para HCl e Fe2O3 por oxidrólise:
2FeCl2 + 2H2O + 1/2O2 → Fe2O3 + HCl
É a mesma tecnologia que é usada para tratar a solução de picles. Dois métodos são usados
Exidrólise de leito fluidizado
Em um reator de leito fluidizado a solução de cloreto ferroso é introduzida em um grande leito de óxido férrico quente onde o aquecimento é proporcionado pelos gases de combustão fluidizantes quentes (Figura 17). À medida que o gás de combustão flui através do leito bem agitado de óxido, ele rapidamente atinge o equilíbrio térmico com o leito. A solução é alimentada em cima do leito de óxidos. A alimentação líquida molha a camada externa das partículas de óxido quente e é rapidamente evaporada para formar uma camada semelhante a uma cebola de novo óxido sólido sobre o óxido existente, produzindo assim partículas densas e homogêneas.

Figure 17: Reator de leito fluidizado para oxidrólise de cloreto ferroso
Extrator de oxidrólise de spray
Neste tipo de oxidrólise de spray, a solução de cloreto ferroso é pulverizada em um recipiente cilíndrico vazio, enquanto a energia necessária é fornecida pelo fluxo ascendente de gases quentes gerados nos queimadores inferiores (Figura 18). Os torradores de pulverização têm grandes diâmetros para manter baixas as velocidades do gás. Se a velocidade do gás for alta, demasiadas partículas são elutrificadas com o gás fora do gás, e a qualidade do produto e a eficiência da gota do torrador. Os off-gas e os óxidos deixam o contra-gás torrefador a cerca de 400°C a 500°C. O tempo de residência das partículas pulverizadas na zona de reação a altas temperaturas é muito curto; portanto, gotículas de líquido muito pequenas, que podem ser rapidamente aquecidas, devem ser criadas por atomização. O rápido aquecimento resulta na formação de uma crosta de óxido sólido na superfície de cada gota. Como a maior parte da gota aquece, o conteúdo de água se vaporiza e quebra através da casca do óxido. Portanto, o óxido assado em spray é composto de esferas ocas muito finas e “fofas”.

Figure 18: Regeneração de HCl a partir de solução de cloreto ferroso por oxidrólise em spray roaster
Produção de titânio
Titânio metálico é produzido pela cloração do rutilo, rutilo sintético, ou escória de titânio, em seguida, redução em um reator metalotérmico de TiCl4 por magnésio para titânio (Figuras 19 e 20) :
TiO2 + C + 2Cl2 → TiCl4 + CO2
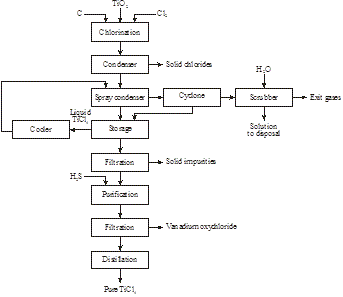
Figure19: Produção de TiCl4 a partir de rutilo, rutilo sintético, ou escória de titânio

Figure 20: Produção de titânio a partir de TiCl4
TiCl4 + Mg → Ti + MgCl2
Cloreto de magnésio é então electroliado para recuperar o magnésio e o cloro para reciclar. A Figura 21 mostra o reator metalotérmico removido do forno após a redução do qual a esponja de titânio é recuperada (Figura 22).

Figure 21: Reator metalotérmico sendo removido do forno

Figure 22: Esponja de titânio (topo) e MgCl2 (fundo) removidos do reator
- Barksdale J (1966) Titanium, Its Occurrence, Chemistry and Technology, Ronald Press, New York.
- Sibum H (1997) “Titanium”, pp. 1129-1179 in Handbook of Extractive Metallurgy editado por F. Habashi, publicado por WILEY-VCH, Weinheim, Alemanha.
- Habashi F (1993) A Textbook of Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Quebec City, Canada.
- DuPont (2007) Brochure™ Ti-Pure® titanium dioxide.
- Habashi F (2002) Textbook of Pyrometallurgy, Métallurgie Extractive Québec, Québec City, Canada.
- Toromanoff I, Habashi F (1985) Transformation of a Low-Grade Titanium Slag into Synthetic Rutile Intern. J. Mineral Processing 15: 65-81
- Habashi F (1996) Pollution Problems in the Mineral and Metallurgical Industries, Metallurgy Extractive Quebec, Quebec City.
- Habashi F (1993) Pressure Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Cidade de Quebec, Canadá.
- Habashi F, Kamaleddine F, Bourricaudy E (2015) A New Process to Upgrade Ilmenite to Synthet-ic Rutile Proceedings Conference of Metallurgists, Canadian Institute of Mining, Metallurgy, and Petroleum, Montreal. Reimpresso em Metall 69: 27-30
- Habashi F (1993) Two Hundred Years Titanium. The Processing of Titanium Ores for Pigment and Metal Production. Arab Min J 11: 74-84