- Introdução
- Epidemiologia
- O Organismo e a Fisiopatologia do C. difficile Diarreia
- Manifestações clínicas
- Diagnóstico
- Orientações práticas para o diagnóstico das Síndromes Diarréicas de C. difficile
- Diagnóstico endoscópico de C. difficile diarreia e colite
- Tratamento
- Gestão da Diarreia Recorrente C. difficile
- Severe C. difficile Colitis
- Conclusão
Introdução
Diarreia Associada ao Clostridium difficile (CDAD) tem sido reconhecida com maior frequência como causa de doença nosocomial. A frequência e incidência de CDAD varia muito, e é influenciada por múltiplos fatores, incluindo surtos nosocomiais, padrões de uso de antimicrobianos, e suscetibilidade individual. Não há relatos de estudos prospectivos de hospitais que rastreiam toxinas A ou A/B positivas e os resultados do CDAD e suas complicações.
O Centro de Controle e Prevenção de Doenças (CDC) analisou tendências seculares na incidência do CDAD, e relatou um aumento constante de 1987 a 2001 (1). Neste relatório, 30% dos 440 médicos de doenças infecciosas que participaram de uma pesquisa baseada na Web relataram que estão vendo taxas mais altas de CDAD, CDAD mais grave e CDAD mais recorrente do que no passado. Há uma impressão geral de que houve um aumento na proporção de casos com complicações graves e fatais, e um aumento na taxa de recidivas entre os pacientes afetados.
Além da morbidade e mortalidade, a carga econômica da infecção por C. difficile em termos de alta tardia e outros custos hospitalares é considerável.
Epidemiologia
A freqüência e incidência de CDAD varia entre hospitais e dentro de uma determinada instituição ao longo do tempo. O risco de doença aumenta em pacientes com exposição a antibióticos, cirurgia gastrointestinal, aumento do tempo de permanência em ambientes de saúde, doença subjacente grave, condições imuno-compromissoras e idade avançada.
C. difficile é derramado nas fezes. Qualquer superfície, dispositivo ou material (por exemplo, comodo, banheira e termômetro retal eletrônico) que se contamine com fezes pode servir como reservatório para esporos de C. difficile. Os esporos são transferidos aos pacientes principalmente através das mãos do pessoal de saúde que tocou em uma superfície ou item contaminado (2-6).
 clique para versão grande
clique para versão grande
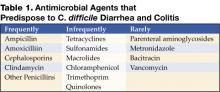
Figure 1 . A radiografia digital de tomografia computadorizada mostra espessamento nodular haustal no cólon transverso.
>
>
>
O Organismo e a Fisiopatologia do C. difficile Diarreia
C. difficile é um bacilo gram-positivo, anaeróbio, formador de esporos, responsável pelo desenvolvimento de diarréia e colite associadas a antibióticos. C. difficile foi descrito pela primeira vez em 1935 como um componente da flora fecal de recém-nascidos saudáveis e inicialmente não foi considerado patogénico (7). O bacilo foi chamado difficile porque cresce lentamente e é difícil de ser cultivado. C. difficile é atualmente responsável por quase todas as causas de colite pseudomembranosa e até 20% dos casos de diarréia associada a antibióticos sem colite. Embora encontrada nas fezes de apenas 5% da população geral, até 21% dos adultos são colonizados com este organismo enquanto hospitalizados (2,6).
Uma alteração da microflora cólica normal, geralmente causada pela antibioticoterapia, é o principal fator que predispõe à infecção por C. difficile. Quase todos os antibióticos têm sido associados à diarréia e colite por C. difficile. Os antibióticos mais frequentemente associados incluem clindamicina, cefalosporinas, ampicilina e amoxicilina (Tabela 1) (8).
Além da terapia antibiótica, a idade avançada e a gravidade da doença subjacente são factores de risco importantes para a infecção por C. difficile. Outros fatores de risco incluem a presença de uma sonda nasogástrica, procedimentos gastrointestinais, medicações antissecretivas ácidas, permanência na unidade de terapia intensiva e duração da hospitalização (9).
C. A diarréia difficile é causada principalmente pela elaboração das toxinas A e B produzidas pela multiplicação bacteriana dentro da luz intestinal. Estas toxinas ligam-se à mucosa do cólon e exercem sobre ela os seus efeitos deletérios. O organismo raramente danifica o cólon por invasão direta, e a diarréia é causada pelos efeitos das toxinas produzidas dentro da luz intestinal que aderem à superfície da mucosa. A maioria dos isolados toxigénicos produz ambas as toxinas, e cerca de 5-25% dos isolados não produzem toxinas A ou B, e não causam colite ou diarreia (3-5).
Manifestações clínicas
Infecção com C. difficile pode produzir uma vasta gama de manifestações clínicas, incluindo transporte assintomático, diarreia leve a moderada, e doença fulminante com colite pseudomembranosa (10). Em pacientes que desenvolvem CDAD, os sintomas geralmente começam logo após a colonização. A colonização pode ocorrer durante o tratamento com antibióticos ou até várias semanas após um curso de antibióticos. O CDAD normalmente está associado à passagem de movimentos frequentes e soltos do intestino, consistentes com a proctocolite. Muco ou sangue oculto podem estar presentes, mas sangue visível é raro.
Diagnóstico
O diagnóstico de CDAD é baseado em histórico de antibioticoterapia recente ou atual, desenvolvimento de diarréia ou outras evidências de colite aguda, e demonstração de infecção por C. difficile toxigênica, geralmente pela detecção da toxina A ou toxina B nas fezes.
 clique para versão grande
clique para versão grande
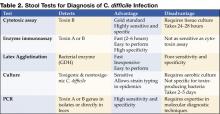
Figure 1 . A radiografia digital da tomografia computadorizada mostra espessamento nodular haustal no cólon transverso.
>
>
>
Orientações práticas para o diagnóstico das Síndromes Diarréicas de C. difficile
- O diagnóstico deve ser suspeito em qualquer pessoa com diarréia que tenha recebido antibióticos nos 2 meses anteriores e/ou cuja diarréia comece 72 horas ou mais após a hospitalização.
- Quando o diagnóstico é suspeito, uma única amostra de fezes deve ser enviada para o laboratório para teste da presença de C. difficile e/ou suas toxinas.
- Quando a diarréia persiste apesar do resultado negativo da toxina das fezes, uma ou duas amostras adicionais podem ser enviadas para teste com o mesmo teste ou testes diferentes (4). A endoscopia é reservada para situações especiais, como quando é necessário um diagnóstico rápido e os resultados do teste são atrasados ou quando o teste não é altamente sensível, quando o paciente tem íleo e fezes não estão disponíveis, ou quando outras doenças do cólon também são consideradas.
Ainda não existe um teste simples, barato, rápido, sensível e específico para o diagnóstico de C. difficile diarreia e colite, nem todos os testes disponíveis são adequados para adopção por todos os laboratórios (Tabela 2) (11).
Diagnóstico endoscópico de C. difficile diarreia e colite
Sigmoidoscopia e colonoscopia não estão indicados para a maioria dos doentes com CDAD (10,12). A endoscopia é útil, no entanto, em situações especiais, como quando o diagnóstico está em dúvida ou a situação clínica exige um diagnóstico rápido. Os resultados do exame endoscópico podem ser normais em pacientes com diarréia leve ou podem apresentar colite inespecífica em casos moderados. O achado de pseudomembranas colônicas em um paciente com diarréia associada a antibióticos é praticamente patognomônico para a colite de C. difficile. Alguns pacientes sem nenhuma característica diagnóstica no retosigmoide têm pseudomembranas nas áreas mais proximais do cólon (13). Outros achados endoscópicos incluem eritema, edema, friabilidade e colite inespecífica com pequenas ulcerações ou erosões.
Tratamento
O primeiro passo no tratamento da diarréia e colite de C. difficile é descontinuar os antibióticos precipitantes se possível (10,12). A diarréia se resolve em aproximadamente 15-25% dos pacientes sem terapia anti-C. difficile específica (14,15). O tratamento conservador sozinho pode não ser indicado, no entanto, em pacientes sistemicamente doentes ou com múltiplos problemas médicos, uma vez que é difícil prever quais pacientes irão melhorar espontaneamente. Se não for possível descontinuar o antibiótico precipitante devido a outras infecções activas, o regime antibiótico do paciente deve ser alterado, se possível, para fazer uso de agentes menos susceptíveis de causar CDAD (por exemplo aminoglicosídeos, trimetoprim, rifampicina ou uma quinolona).
Antiperistálticos, tais como difenoxilato mais atropina (Lomotil), ou loperamida (Imodium), e analgésicos narcóticos devem ser evitados porque podem retardar a eliminação de toxinas do cólon e, assim, exacerbar a lesão do cólon induzida por toxinas ou precipitar íleo e dilatação tóxica (12,16). A terapia específica para erradicar C. difficile deve ser usada em pacientes com sintomas inicialmente graves e em pacientes cujos sintomas persistem apesar da descontinuação do tratamento com antibióticos. Embora o diagnóstico de C. difficile colite deva ser idealmente estabelecido antes da implementação da terapia antimicrobiana, as diretrizes atuais do ACG recomendam que a terapia empírica deve ser iniciada em casos altamente sugestivos de pacientes gravemente doentes (Tabela 3 na página 54) (12).
Atualmente, vancomicina oral ou metronidazol, usado por 7 a 10 dias, são considerados terapia de primeira linha pela maioria dos autores e pelas diretrizes atuais. O metronidazol na dose de 250 mg 4 vezes ao dia é recomendado pela maioria dos autores e pelas diretrizes do ACG como droga de escolha para o tratamento inicial da colite C. difficile (12). Essas recomendações são baseadas, em grande parte, na eficácia, menor custo e preocupação com o desenvolvimento de cepas resistentes à vancomicina. As principais desvantagens do metronidazol incluem um perfil medicamentoso menos desejável e contra-indicações em crianças e mulheres grávidas.
Vancomycin, por outro lado, com uma dose de 125 mg 4 vezes ao dia, é seguro e bem tolerado e atinge níveis de fezes 20 vezes a concentração inibitória mínima necessária para o tratamento de C. difficile. Os inconvenientes do uso da vancomicina são o custo e o potencial desenvolvimento de estirpes resistentes à vancomicina. As diretrizes atuais do ACG consideram a vancomicina o medicamento de escolha em pacientes gravemente doentes e nos casos em que o uso de metronidazol está excluído.
Não existem ensaios clínicos controlados para pacientes com colite fulminante que podem não tolerar a terapia oral. A administração de metronidazol por via intravenosa ou a administração de vancomicina por sonda nasogástrica ou enema rectal foi descrita em pequenas séries de casos (17-20). A administração intravenosa de vancomicina não é recomendada, porque o fármaco não é excretado no cólon (17).
Gestão da Diarreia Recorrente C. difficile
Apesar do tratamento inicial com sucesso do CDAD, 15-20% dos doentes têm recidiva de diarreia associada a um teste de fezes positivo para a toxina C. difficile. A recidiva sintomática é raramente devida a falha no tratamento ou resistência antimicrobiana ao metronidazol ou à vancomicina. As abordagens ao tratamento incluem terapia conservadora (no entanto, muitos pacientes são idosos e doentes e incapazes de tolerar a diarreia), terapia com antibióticos específicos anti-C. difficile, o uso de resinas aniônicas, terapia com microorganismos (probióticos) e terapia com imunoglobulina.
A terapia mais comum para a diarreia recorrente de C. difficile é um segundo curso do mesmo antibiótico usado para tratar o episódio inicial (12). Em um grande estudo observacional nos Estados Unidos, 92% dos pacientes com CDAD recorrente responderam com sucesso a um único curso repetido de terapia, geralmente com metronidazol ou vancomicina (14). Há evidências que sugerem que pacientes com histórico de recidiva têm alto risco de novos episódios de CDAD após a interrupção da antibioticoterapia. Não há dados que sugiram que os episódios sequenciais se tornem progressivamente mais graves ou complicados (21). Uma variedade de cronogramas de tratamento tem sido sugerida para pacientes com múltiplas recidivas de C. difficile diarréia. Uma abordagem é dar um curso prolongado de vancomicina (ou metronidazol) usando um programa de dosagem decrescente seguido de terapia de pulso (Tabela 4).
Cholestyramine, uma resina de troca de aniões administrada na dose de 4 gramas 3 ou 4 vezes ao dia durante 1 a 2 semanas, liga as toxinas C. difficile e pode ser usada em conjunto com antibióticos para tratar recidivas repetidas. Como a colestiramina pode ligar a vancomicina assim como as toxinas, deve ser tomada com pelo menos 2 a 3 horas de intervalo entre a vancomicina.
Severe C. difficile Colitis
A incidência de fulminante C. difficile colitis foi relatada como sendo de 1,6-3,2% (22). Embora faltem números precisos recentes de outros centros, ela está sendo reconhecida como uma causa crescente de complicações e morte. A síndrome clínica da colite fulminante C. difficile pode ser reconhecida com um conhecimento adequado do espectro de apresentação da doença.
A. Diarréia: Embora a diarreia seja a marca registrada da colite C. difficile, ela não está invariavelmente presente, e sua ausência pode levar a confusão diagnóstica. Quando a diarréia está ausente, esta parece ser secundária a uma grave dismotilidade do cólon. Mesmo quando presente, a diarreia pode ser percebida como um componente menor de um quadro séptico não específico.
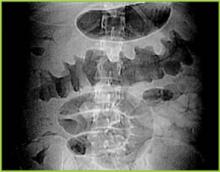 Reimpresso com permissão da BUMC Proceedings 1999; 12:249-250
Reimpresso com permissão da BUMC Proceedings 1999; 12:249-250
Figure 1 . A radiografia digital da tomografia computadorizada mostra espessamento nodular haustal no cólon transverso.
>
>
>
>
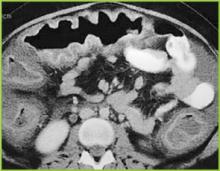 Reimpresso com permissão da BUMC Proceedings 1999; 12:249-250
Reimpresso com permissão da BUMC Proceedings 1999; 12:249-250
Figure 2 . Imagem tomográfica do abdómen superior confirma espessamento haustral marcado no cólon transversal.
>
>
>
>
>
>
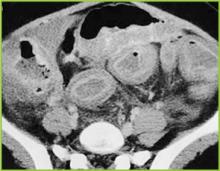 Reimpresso com permissão do BUMC Proceedings 1999; 12:249-250
Reimpresso com permissão do BUMC Proceedings 1999; 12:249-250
Figure 3 . A imagem tomográfica do abdómen médio demonstra um acentuado espessamento de todo o cólon. Mudanças inflamatórias leves estão presentes na gordura pericolónica.
B. Doença Grave: A colite fulminante é uma forma incomum de infecção por C. difficile, ocorrendo em apenas 3% dos pacientes, mas sendo responsável por praticamente todas as complicações graves. Os doentes com formas mais graves da doença podem apresentar-se com ou sem diarreia. Quando os doentes desenvolvem colite localizada no ceco e no lado direito do cólon, a diarreia pode ser mínima ou ausente. Na ausência de diarreia, as únicas pistas para o diagnóstico podem ser sinais sistémicos de toxicidade (febre, taquicardia, leucocitose e/ou depleção de volume).
Uma contagem elevada de glóbulos brancos pode ser uma pista importante para a colite fulminante iminente de C. difficile. A rápida elevação da contagem periférica de glóbulos brancos (geralmente de 30.000 a 50.000) com um significativo excesso de bandas e por vezes formas mais imaturas precede frequentemente a instabilidade hemodinâmica e o desenvolvimento de disfunções orgânicas. Mesmo em pacientes que são ligeiramente sintomáticos durante um período prolongado, pode ocorrer uma progressão súbita e inesperada para o choque. É difícil prever os pacientes que podem não responder ao tratamento médico. Portanto, sinais de alerta precoce, como uma reação leucemóide, podem ser inestimáveis.
Hipotensão é um achado tardio e pode ser resistente ao suporte vasopressor. Os sinais abdominais variam desde a distensão até a sensibilidade generalizada com guarda. A perfuração do cólon é geralmente acompanhada de rigidez abdominal, guarda involuntária, sensibilidade de rebote e ausência de sons intestinais. O ar livre pode ser revelado nas radiografias abdominais. Qualquer suspeita de perfuração neste ambiente deve ser imediata e imediata consulta cirúrgica. O óbito geralmente ocorre antes que o ar livre e a perfuração possam ocorrer. Em um estudo, ao contrário da maioria da literatura, a perfuração foi considerada rara (22).
A radiografia abdominal pode revelar um cólon dilatado (>7 cm em seu maior diâmetro), consistente com megacólon tóxico. Os pacientes com megacólon podem ter um íleo do intestino delgado associado com intestino delgado em radiografias simples do abdome, com níveis de fluido de ar imitando obstrução ou isquemia do intestino delgado. A TC sem contraste e endoscopia pode diagnosticar rapidamente ou, pelo menos, sugerir fortemente colite fulminante C.difficile. Os resultados da tomografia computorizada incluem evidências de ascite, espessamento e/ou dilatação da parede do cólon. Esses achados podem ser úteis na categorização da gravidade da colite.
Uma intervenção mais agressiva em pacientes clinicamente não responsivos, incluindo a rápida identificação de pacientes que não respondem à terapia médica, é crucial para um resultado positivo, e uma intervenção cirúrgica precoce deve ser feita nesse grupo (Figuras 1-3).
É importante que todos os envolvidos com o cuidado de pacientes em hospitais, lares e instalações de enfermagem especializadas sejam educados sobre o organismo e sua epidemiologia, abordagens racionais para o tratamento e cuidado de pacientes com C. A diarréia difficile, a importância da lavagem das mãos entre o contato com os pacientes, o uso de luvas ao cuidar de um paciente com C. difficile diarréia, e a prevenção do uso desnecessário de antimicrobianos.
Conclusão
Os anos recentes têm levantado preocupações sobre o aumento da incidência e das taxas de complicações graves do CDAD nos hospitais norte-americanos (22,23). A revista Canadian Medical Association publicou em 2004 um relatório detalhando um surto de CDAD envolvendo vários hospitais em Montreal. A introdução de novas linhagens hipervirulentas e altamente transmissíveis de C. difficile foi postulada como a possível causa do surto (24). Uma infra-estrutura deteriorada, práticas inadequadas de controle de infecção, o número crescente de pacientes debilitados, uma população envelhecida e cepas hipervirulentas foram todos considerados como provavelmente contribuintes para surtos recentes no Canadá (25).
Duas investigações epidemiológicas nos Estados Unidos e no Canadá (24,26) examinaram independentemente amostras de C. difficile e descobriram que uma versão mutante da cepa “selvagem” foi responsável por surtos no Quebec e por taxas aumentadas de CDAD em hospitais nos Estados Unidos recentemente (22,23). Epidemiologistas clínicos do CDC investigaram o C. difficile isolado de hospitais nos Estados Unidos com surtos recentes (ou seja, 2001-2004) de CDAD (22,23). O relatório indica o surgimento de uma nova estirpe epidêmica, “BI” (distinta da estirpe “J” de 1989-1992), que pode ser responsável pelo recente aumento das taxas e aparente gravidade do CDAD (26).
CDAD e colite na maioria dos casos podem ser tratados pela administração de metronidazol ou vancomicina. Em alguns pacientes desenvolve-se toxicidade grave com risco de vida, apesar de tratamento médico apropriado e oportuno, sendo necessária intervenção cirúrgica. Os sintomas sistémicos de infecção com C. difficile são relatados não por bacteremia, perfuração do cólon ou isquemia, mas por mediadores inflamatórios induzidos por toxinas libertados do cólon (27-29). A intervenção cirúrgica precoce deve ser empregada em casos refratários de doença grave. A intervenção cirúrgica está longe de ser ideal, no entanto, e carrega uma taxa muito alta de complicações e risco significativo de mortalidade (22). A futura abordagem clínica para o tratamento da colite nosocomial C. difficile pode eventualmente envolver hiperimunoglobulinas antitoxinas específicas e inibidores da cascata inflamatória (28,30,31).
- Archibald LK, Banerjee SN, Jarvis WR. Tendência secular na doença Clostridium difficile adquirida em hospital nos Estados Unidos; 1987-2001. J Infect Dis. 2004;189:1585-9.
- Fekety R. Antibiotic-associated colitis. In: Mandell G, Bennet JE, Dolin R, eds. Principles and Practice of Infectious Diseases. 4ª ed. New York: Churchill Livingston; 1996:978-806.
- Mitty RD, LaMont T. Clostridium difficile diarrhea: Patogénese, epidemiologia, e tratamento. Gastroenterologista. 1994;2:61-9.
- Bartlett JG. Clostridium difficile: History of its role as an enteric pathogenesis and the current state of knowledge about the organism. Dis. Clin Infect Dis. 1994;18(Suppl 4):265-72.
- Johnson S, Gerding D. Clostridium difficile. In: Mayhall CG, ed. Hospital Epidemiology and Infection Control. Baltimore, Md: Williams & Wilkins; 1996:99-408.
- Mcfarland LV, Mulligan ME, Kwok RY, Stamm WE. Aquisição nosocomial de Clostridium difficile. N Engl J Med. 1989;320:204-10.
- Hall IC, O Toole E. Intestinal Flora em recém-nascidos: Com uma descrição de um novo aneróbio patogénico, Bacillus difficile. Am J Dis Child. 1935;49:390-402.
- Kelly CP, LaMont JT. Tratamento de Clostridium difficile diarréia e colite. In: Wolfe MM, ed. Farmacoterapia Gastrointestinal. Philadelphia, Pa.: WB Saunders; 1993:199-212.
- Bignardi GE. Fatores de risco para infecção por Clostridium difficile. J Infecção hospitalar. 1998;40:1-15.
- Kelly CP, Pothoulakas C, LaMont JT. Clostridium difficile colitis. N Engl J Med. 1994;330:257-62.
- Linevsky JK, Kelly CP. Clostridium difficile colitis. In: Lamont JT, ed. Infecções Gastrointestinais: Diagnóstico e Gestão. New York: Marcel Dekker; 1997:293-325.
- Fekety R. Guidelines for the diagnosis and management of Clostridium difficile associated diarrhea and colitis. American College of Gastroenetrology, Practice Parameters Committee. Am J Gastroenterol. 1997;92:739-50.
- Tedesco FJ, Corless JK, Brownstein RE. Rectal sparing in antibiotic-associated pseudomembranous colitis: Um estudo prospectivo. Gastroenterologia. 1982;83:1259-60.
- Olson MM, Shanholtzer CJ, Lee JT Jr, Gerding DN. Dez anos de vigilância e tratamento prospectivo da doença associada ao Clostridium difficile no Centro Médico de Minneapolis VA, 1982-1991. Epidemiol do Hospital de Controle de Infecções. 1994;15: 371-81.
- Teasley DG, Gerding DN, Olson MM, et al. Estudo prospectivo randomizado de metronidazol versus vancomicina para diarréia associada ao Clostridium-difficile e colite. Lanceta. 1983;2:1043-6.
- Walley T, Milson D. Loperamide-related Loperamide-related toxic megacolon in Clostridium difficile colitis. Postgrad Med J. 1990;66:582.
- Malnick SD, Zimhony O. Tratamento da diarréia associada ao Clostridium difficile. Ann Pharmacother. 2002;36:1767-75.
- Sehgal M, Kyne L. Clostridium difficile disease. Opções de tratamento da doença de Clostridium difficile. 2002;4:201-10.
- Apisarnthanarak A, Razavi B, Mundy LM. Vancomicina intracolônica adjunta para colite Clostridium difficile grave: série de casos e revisão da literatura. Clin Infect Dis. 2002;35:690-6.
- Friendenberg F, Fernandez A, Kaul V, Niami P, Levine GM. Intravenous metronidazole for the treatment of Clostridium difficile colitis. Dis Colon Rectum. 2001;44:1176-80.
- Fekety R, McFarland LV, Surawicz CMGreenberg, RN, Elmer GW, Mulligan ME. Diarréia Clostridium difficile recorrente: características e fatores de risco para pacientes inscritos em um estudo prospectivo, randomizado e duplo-cego. Clin Infect Dis. 1997;24:324-33.
- Dallal RM, Harbrecht BG, Boujoukas AJ, et al. Fulminant Clostridium difficile: uma causa subapreciada e crescente de morte e complicações. Ann Surg. 2002;235:363-72.
- Morris AM, Jobe BA, Sontey, M, Sheppard BC, Deveney CW, Deveney KE. Clostridium difficile colitis: uma doença iatrogênica cada vez mais agressiva? Arch Surg. 2002;137:1096-100.
- Eggerston L, Sibbald B. Hospitais que lutam contra surtos de C. difficile. CMAJ. 2004;171:19-21.
- Valiquette L, Low DE, Pepin J, McGeer A. Infecção por Clostridium difficile nos hospitais: uma tempestade cervejeira. CMAJ. 2004;171:27-9.
- McDonald LC, Killgore GE, Thompson A, et al. Emergência de uma estirpe epidémica de Clostridium difficile nos Estados Unidos, 2001-4: Potencial papel dos factores de virulência e dos traços de resistência antimicrobiana. Sociedade de Doenças Infecciosas da América 42º Encontro Anual. Boston, MA, 30 de setembro – 3 de outubro de 2004. Resumo # LB-2.
- Flegel W, Muller F, Daubener W, Fischer HG, Hadding U, Northoff H. Resposta de citocinas por monócitos humanos à toxina Clostridium difficile A e toxina B. Infect Immun. 1991;59:3659-66.
- Castagliuolo I, Keates A, Qiu B, et al. Aumento da resposta da substância P nos gânglios radiculares dorsais, macrófagos intestinais durante a toxina Clostridium difficile A enterite em ratos. Proc Natl Acad Sciad U S A. 1997;94:4788-93.
- Castagliuolo I, Keates A, Wang C, et al. Clostridium difficile toxin A estimula a produção de proteína-2 macrófago-inflamatória nas células epiteliais intestinais de ratos. J Immunol. 1998;160:6039-45.
- Kelly C, Chetham S, Keates S, et al. Survival of anti-Clostridium difficile bovine immunoglobulin concentrate in the human gastrointestinal tract. Quimioterapia Antimicrobiana. 1997;41:236-41.
- Salcedo J, Keates S, Pothoulakis C, et al. Intravenous immunoglobulin therapy for severe Clostridium difficile colitis. Intravenosa. 1997;41:366-70.