Glycogen e amido, polímeros de glucose do tamanho de megadalton, são o principal reservatório de energia disponível e compostos de carbono na maioria dos organismos vivos. Nos mamíferos, a absorção e utilização da glicose estão sob controlo apertado. Os defeitos no manuseio normal da glicose estão associados a uma variedade de patologias humanas, como doenças de armazenamento do glicogênio e diabetes, nas quais a hiperglicemia persistente está correlacionada com um início precoce e o aumento da gravidade da doença. As vias metabólicas para a conversão catalítica do glicogênio envolvem várias enzimas, entre estas a glicogênio sintase catalisa o alongamento, e a glicogênio fosforilase a degradação, de glucanos ligados a(1,4)-linked glucans. Uma grande riqueza de informações tem sido obtida sobre a degradação do glicogênio através dos estudos bioquímicos e estruturais de glicogênio e maltodextrinas fosforilases nos últimos 30 anos. Estes estudos demonstraram que a regulação da glicogênio fosforilase é um exemplo fascinante de alosterismo covalente e não covalente, primorosamente coordenado pelo controle hormonal. Informações descrevendo as estruturas terciária e quaternária estão agora disponíveis para praticamente todas as enzimas diretamente envolvidas no processamento do glicogênio. Surpreendentemente, muito pouca informação estrutural tem sido relatada sobre a glycogen synthase, que catalisa o alongamento do glicogênio através da adição sucessiva de ![]() -(1,4)-linked glucose residues to the polymer’s non-reducing end, usando ADP/UDP-glucose como doador de glicose.
-(1,4)-linked glucose residues to the polymer’s non-reducing end, usando ADP/UDP-glucose como doador de glicose.
Determinamos agora a estrutura cristalina da glicogênio sintetase de Agrobacterium tumefaciens (AtGS) com resolução de 2,3 Å, tanto na sua forma como na presença de ADP. Os dados foram coletados no ID29, e a estrutura resolvida usando a técnica do SAD (difração anômala de comprimento de onda único), seguida por procedimentos de modificação de densidade. A proteína é encontrada como um dímero na unidade assimétrica, com cada monómero composto por dois domínios ‘Rossmann-fold’ (Figura 81) que estão organizados como nas estruturas de glicogénio fosforilase e outras transferências de glicogénio da superfamília GT-B. Uma fissura profunda entre os dois domínios contém o centro catalítico. Uma grande diferença entre as síntases glicogénicas de mamíferos (família GT3) e bactérias (GT5), é que apenas as enzimas GT3 são fortemente reguladas pela fosforilação e modulação alostérica não covalente. De acordo com a estrutura baseada em alinhamentos de sequências múltiplas entre GT3, GT5 e sequências de glicogénio fosforilase, os locais reguladores da fosforilase na glicogénio sintetase humana estão provavelmente localizados nas inserções terminais N-terminal de 25-resíduos e C-terminal de 120-resíduos, fora do núcleo não regulado de GT-B de glicogénio sintetase bacteriana. Estudos de mutagênese identificaram previamente dois aglomerados de Arg Arg em enzimas GT3 conservadas como parte do(s) sítio(s) alostérico(s) tanto para os resíduos fosfo-Ser/Thr quanto para o ativador não covalente Glc-6P. Os resíduos equivalentes em AtGS estão localizados em uma extremidade do domínio C-terminal, longe do centro de reação, indicando um efeito regulador de longa distância.
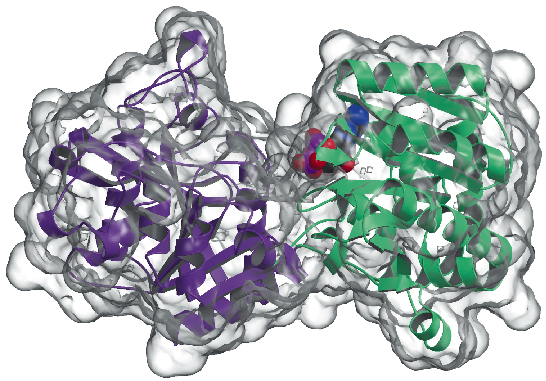
Fig. 81: Estrutura de síntese do glicogênio: a superfície acessível ao solvente é representada em transparente. Note a molécula ADP ligada (desenhada como esferas VDW).
A estrutura do AtGS mostra uma surpreendente semelhança topológica com as estruturas centrais de glicogênio/maltodextrina fosforilases (família GT35) (Figura 82a), embora as identidades de seqüência sejam baixas (~14%). A estrutura de cada domínio Rossmann-fosforilases da família AtGS é significativamente mais próxima das fosforilases da família GT35 do que de qualquer outra glicosil transferase dependente de nucleotídeos. A glicosil transferase e as fosforilases também apresentam uma forte semelhança em seus locais catalíticos (Figura 82b). A ribose ADP e os grupos piridoxal encontram-se em posições equivalentes, assim como o fosfato distal de ADP em AtGS e o substrato inorgânico de fosfato em fosforilases. Além disso, também são conservados aminoácidos críticos que interagem com as moidades da glicose dos substratos. O mecanismo catalítico utilizado pelas síntases glicogênicas e fosforilases é, portanto, provavelmente similar, com mudanças sutis na estrutura explicando suas diferentes propriedades funcionais gerais.
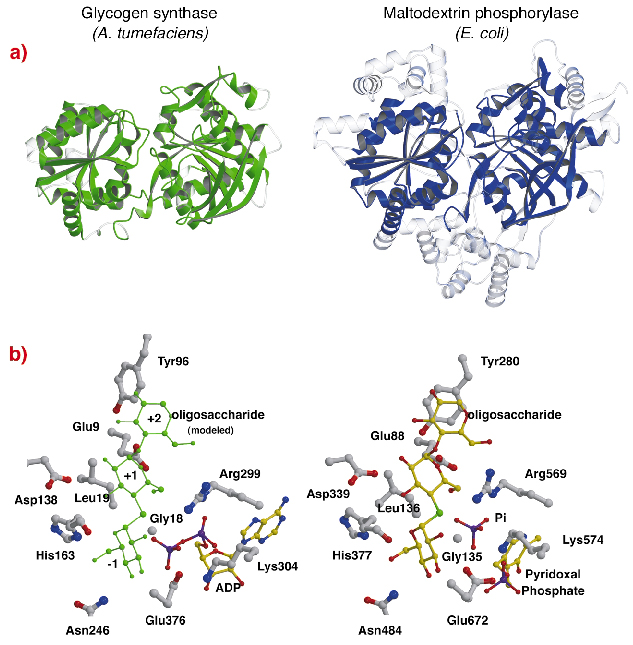
Fig. 82: Homologia à glicogênese fosforilase: (a) após alinhamento estrutural, os resíduos equivalentes sobrepostos entre AtGS e E. coli maltodextrina-fosforilase MalP, são representados em material sólido (regiões não alinhadas, em transparente); (b) os locais catalíticos de AtGS e MalP.
A sugestão inicial de que a síntese de glicogênio simplesmente representava uma reversão de sua fosforólise degradativa foi demonstrada como falha, pois Leloir mostrou que a UDP-Glc e a glicogênio sintetase, não a Glc-1-P e a glicogênio fosforilase, foram responsáveis pelo alongamento do polissacarídeo. Nosso trabalho agora demonstra, entretanto, que as reações independentes opostas na interconversão glucose-glicogênio são catalisadas por enzimas homólogas relacionadas com o fechamento.