Mecanismos explicam a Regioselectividade
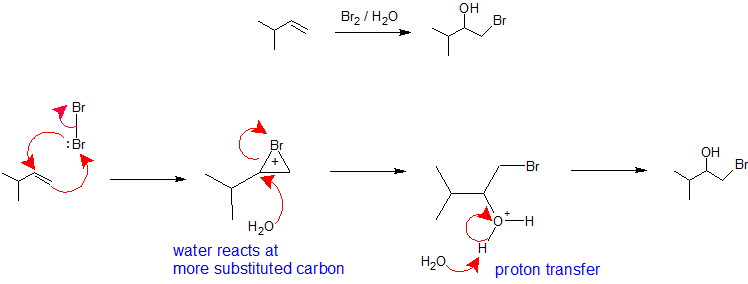
X2/H2O ou X2/ROH: A regiolectividade da formação de haloidrinas a partir de uma reacção alcalina com um halogéneo num solvente nucleofílico é análoga à via de oximerização-demercuração. A molécula halógena assume o papel de eletrofílicos que aceitam os píons nucleofílicos do alqueno e ao mesmo tempo formam uma ligação com o outro carbono vinílico para criar um íon de bromônio (ou cloroium). A formação do íon bromônio (ou clorônio) estabiliza a carga positiva e previne a rearranjo do carbocal. O solvente assume o papel do nucleófilo porque está presente é uma percentagem muito maior do que o grupo de saída e reage com o carbono mais substituído do íon bromônio (ou clorônio) cíclico para criar a regioquímica. A estereoquímica desta reação é antiadição porque o solvente se aproxima do íon bromônio com orientação para o lado posterior para produzir o produto de adição. No entanto, como a interação do halogênio com o alceno pode ocorrer por cima ou por baixo, não há controle estereoquímico nesta reação e uma mistura de enantiômeros será produzida quando aplicável. A etapa final deste mecanismo é uma transferência de prótons para uma molécula de água solvente para neutralizar o produto de adição.
HOX ou RSCl: A regioselectividade dos ácidos hipoalinos e reacções de cloreto de sulfenil pode ser explicada pelo mesmo mecanismo que usámos para racionalizar a regra de Markovnikov. A ligação de uma espécie eletrofílica à dupla ligação de um alqueno forma preferencialmente para produzir a carbonização mais estável (mais altamente substituída). Este intermediário deve então combinar rapidamente com uma espécie nucleófila para produzir o produto de adição.
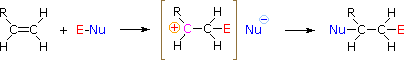
Para aplicar este mecanismo precisamos determinar a meação eletrofílica em cada um dos reagentes. Utilizando diferenças de eletronegatividade podemos dissecar reagentes de adição comum em loites eletrofílicas e nucleofílicas, como mostrado à direita. No caso dos ácidos hipocloroso e hipobrómico (HOX), estes ácidos Brønsted fracos (pKa’s ca. 8) não reagem como doadores de prótons; e como o oxigénio é mais electronegativo que o cloro ou o bromo, o electrofilo será um catião haleto. As espécies nucleófilas que se ligam à carbonização intermediária são então o íon hidróxido, ou mais provavelmente água (o solvente usual para estes reagentes), e os produtos são chamados de haloidrinas. Os cloretos de sulfenil acrescentam de forma oposta porque o eletrofilo é um cátion de enxofre, RS(+), enquanto que a fracção nucleofílica é o ânion cloreto (o cloro é mais eletronegativo que o enxofre).
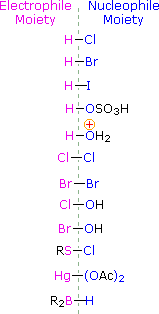
Abaixo estão alguns exemplos que ilustram a adição de vários reagentes halógenos eletrofílicos a grupos alcenos. Observe a regioquímica específica dos produtos, como explicado acima.
Exercício
1. Prever o produto da seguinte reacção:

>2. Quando o buteno é tratado com NBS na presença de água, o produto mostra que o bromo está sobre o carbono menos substituído, é este Markovnikov ou anti-Markovnikov?
Resposta

2. Como o bromo é a primeira adição ao alceno, esta adição seria uma adição anti-Markovnikov.
Contribuintes
-
Prof. Steven Farmer (Sonoma State University)
-
William Reusch, Professor Emérito (Michigan State U.), Virtual Textbook of Organic Chemistry