- O que faz uma molécula polar?
- Dê uma olhada na fórmula estrutural do dióxido de carbono:
- Por que a água é polar?
A água é uma molécula polar porque o seu oxigénio é fortemente electronegativo e, como tal, puxa o par de electrões na sua direcção (longe dos dois átomos de hidrogénio), adquirindo assim uma carga ligeiramente negativa.
A polaridade de uma molécula depende não só dos seus átomos constituintes, mas também da forma como estes estão dispostos em torno do átomo central, ou seja, da disposição espacial desses átomos. Para melhor compreender isto, vamos discutir o tópico em mais detalhe.
O que faz uma molécula polar?
A polaridade de uma molécula está relacionada com o deslocamento de electrões numa determinada direcção. Isto, por sua vez, depende da polaridade das ligações presentes na molécula, pois estas ligações também contêm electrões.
Em uma molécula, o átomo com a maior potência para atrair electrões para si próprio (ou seja é mais electronegativo que o outro átomo) adquirirá uma ligeira carga negativa sobre si mesmo, e a ligação entre os dois átomos tornar-se-á polar.
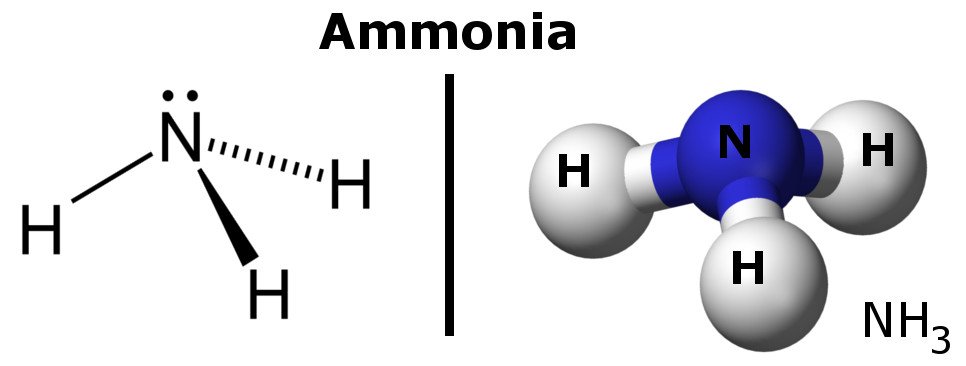
Amonia é uma molécula polar porque tem regiões de ligeiras cargas negativas e positivas.
Em suma, pode-se dizer que a densidade de elétrons de uma ligação polar se acumula em uma extremidade da ligação, o que resulta em que essa extremidade possui uma leve carga negativa, enquanto a outra extremidade possui uma leve carga positiva. Isto torna uma molécula polar.
Likewise, se uma molécula não tem regiões de carga positiva e negativa, é considerada não polar.
No entanto, uma coisa interessante a notar é que quanto maior a diferença de electronegatividade, mais polar será a ligação dentro de uma molécula. Os compostos carbonílicos são polares porque o carbono carbonílico é ligeiramente positivo. Assim, o dióxido de carbono, que contém um carbono positivo e dois oxigenados parcialmente negativos, não deveria ser polar?
Bem, o dióxido de carbono consiste em dois átomos de oxigénio ligados a um átomo de carbono. Os átomos de oxigénio são muito mais electronegativos do que os átomos de carbono e, como tal, devem conter uma carga parcialmente negativa, enquanto que o átomo de carbono deve ser ligeiramente carregado positivamente. Entretanto, curiosamente, isso não acontece.
Dê uma olhada na fórmula estrutural do dióxido de carbono:
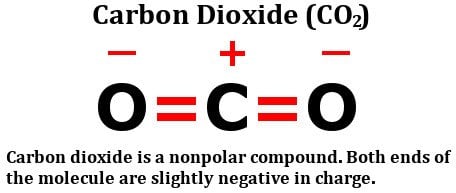
Consiste em dois átomos de oxigênio igualmente eletronegativos, sim, mas veja como esses átomos estão dispostos em torno do átomo de carbono. Ambos estão em perfeito ângulo de 180 graus em relação ao carbono. Consequentemente, eles puxam a densidade de elétrons do carbono com igual força em direções opostas. O resultado líquido é que a densidade de elétrons no átomo de carbono permanece inalterada, o que torna a molécula de dióxido de carbono não polar.
O dióxido de carbono é um grande exemplo de como a geometria de uma molécula desempenha um papel crucial na determinação se ela é polar ou não polar. Agora, vejamos uma molécula de água:
Por que é a água polar?
A fórmula química da água é H20, o que significa que contém dois átomos de hidrogénio e um átomo de oxigénio. Os átomos de hidrogénio consistem em apenas um electrão na sua casca, enquanto que o átomo de oxigénio tem 6 electrões de valência.
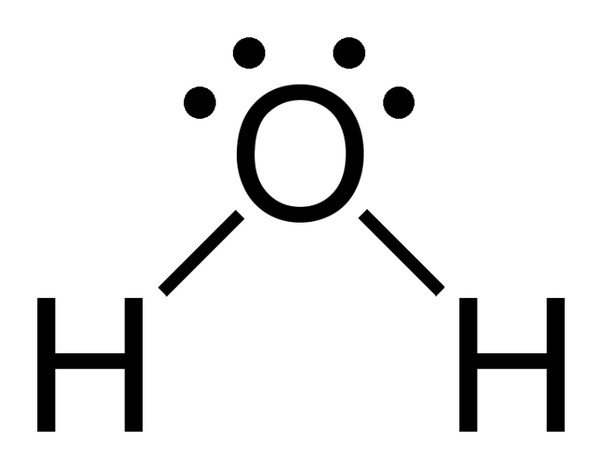
Notem os 2 pares únicos de electrões no átomo de oxigénio na água.
Posto que o oxigénio tem 6 electrões na sua casca de valência, partilha um electrão com cada átomo de hidrogénio. Desta forma, ele fica com 4 elétrons sem ligação em seus 2 orbitais. Estes pares de electrões ligados e não ligados organizam-se em forma tetraédrica em torno do oxigénio, razão pela qual as duas ligações parecem ter uma forma dobrada.
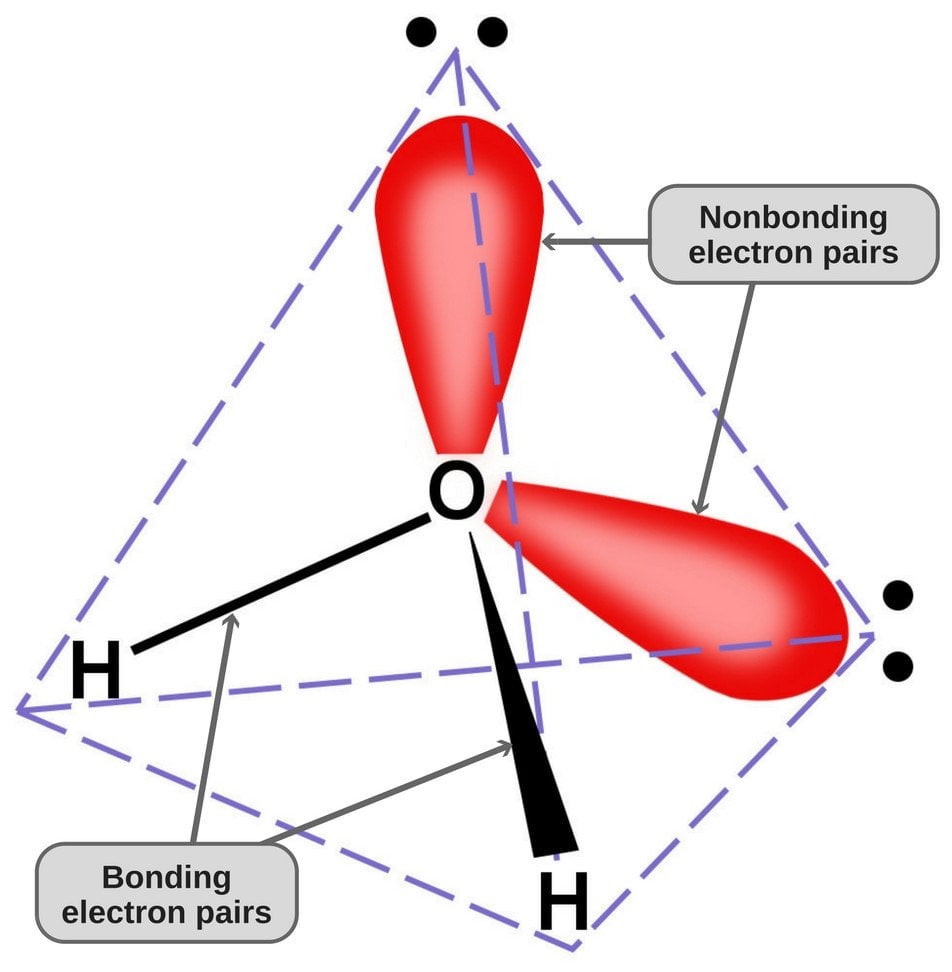
A geometria tetraédrica da molécula da água.
Agora, ambos os átomos de oxigénio e hidrogénio têm diferentes electronegatividades (o valor de electronegatividade do hidrogénio é 2,1, enquanto a electronegatividade do oxigénio é 3,5); portanto, ambas as ligações são polares. Uma vez que o oxigénio é mais electronegativo que o hidrogénio, a densidade dos electrões desloca-se para o oxigénio em ambas as ligações, tornando assim a região em redor do oxigénio mais negativa que as áreas em redor dos dois átomos de hidrogénio.
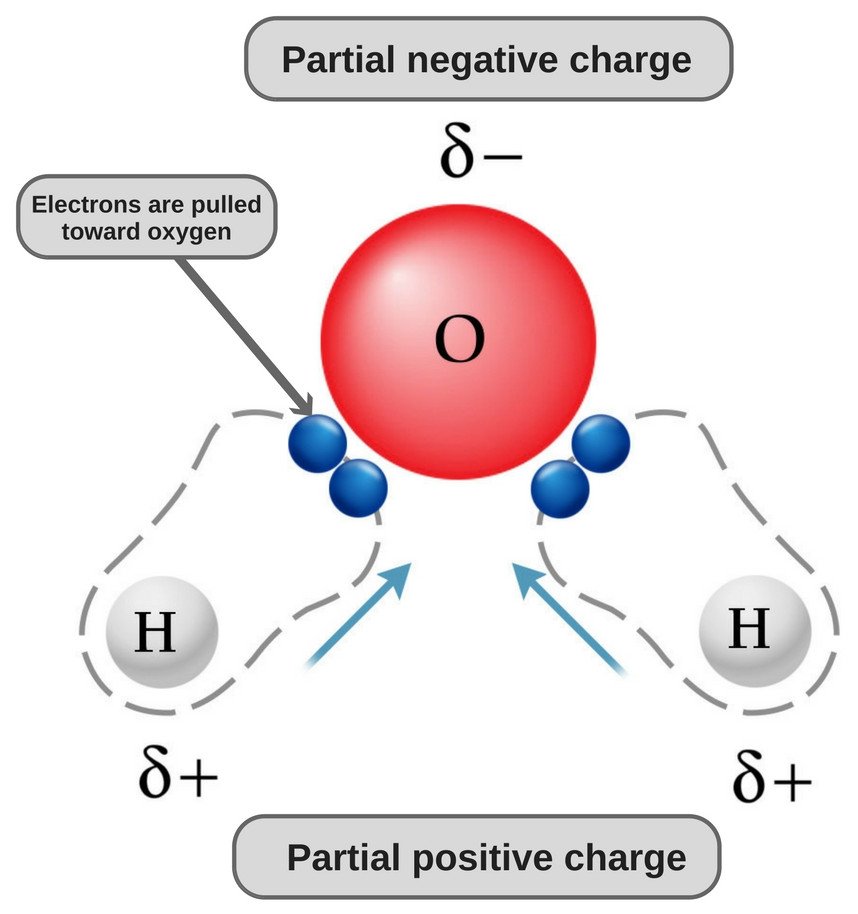
É por isso que a molécula da água se torna polar!