Abstract
Arsen stymuluje proliferację przy niskich poziomach i hamuje wzrost komórek przy wysokich stężeniach, wykazując dwufazowy wpływ na proces biologiczny. Efekt dwufazowy wymaga, aby stężenie arsenu było utrzymywane na odpowiednim progu w celu zahamowania wzrostu komórek nowotworowych podczas chemioterapii. Apoptoza może być pierwotnym mechanizmem związanym z podwójnymi właściwościami arsenu.
Słowa kluczowe
arsen, efekt dwufazowy, arsenizm endemiczny, kancerogeneza, chemioterapia
Szacunki
- Arsen jest kancerogenem, który może stymulować proliferację komórek przy niskich poziomach.
- Arsen jest również supresorem raka, który hamuje wzrost komórek w wysokich stężeniach.
- Biologiczna rola arsenu pokazuje dwufazowy wpływ na wzrost komórek.
- Apoptoza może być potencjalnym mechanizmem związanym z podwójnymi właściwościami arsenu.
Komentarz
Pierwiastek arsen (As) jest szeroko rozpowszechniony w przyrodzie, który często łączy się z tlenem lub siarką tworząc związki. Arsen jest ściśle związany z procesem biologicznym, jak również. Jego cechy patofizjologiczne są włączone do następujących aspektów: (a) arsen w niskich dawkach stymuluje proliferację komórek i kancerogenezę. Kiedy arsenian sodu został wykorzystany do leczenia ludzkich komórek nowotworowych HepG2 lub nienowotworowych hepatocytów HHI-5, stwierdziliśmy, że odsetek śmierci komórek był ujemny w fazie początkowej, co oznacza, że arsenian w niskich dawkach promuje wzrost komórek (rysunek 1). Arszenik mógł zwiększyć żywotność komórek w wąskim zakresie niskich stężeń. Jak poziom arsenitu został zwiększony, aby osiągnąć punkt krytyczny, zaczął hamować proliferację i przyspieszyć śmierć komórek. Ten spójny wynik został również zgłoszony przez inne badania. W różnych regionach geologicznych, stężenie arsenu w wodzie pitnej przekracza standardową zawartość (0.01mg/L) zalecaną przez Światową Organizację Zdrowia. Lokalni mieszkańcy, którzy piją wodę wzbogaconą arsenem, cierpią na endemiczny arsenizm. Częstość występowania raka różnych narządów (np. skóry, płuc, nerek, pęcherza moczowego, wątroby i tak dalej) w obszarach endemicznych jest znacznie wyższa niż w regionach nieendemicznych. Arsen został zidentyfikowany jako czynnik rakotwórczy dla ludzi przez Międzynarodową Agencję Badań nad Rakiem; b) wysokie stężenie arsenu hamuje wzrost komórek. W praktyce klinicznej, związki arsenu (tj. As2O3, As2S2, itp.) są powszechnie stosowane do zabijania komórek nowotworowych podczas chemioterapii. Ponadto, arsenek był lekiem pierwszego rzutu w leczeniu niektórych nowotworów, takich jak białaczka i lite nowotwory trzewne. Czasami, związki arsenu są stosowane w połączeniu z innymi lekami w celu uzyskania najlepszego efektu terapeutycznego. Arsenek nie tylko indukuje rozwój guza, ale także zabija komórki nowotworowe jako podstawowy lek w leczeniu klinicznym. Arszenik ma podwójne właściwości: kancerogenne i supresorowe. Tak więc, nowe pojęcie „efekt dwufazowy” jest proponowany do opisania jego dwukierunkowej roli w rozwoju komórek.
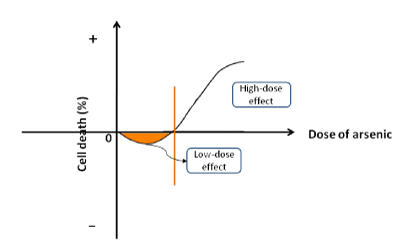
Figura 1. Schemat efektu dwufazowego. Arszenik stymuluje proliferację komórek w niskich dawkach, natomiast przyspiesza śmierć komórek w wysokich stężeniach
Jaki jest dokładny mechanizm, który powoduje podwójne właściwości arsenu? Obecnie nie ma jednoznacznej odpowiedzi na to pytanie. Jednak dostępne dane potwierdzają, że apoptoza odgrywa kluczową rolę. Apoptoza jest kontrolowanym przez geny, energochłonnym, samobójczym procesem mającym na celu utrzymanie struktury tkanki. Równowaga pomiędzy kompetencjami apoptotycznymi i antyapoptotycznymi nie tylko decyduje o żywotności komórek, ale także bezpośrednio wpływa na funkcję tkanek. Do tej pory apoptoza była uważana za podstawowy mechanizm łączący kancerogenezę i supresję nowotworów. Inhibitor białek apoptozy (IAPs) pełni potężną funkcję w regulacji przeżycia komórek i kontroli kaskady apoptozy. Ponadto, ekspresja IAPs jest modulowana przez wiele czynników jądrowych, takich jak NF-kappa B, FoxA2, C/EBP-beta i tak dalej. Związek między arsenem a apoptozą jest wart dokładnego zbadania. Potrzebujemy więcej dowodów, aby wykazać, że (a) arsen w małych dawkach hamuje apoptozę i stymuluje proliferację komórek. Dobrze wiadomo, że kancerogeneza musi pokonać opór apoptozy; (b) arsen w dużych dawkach wyzwala apoptozę i zabija komórki nowotworowe. Podstawową strategią leczenia raka jest indukowanie apoptozy komórek nowotworowych. Uzasadnioną hipotezą jest, że arszenik hamuje apoptozę w niskich stężeniach, natomiast promuje apoptozę w wysokich stężeniach. It is also speculated that IAPs and their regulatory network may be responsible for the dual properties of arsenide.
An exploration on biphasic effect of arsenic (arsenide) has special significance in clinical treatment of the cancer. Gdy związek arsenu podawany jest razem z innymi lekami, dawka związków arsenu jest często zmniejszana. Ze względu na podwójne właściwości arsenu, należy ocenić wartość leczniczą związku arsenu przy łącznym stosowaniu leków. W tej chwili miejscowe stężenie arsenku musi być utrzymywane na określonym poziomie, aby indukować apoptozę komórek nowotworowych. W przeciwnym razie arsenek może promować proliferację komórek nowotworowych. Nie ma wtedy żadnego efektu terapeutycznego, a wręcz przeciwnie. Dlatego też musimy rozważyć dwukierunkową odpowiedź arsenku, zwłaszcza w połączeniu z innymi lekami. Jaki jest dokładny próg dla arsenku, aby zahamować nowotwór? Jak podawać arsenek, aby osiągnąć stężenie progowe i utrzymać je na stałym poziomie? Jakie biomarkery są sensowne do monitorowania stężenia arsenku we krwi? Do tej pory nie znaleziono odpowiedzi na powyższe pytania. Biologiczna charakterystyka arsenu stwarza również nowe zagadnienie dla toksykologii. W tradycyjnej definicji toksykologii za zachowanie toksyczne uważa się zwykle zabijanie komórek lub zwiększanie szybkości ich umierania. Jednak zwiększanie proliferacji komórek nowotworowych jest również toksyczne dla organizmu. Tak więc zachowanie arsenu w niskich dawkach jest kolejnym aspektem toksykologii. Być może można to określić jako toksykologię odwrotną lub toksykologię odwrotną. Obecnie pracujemy nad markerami molekularnymi, które pozwolą oszacować stężenie arsenu we krwi i ocenić jego efekt terapeutyczny. Białaczka i guzy lite mogą wymagać różnych stężeń leków arsenowych (4). Badania kliniczne na dużych próbkach są potrzebne, aby sprawdzić prawdziwą rolę arsenku w leczeniu różnych nowotworów. Ponadto, kwantyfikacja stanu funkcjonalnego komórek jest obecny focus.
Podsumowując, arsen ma dwufazowy wpływ na wzrost komórek, co objawia się proliferacji na niskich poziomach i hamowania w wysokich stężeniach. Ze względu na dwufazowy efekt, próg stężenia arsenu musi być utrzymywany w celu zabicia komórek nowotworowych podczas leczenia raka. W przeciwnym razie, arsenek może stymulować proliferację komórek nowotworowych, osiągając efekt odwrotny do zamierzonego. Wstępne badania ujawniają, że antyapoptotyczna rodzina IAPs i jej sieć regulacyjna odgrywają ważną rolę w biologii arsenu. Apoptoza może być istotnym mechanizmem związanym z podwójnymi właściwościami arsenu.
Deklaracja interesów
Autorzy nie mają nic do ujawnienia.
Podziękowania
Ta praca była wspierana przez „The National Natural Science Foundation of China”, numer projektu 81773367. We thank professor Yang Jianbo’s suggestion and advice in the preparation of manuscript.
- Yedjou C, Tchounwou P, Jenkins J, McMurray R (2010) Basic mechanisms of arsenic trioxide (ATO)-induced apoptosis in human leukemia (HL-60) cells. J Hematol Oncol 3: 28.
- Tseng CH, Chong CK, Tseng CP, Centeno JA (2007) Blackfoot disease in Taiwan: its link with inorganic arsenic exposure from drinking water. Ambio. 36: 82-84.
- Smith AH, Marshall G, Roh T, Ferreccio C, Liaw J, et al. (2018) Lung, bladder, and kidney cancer mortality 40 years after arsenic exposure reduction. Journal of the National Cancer Institute 110: 241-249.
- Gill H, Yim R, Lee HKK, Mak V, Lin SY, et al. (2018) Long-term outcome of relapsed acute promyelocytic leczone doustnymi schematami reindukcji i podtrzymania opartymi na trójtlenku arsenu: 15-letnie badanie prospektywne. Cancer 124: 2316-2326.
- Varfolomeev E, Blankenship JW, Wayson SM, Fedorova AV, Kayagaki N, et al. (2007) IAP antagonists induce autoubiquitination of c-IAPs, NF-kappaB activation, and TNFalpha-dependent apoptosis. Cell 131: 669-681.
.