Immunofluorescencja (IF) jest powszechnym podejściem morfologicznym stosowanym do określania dystrybucji składników subkomórkowych. Przeciwciała, które są sprzężone z barwnikami fluorescencyjnymi są wymagane w IF assay. Przeciwciało specyficznie rozpoznaje antygen poprzez wiązanie się z epitopem celu, a fluorofor zostanie wykryty pod mikroskopem fluorescencyjnym. W ten sposób składniki subkomórkowe mogą być wizualizowane w ciemnym tle. IF może być również stosowany jako alternatywna metoda analizy półilościowej do monitorowania ekspresji zainteresowania.
Są trzy rodzaje IF: IF bezpośredni, IF pośredni i IF łączony.
IF bezpośredni wykorzystuje pojedyncze przeciwciało pierwotne, które jest sprzężone z barwnikiem fluorescencyjnym.
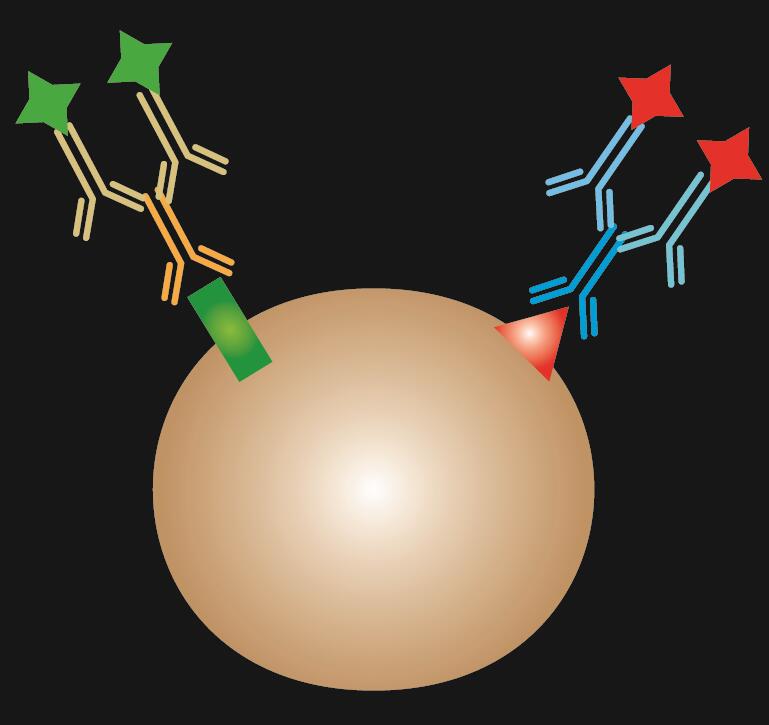
Pośredni IF wykorzystuje dwa przeciwciała do barwienia: przeciwciało pierwotne, które specyficznie wiąże się z epitopem i dopasowane przeciwciało wtórne sprzężone z barwnikiem fluorescencyjnym.
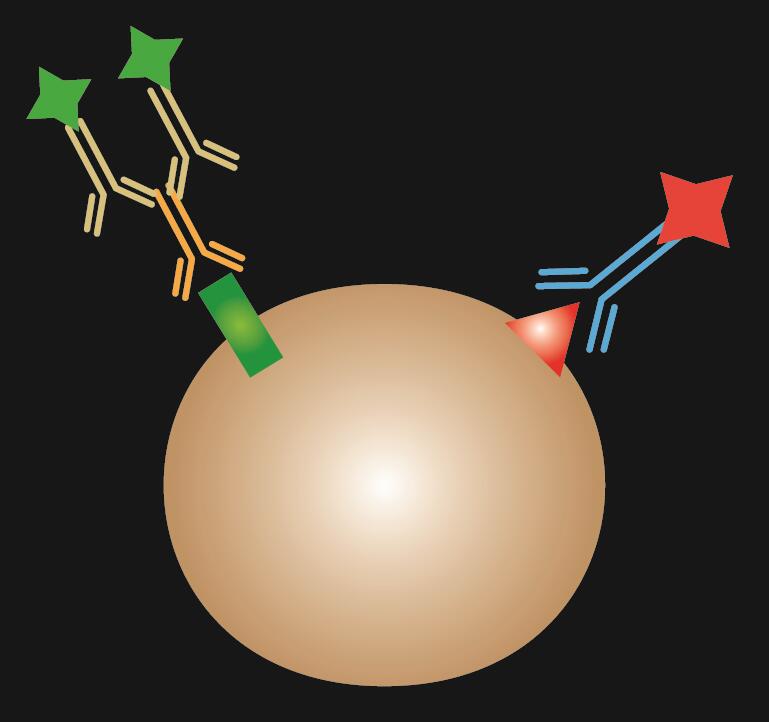
Połączony IF jest kombinacją barwienia bezpośredniego i pośredniego IF.
Tabela 1. Porównanie IF bezpośredniego, pośredniego i kombinowanego.
| Typ IF | Direct | Indirect | Combined | |
|---|---|---|---|---|
| Schemat | 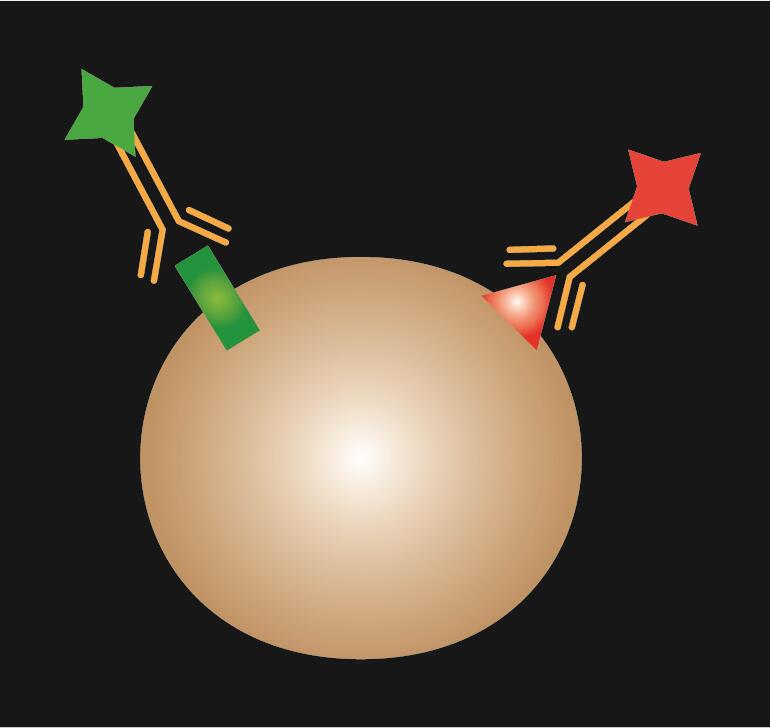 |
.  |
 |
|
| Zalety |
|
|
|
|
| Wady |
|
|
|
Pośród trzech typów IF, najbardziej popularna jest metoda IF pośredniego.
- Zbieranie i utrwalanie próbek
Próbki muszą być utrwalone szybko po usunięciu tkanki, a u małych zwierząt, takich jak gryzonie, lepiej jest przeprowadzić wstępne utrwalenie poprzez infuzję serca z 4% formaldehydem lub paraformaldehydem. Zaleca się, aby tkanki nie były grubsze niż 10 mm, a objętość utrwalacza powinna być co najmniej 15-20 razy większa niż objętość tkanki. Utrwalanie jest bardzo ważne dla zachowania morfologii i struktury komórki, jak również integralności antygenu. Dlatego roztwory utrwalające muszą być starannie dobrane w zależności od różnych antygenów i próbek tkanek.
Tabela 2. Strategia utrwalania dla antygenów częściowych.
| Antygen | Roztwór utrwalający | Warunki utrwalania |
|---|---|---|
| Większość białek | 95~100% alkohol 4% paraformaldehyd |
3~10 min w temp. 37℃ 4~24 godz. w temp. 4℃ |
| Enzym | Aceton | 15 min w temp. |
| Hormon | 95% alkohol plus 1~5% lodowaty kwas octowy | 30 min przy 4℃ |
| Immune globulin | 95% alkohol Carbon tetrachlorek węgla |
10 min w temperaturze 37℃ następnie 15 min w temperaturze 4℃ |
| Białko włókniste | 95% alkohol plus 1~5% lodowaty kwas octowy | 10 min w 37℃ następnie 15 min w 4℃ |
| Wirus | Aceton Cetrachlorek węgla Alkohol |
5~10 min w RT następnie 30~60 min w 4℃ |
| Polisacharyd i bakterie | Aceton 10% formaldehyd Metanol |
3~10 min przy RT następnie 30~60 min przy 4℃ |
| Lipoid | 10% formaldehyd | 3~10 min w RT |
| Komórka hodowlana | Ogrzewany 4% paraformaldehyd | 15~20 min at RT |
- Odwodnienie i osadzanie
Odwodnienie jest wymagane podczas przygotowywania wycinków tkankowych z następujących powodów:
1. Sekcja parafinowa: Parafina jest niemieszalna z wodą.
2. Sekcja mrożona: Rozmrożone kryształy lodu zniszczyłyby morfologię komórek.
Odwodnienie jest zawsze wykonywane przez zanurzenie tkanki w poważnym roztworze etanolu o wzrastającym gradiencie lub roztworze sacharozy.
Potem próbki tkanek mogą być osadzane przez dodanie stopionej parafiny dla przekrojów parafinowych, podczas gdy związek OCT jest dodawany dla przekrojów mrożonych. Ten krok zapewnia odpowiednią twardość dla próbek tkanek miękkich i pozwala na łatwe cięcie tkanki.
- Sekcja i barwienie
Zatopione tkanki mogą być sekcjonowane na cienkie plasterki za pomocą mikrotomu lub mikrotomu mrożącego. Grubość plasterków powinna być ustalona w zależności od średnicy komórek i celu badania IF. Cieńsze plasterki (≤10 μm) sugeruje się mocować bezpośrednio na szkiełkach samoprzylepnych przed barwieniem, ponieważ łatwo je uszkodzić w wielokrotnych etapach płukania. Grubsze plasterki (10~30 μm) uzyskają lepsze obrazy przy użyciu metody swobodnego pływania, ponieważ przeciwciało pierwotne może przeniknąć przez obie strony plasterka. Po zabarwieniu swobodnie pływające skrawki są montowane na szkiełkach mikroskopowych. Swobodnie pływające przekroje małych tkanek, takich jak korzeń zwoju grzbietowego myszy (DRG) są trudne do wykonania i łatwo stracić próbkę. W związku z tym, dla niektórych małych próbek tkanek zalecana jest metoda przekrojów lepkich. Etapy barwienia powinny być wykonywane w ciemności, gdy zaangażowane jest przeciwciało sprzężone z barwnikiem fluorescencyjnym.
Sięgnij po protokoły IF:
- Przekrój pałeczkowy
- Przekrój swobodnie pływający
- Komórki hodowlane
- Obrazowanie i analiza
Sygnalizacja pozytywna jest wirtualizowana pod mikroskopem fluorescencyjnym w ciemnym tle. Lokalizacja zainteresowania jest określana zwykle przez współbarwienie białka, którego lokalizacja jest znana. Alternatywnie, ilość komórek pozytywnych lub intensywność fluorescencji pozytywnej sygnalizacji może być mierzona dla analizy ilościowej. Na przykład, silniejsza intensywność fluorescencji odnosi się do względnie wysokiej ekspresji białka docelowego.
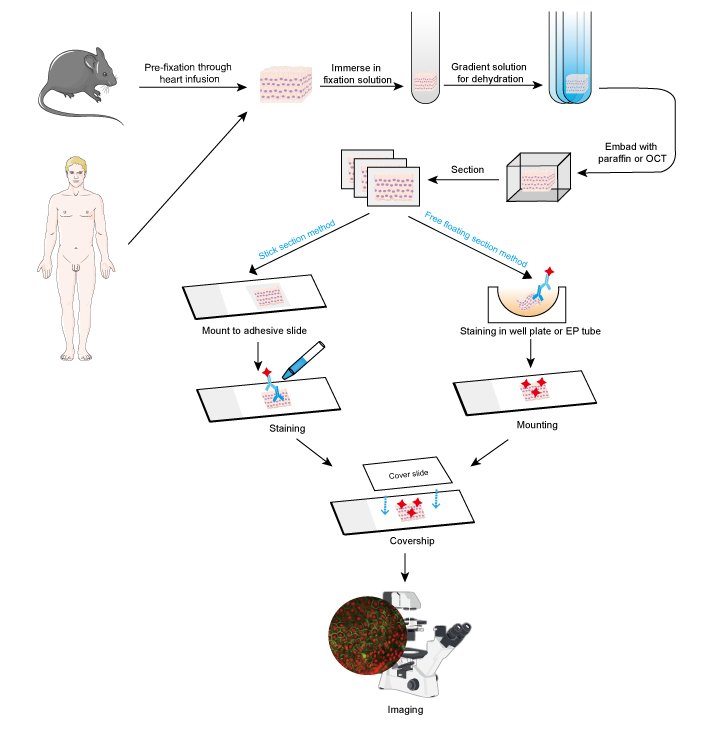
Rysunek 1. Przebieg badania IF na wycinkach tkankowych.
IF i IHC są potężnymi metodami analizy morfologii z ważnymi zastosowaniami diagnostycznymi i prognostycznymi. W Państwa badaniach należy zwrócić uwagę na kilka różnic:
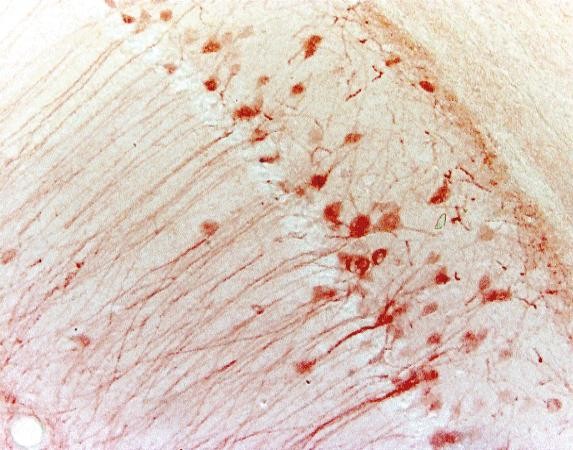
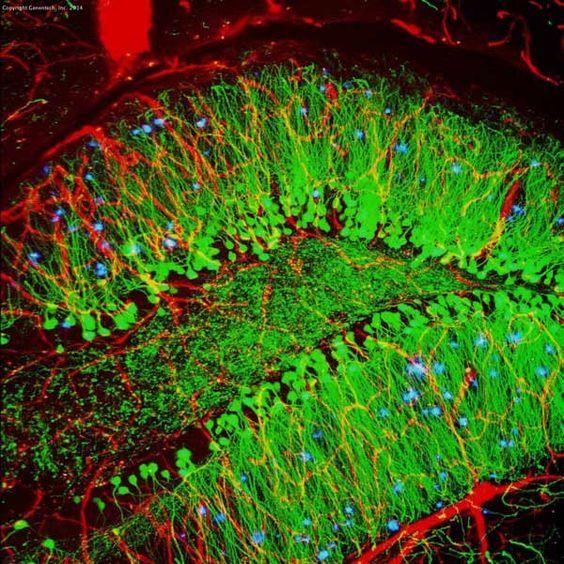
Tabela 3. Porównanie między IHC i IF
| IHC | IF | |
|---|---|---|
| Metoda znakowania | Chromogeniczne | Fluorescencyjne |
| Krok przetwarzania | Więcej jak potrzebny jest substrat | Mniej |
| Obraz |
|
|
| Mikroskop | Mikroskop świetlny | Mikroskop fluorescencyjny |
| Stabilność | Stabilność przez lat | Mniej stabilny z powodu fotobielenia |
| Przykład (hipokamp myszy) |
 |
 |
.