Wprowadzenie
Przewlekła choroba nerek (CKD) wiąże się z wysoką śmiertelnością, szczególnie pochodzenia sercowo-naczyniowego. Jednak ograniczony związek między śmiertelnością a tradycyjnymi czynnikami ryzyka sercowo-naczyniowego u tych pacjentów jest paradoksalny. Wykazano, że tylko niektóre markery związane z zapaleniem lub odżywianiem (np. białko C-reaktywne i albuminy w surowicy) są stałymi predyktorami śmiertelności w CKD.1
W ostatnich latach w niektórych badaniach obserwacyjnych wykazano związek między podwyższonym całkowitym stężeniem fosfatazy alkalicznej (ALP) w surowicy a śmiertelnością u pacjentów z CKD2-5; jednak biologiczne i kliniczne znaczenie tego wyniku pozostaje nieznane.
Gamma-glutamylotransferaza (GGT) jest enzymem obecnym w surowicy i na zewnętrznej powierzchni komórek różnych narządów, takich jak wątroba, trzustka, jelito, płuca i nerki.6 GGT w surowicy jest nie tylko tradycyjnym markerem spożycia alkoholu i chorób wątroby i dróg żółciowych, ale w kilku badaniach wykazano również związek między podwyższonym stężeniem GGT w surowicy a chorobami układu sercowo-naczyniowego, cukrzycą, nadciśnieniem tętniczym i zespołem metabolicznym.7
Jest tylko kilka badań, które analizowały kliniczne i prognostyczne znaczenie GGT w surowicy w CKD.9,10 Celem niniejszej pracy było zbadanie charakterystyki klinicznej pacjentów z CKD z nieprawidłowo podwyższonym stężeniem GGT w surowicy i jego interakcji z ALP oraz określenie wartości tego parametru jako predyktora śmiertelności.
Materiał i metody
Jest to retrospektywne, obserwacyjne badanie przeprowadzone na kohorcie dorosłych pacjentów obserwowanych w poradni niskiego klirensu (zaawansowana CKD) oddziału nefrologii Hospital Infanta Cristina, Badajoz, Hiszpania, od stycznia 2002 roku do października 2013 roku. Do badania włączono wszystkich przeddializacyjnych pacjentów w wieku >18 lat z szacunkowym wskaźnikiem filtracji kłębuszkowej (eGFR)
mL/min/1,73m2. Pacjenci z CKD spowodowaną dysfunkcją przeszczepu nerki nie byli włączeni do badania.
Dane demograficzne i parametry kliniczne, takie jak wiek, płeć, wskaźnik masy ciała (BMI), choroby współistniejące i przyjmowane leki, rejestrowano po włączeniu do badania.
Zachorowalność oceniano za pomocą skali Daviesa,11 a pacjentów klasyfikowano zgodnie z sumą różnych chorób współistniejących: brak chorób współistniejących, łagodna-umiarkowana (1 lub 2 choroby współistniejące) lub ciężka (3 lub więcej chorób współistniejących). Głównymi odnotowanymi chorobami współistniejącymi były: cukrzyca, niewydolność serca, choroba wieńcowa, choroba naczyń mózgowych lub obwodowych, przewlekła obturacyjna choroba płuc, nowotwory i przewlekłe procesy zapalne.
W niniejszym badaniu termin „choroba wątroby” obejmował nie tylko pacjentów, u których rozpoznano przewlekłe choroby wątroby, marskość wątroby lub przeszczep wątroby, ale także pacjentów z aktywnym alkoholizmem lub aktywnym zakażeniem wirusem hepatotropowym (B lub C). Niealkoholowe stłuszczeniowe zapalenie wątroby (choroba stłuszczeniowa wątroby) było częstym wynikiem badania ultrasonograficznego wśród tych pacjentów, chociaż choroba ta nie została uwzględniona w wykazie chorób wątroby.
Pacjenci byli regularnie obserwowani od momentu włączenia do badania aż do śmierci, przeszczepu nerki, utraty do obserwacji lub końca okresu zbierania danych (31 grudnia 2014 r.).
Zważywszy na retrospektywny projekt badania, nie uzyskano indywidualnej świadomej zgody.
Pomiary biochemiczne
Począwszy od stycznia 2002 roku, GGT w surowicy i całkowite ALP zostały dodane do rutynowych pomiarów parametrów biochemicznych u pacjentów z naszej zaawansowanej kliniki CKD.
Poziomy GGT oznaczano za pomocą autoanalizatora (Advia Chemistry, Siemens Healthcare Diagnostics, Nowy Jork, USA) metodą kinetyczno-kolorymetryczną z gamma-glutamylo-3-karboksy-4-nitroanilidem i glicyloglicyną. Współczynnik zmienności wynosi mniej niż 4,5%, a zakres referencyjny 0-36U/L.
Poziomy ALP w surowicy mierzono również za pomocą autoanalizatora (Advia Chemistry), metodą ALPI, która określa aktywność fosfatazy alkalicznej poprzez pomiar transfosforylacji p-nitrofenylofosforanu do p-nitrofenolu w obecności 2-amino-2-metylo-1-propanolu. Współczynnik zmienności był mniejszy niż 4%, a zakres referencyjny wynosił 45-120U/L.
Aby scharakteryzować pacjentów z nieprawidłowo podwyższonym stężeniem GGT lub ALP w surowicy, do badania włączono również podstawowe parametry hematologiczne i biochemiczne (przedstawione w Tabeli 1). Parametry biochemiczne oznaczono przy użyciu konwencjonalnych metod laboratoryjnych (Advia Chemistry, New York, USA). Stężenie hormonu przytarczyc (cząsteczka 7-84) (PTH) oznaczano automatycznym testem immunoenzymatycznym chemiluminescencyjnym (DiaSorin, Włochy), stężenie albumin w surowicy metodą zieleni bromokrezolowej, a stężenie białka C-reaktywnego o wysokiej czułości metodą immunoenzymatyczną chemiluminescencyjną w fazie stałej (Immulite autoanalyser, Diagnostic Product Corporation, Nowy Jork, USA).
Charakterystyka kliniczna i biochemiczna zestawu pacjentów oraz podgrupy w zależności od nieprawidłowo wysokich wartości GGT lub ALP.
| Ogółem | Normalne GGT i ALP | Wysokie GGT | Wysokie ALP | Równocześnie wysokie GGT i ALP | P* | |
|---|---|---|---|---|---|---|
| N Pacjenci | 909 | 596 | 141 | 104 | 68 | |
| . Wiek (lata) | 65 (15) | 66 (15) | 63 (13) | 66 (17) | 66 (14) | 0.234 |
| Płeć, mężczyzna/kobieta | 485/424 | 316/280 | 81/60 | 46/58 | 42/26 | 0.094 |
| Wskaźnik zachorowalności % | ||||||
| Brak | 31 | 37 | 21 | 29 | 9 | |
| Łagodny-.umiarkowane | 52 | 48 | 63 | 59 | 54 | |
| Ciężkie | 17 | 15 | 16 | 12 | 37 | |
| Czynni palacze, % | 15 | 14 | 21 | 10 | 25 | 0.011 |
| Cukrzyca, % | 39 | 35 | 46 | 41 | 50 | 0.013 |
| Choroba wątroby, % | 3 | 2 | 6 | 2 | 10 | |
| Choroba niedokrwienna serca, % | 16 | 14 | 10 | 16 | 38 | |
| Niedokrwienie OUN lub niedokrwienie obwodowe, % | 21 | 19 | 18 | 23 | 34 | 0.031 |
| Niewydolność serca, % | 18 | 16 | 21 | 14 | 37 | |
| BMI, kg/m2 | 29.4 (6) | 29.2 (5.8) | 29.4 (6) | 30.6 (6.7) | 29.4 (5,9) | 0,176 |
| eGFR, mL/min/1,73 m2 | 14,7 (5,1) | 14,8 (5,1) | 14.6 (4.6) | 14.1 (4.4) | 15.6 (6.2) | 0.234 |
| Hemoglobina (g/dl) | 11.4 (1.7) | 11.4 (1.7) | 11.1 (1.7) | 11.4 (1.5) | 11.6 (1.8) | 0.205 |
| Kwas moczowy w surowicy, mg/dl | 7,6 (1,9) | 7,5 (1,9) | 7,9 (2.1) | 7.5 (1.7) | 8.4 (2.4)a | |
| Cholesterol całkowity, mg/dl | 186 (49) | 187 (48) | 191 (56) | 179 (42) | 182 (50) | 0.226 |
| Triglicerydy, mg/dL | 147 (96) | 140 (76) | 167 (133)b | 140 (70) | 171 (163) | 0.003 |
| Albumina surowicy, g/dL | 3.9 (0.5) | 3.9 (0.5) | 3.8 (0.5) | 3.9 (0.5) | 3.8 (0.5) | 0.151 |
| Wapń całkowity w surowicy, mg/dl | 9,1 (0,8) | 9,2 (0.9) | 9.2 (0.7) | 9 (0.9) | 8.9 (0.8) | 0.049 |
| Fosfor w surowicy, mg/dl | 4,7 (1,1) | 4,7 (1) | 4,7 (0,9) | 4,6 (1.2) | 4.6 (1.2) | 0.851 |
| Wodorowęglan surowicy, mEq/L | 21.4 (3.9) | 21.6 (3.8) | 21.2 (3.7) | 20.5 (4.4) | 22.1 (4.5) | 0.026 |
| PTH, pg/mL | 267 (220) | 241 (187) | 234 (184) | 448 (337)c | 281 (195) | |
| ALT, IU/L | 18 (16) | 16 (8) | 25 (23)d | 15 (6) | 30 (39)d | |
| GGT, IU/L | 36 (63) | 18 (8) | 69 (39)d | 19 (8) | 142 (181)d | |
| ALP, IU/L | 99 (52) | 79 (20) | 89 (21) | 163 (67)e | 187 (88)e | |
| Ferrytyna w surowicy, ng/mLg | 173 (247) | 148 (179) | 284 (361)d | 112 (118) | 271 (465)d | |
| Białko C-reaktywne, mg/L | 9.9 (17.3) | 8.5 (15.6) | 14.6 (22.2)f | 6.9 (9.4) | 17.8 (24.2)f | |
| Proteinuria, mg/g kreatyniny | 2462(2787) | 2227(2632) | 2726(3035) | 3023(3314) | 3109(2473) | 0.004 |
| Inhibitory układu renina-angiotensyna, % | 79 | 80 | 78 | 72 | 0.502 | |
| Beta-blokery, % | 26 | 25 | 30 | 22 | 35 | 0.140 |
| Diuretyki, % | 60 | 59 | 62 | 60 | 65 | 0.829 |
| Statyny, % | 53 | 54 | 53 | 55 | 47 | 0.762 |
| Alopurinol, % | 22 | 22 | 25 | 26 | 13 | 0.200 |
| Analogi witaminy D, % | 10 | 10 | 7 | 15 | 9 | 0.201 |
| Leki przeciwpłytkowe, % | 34 | 33 | 28 | 41 | 38 | 0.124 |
Dane przedstawiono jako średnią (odchylenie standardowe), chyba że określono inaczej.
ANOVA lub χ2 między grupami.
P0.05 wysokie GGT-ALP vs. prawidłowe GGT-ALP lub wysokie ALP, test Scheffégo.
P0,05 wysokie GGT vs. prawidłowe GGT-ALP, test Scheffégo.
P0,0001 wysokie ALP vs. prawidłowe GGT-ALP. każda z pozostałych podgrup, test Scheffégo.
P0,0001 wysokie GGT lub wysokie GGT-ALP vs. prawidłowe GGT-ALP lub wysokie ALP, test Scheffégo.
P0,0001 wysokie ALP lub wysokie GGT-ALP vs. prawidłowe GGT-ALP lub wysokie ALP. normalne GGT-ALP lub wysokie GGT, test Scheffé.
P0,001 wysokie GGT lub wysokie GGT-ALP vs. normalne GGT-ALP lub wysokie ALP, test Scheffé.
Dane dostępne dla 845 pacjentów.
Do oszacowania współczynnika filtracji kłębuszkowej (eGFR) zastosowano wzór MDRD-4.12
Ferrytyna sodu była jedynym parametrem, dla którego brakowało wartości. Średnia z dostępnych wartości została uwzględniona w analizie opisowej, ale brakujące wartości nie zostały obliczone, a zmienna ta nie została uwzględniona jako zmienna w analizie przeżycia.
Zmienna wyniku
Zmienną wyniku był zgon z jakiejkolwiek przyczyny. Przyczyny zgonu podzielono na 5 grup: zgon nagły, sercowo-naczyniowy, infekcyjny, nowotwory złośliwe i inne przyczyny.
Analiza statystyczna
Do opisowego porównania zmiennych ciągłych użyto testów parametrycznych lub nieparametrycznych, w zależności od ich charakterystyki, a dla zmiennych kategorycznych zastosowano test Chi-kwadrat. Test Pearsona został użyty do analizy korelacji dwuczynnikowej.
Różnice w przeżyciu między pacjentami w zależności od kwartyli GGT lub ALP analizowano za pomocą krzywych Kaplana-Meiera i porównywano za pomocą testu log-rank Mantela-Haenszela.
Wielowariantowe modele proporcjonalnego zagrożenia Coxa zostały użyte do analizy wpływu wartości wyjściowych GGT i ALP na czas do śmiertelności z wszystkich przyczyn.
Ponieważ wyjściowe poziomy GGT i ALP przedstawiały rozkład dodatnio stronniczy, wartości zostały przekształcone logarytmicznie w celu włączenia jako zmienna ciągła.
Aby uwzględnić różne okresy rekrutacji, modele wielowariantowe zostały również dostosowane zgodnie ze zmienną kategoryczną odpowiadającą okresom rekrutacji (2002-2005, 2006-2009, 2010-2014).
GGT i ALP analizowano jako zmienne ciągłe (transformacja logarytmiczna) oraz jako zmienne kategoryczne: górny kwartyl i wartości nieprawidłowo wysokie (GGT>36IU/L i ALP>120IU/L).
Włączono następujące modele regresji: (1) Univariate. (2). Skorygowane o wiek, płeć, liczbę chorób współistniejących, cukrzycę, choroby wątroby, aktywnego palacza, BMI, wyjściowy eGFR i okres rekrutacji. (3) Skorygowane o te same zmienne, co w modelu 2, plus wapń całkowity, fosfor, PTH, albuminy, białko C-reaktywne, triglicerydy, kwas moczowy i poziom aminotransferazy alaninowej (ALT). (4) Najlepiej dopasowany model przy użyciu procesu warunkowej eliminacji wstecznej.
Założenie proporcjonalnych zagrożeń testowano za pomocą krzywych log-minus-log i reszt Schöenfelda dla każdej zmiennej. Pacjenci byli cenzurowani w momencie zgonu, utraty do obserwacji, przeszczepu nerki lub na końcu obserwacji (31 grudnia 2014 r.), w zależności od tego, co wystąpiło wcześniej.
Dane opisowe przedstawiono jako średnią i odchylenie standardowe lub medianę i zakres międzykwartylowy dla zmiennych ciągłych oraz wartości bezwzględne i procenty dla zmiennych kategorycznych. A p-value
WynikiCharakterystyka pacjentów
Grupa badana obejmowała 909 pacjentów w stadium 4 lub 5 CKD, przed dializą (średni eGFR 14,7±5,1mL/min/1,73m2). Średnia wieku (±SD) wynosiła 65±15 lat, a 53% pacjentów stanowili mężczyźni. Wszyscy byli rasy kaukaskiej. Podstawowe cechy kliniczne i biochemiczne przedstawiono w tabeli 1.
Aby przeanalizować cechy kliniczne i biochemiczne pacjentów w zależności od obecności nieprawidłowo wysokich poziomów GGT lub ALP, pacjentów podzielono na cztery podgrupy (tabela 1): prawidłowe poziomy GGT i ALP (66% pacjentów), wysokie GGT, ale prawidłowe ALP (16%), prawidłowe GGT, ale wysokie ALP (11%) oraz jednocześnie wysokie GGT i ALP (7%).
Tak więc 209 (23%) i 172 (19%) pacjentów miało nieprawidłowo wysokie wyjściowe wartości odpowiednio GGT i ALP. Wartość górnego kwartyla dla GGT i ALP wynosiła odpowiednio 34IU/L i 112IU/L.
Nie było istotnych różnic w średnim wieku i dystrybucji płci w podgrupach. Liczba chorób współistniejących i odsetek aktywnych palaczy był znacznie wyższy u pacjentów z wysokim GGT, zwłaszcza w grupie z jednocześnie wysokim GGT i ALP (Tabela 1). Jednak u około 8% pacjentów z wysokim stężeniem GGT stwierdzono chorobę wątroby.
Częstość występowania chorób układu krążenia u pacjentów z wysokim stężeniem GGT lub wysokim stężeniem ALP była podobna do częstości występowania u pacjentów z prawidłowymi wartościami GGT i ALP, jednak częstość występowania chorób układu krążenia była istotnie zwiększona u pacjentów z jednocześnie wysokim stężeniem GGT i ALP.
Zaobserwowano istotne różnice w parametrach biochemicznych pomiędzy podgrupami (tab. 1). Pacjenci z wysokim GGT mieli wyższe stężenie kwasu moczowego, triglicerydów, ALT, ferrytyny i CRP w surowicy niż pacjenci z prawidłowym stężeniem GGT i ALP lub z samym wysokim ALP. Podgrupa pacjentów z samym wysokim ALP miała wyższe stężenie PTH. Średnie wyjściowe wartości albuminy były podobne wśród podgrup.
Te biochemiczne wzorce związane z GGT lub ALP zostały potwierdzone przez dwuwymiarową analizę korelacji (Tabela 2).
Współczynniki korelacji między parametrami biochemicznymi.
| Log GGTa | Log ALPb | Haemoglobina | Kwas moczowy | Triglicerydy | ALT | Fosfor | Wapń | Ferrytyna | Albumina | PTH | C- | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Log ALPb | 0.337** | ||||||||||||||||||
| Haemoglobina | -0.001 | 0.029 | |||||||||||||||||
| Kwas moczowy | 0.162** | 0.051 | 0.068* | ||||||||||||||||
| Trójglicerydy | 0,164** | 0.011 | 0,063 | 0,083* | |||||||||||||||
| ALT | 0.387** | 0.107** | 0.002 | 0.093** | 0.043 | ||||||||||||||
| Fosfor | -0,013 | 0,024 | -0.092* | 0,075* | 0,020 | 0,026 | |||||||||||||
| Wapń | 0.019 | -0.105** | 0.161** | 0.034 | 0.127** | 0,014 | -0,178** | ||||||||||||
| Ferrytyna | 0.244** | 0.050 | -0.149** | 0.054 | 0.059 | 0.195** | -0.037 | -0,043 | |||||||||||
| Albumina | -0.072* | -0.074* | 0.208** | -0.004 | 0.029 | 0.009 | -0.097** | 0.317** | -0.112** | ||||||||||
| PTH | -0.055 | 0.296** | -0.060 | 0.066* | -0.025 | -0.042 | 0.244** | -0.168** | -0.100** | 0.072* | |||||||||
| Białko C-reaktywne | 0.197** | 0.088** | -0.190** | 0.076* | 0.005 | 0.021 | -0.048 | -0.055 | 0.238** | -0.233** | -0,077* | ||||||||
| eGFR | 0,080* | -0,028 | 0,163** | 0.008 | -0.015 | 0.003 | -0.555** | 0.136** | 0.044 | 0.012 | -0.268** | 0.054 | |||||||
| Proteinuria | 0.098* | 0.131** | -0.055 | -0.081* | 0.161** | 0.077* | 0.207** | -0.250** | 0.005 | -0.534** | 0.065 | 0.005 | -0.158** |
P0.05.
P0,01.
Log-transformowana gamma-glutamylotransferaza.
Log-transformowana fosfataza zasadowa.
Śmiertelność i inne zdarzenia będące przedmiotem zainteresowania
W okresie badania zmarło łącznie 365 pacjentów (40%), z medianą przeżycia dla zbioru pacjentów wynoszącą 74 miesiące (Tabela 3). Zgodnie z oczekiwaniami, najczęstszymi przyczynami zgonów były choroby sercowo-naczyniowe i zakażenia, bez istotnych różnic między podgrupami (Tabela 3).
Śmiertelność i inne zmienne wynikowe będące przedmiotem zainteresowania w grupie ogółem i w podgrupach według GGT i fosfatazy alkalicznej (ALP).
| Ogółem | Normalne GGT i ALP | Wysokie GGT | Wysokie ALP | Wysokie GGT i ALP | |
|---|---|---|---|---|---|
| Mediana czasu przeżycia , miesięcy | 74 | 86 | 61 | 82 | 38 |
| Zgony, N (%) | 365 (40) | 219 (37) | 61 (43) | 46 (44) | 39 (57) |
| Przyczyna zgonu, N (%): | |||||
| Nagły | 58 (16) | 34 (16) | 13 (21) | 5 (11) | 6 (15) |
| Sercowo-naczyniowy | 137 (38) | 82 (37) | 17 (28) | 23 (50) | 15 (39) |
| Zakaźne | 53 (14) | 32 (15) | 9 (15) | 10 (22) | 2 (5) |
| Malignancy | 38 (10) | 24 (11) | 7 (11) | 1 (2) | 6 (15) |
| Inne | 79 (22) | 47 (21) | 15 (25) | 7 (15) | 10 (26) |
| Dializa, N (%) | 526 (58) | 346 (58) | 80 (57) | 67 (64) | 33 (48) |
| Przeszczep nerki, N (%) | 133 (15) | 92 (15) | 20 (14) | 16 (15) | 5 (7) |
| Lost to follow-up, N (%) | 71 (8) | 49 (8) | 14 (10) | 6 (6) | 2 (3) |
W okresie obserwacji, 58% chorych musiało rozpocząć dializoterapię, a 15% otrzymało przeszczep nerki (nie było przeszczepów wyprzedzających). Nie zaobserwowano różnic pomiędzy podgrupami w odsetku pacjentów, którzy rozpoczęli dializy, przeszli transplantację lub stracili czas na obserwację (Tabela 3).
Gamma-glutamylotransferaza i fosfataza alkaliczna jako determinanty przeżycia
Rysunki 1 i 2 przedstawiają krzywe przeżycia Kaplana-Meiera w zależności od kwartyli rozkładu częstości wartości GGT i ALP, odpowiednio. Pacjenci z wysokim poziomem GGT lub ALP (górne kwartyle) mieli gorsze przeżycie.
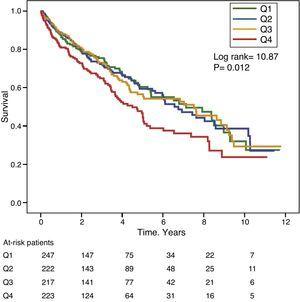
Krzywe przeżycia Kaplana-Meiera w zależności od kwartyli rozkładu częstości poziomów GGT w surowicy (Q, kwartyle).
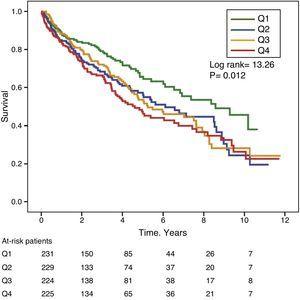
Krzywe przeżycia Kaplana-Meiera w zależności od kwartyli rozkładu częstości poziomów ALP w surowicy. (Q=quartiles).
Używając modeli regresji Coxa, GGT jako zmienna ciągła lub kategoryczna (górny kwartyl lub wartość w surowicy >36IU/L) było istotnie związane ze zwiększoną śmiertelnością w analizowanych modelach (Tabela 4). Również ALP było istotnie i niezależnie związane ze wzrostem śmiertelności we wszystkich analizowanych modelach, z wyjątkiem sytuacji, gdy ALP było włączone do najlepiej dopasowanego modelu jako zmienna kategoryczna zdefiniowana jako wartość górnego kwartyla. W tym modelu stopień związku ALP ze śmiertelnością nie osiągnął istotności statystycznej (P=0,052) (Tabela 4).
Modele regresji Coxa związku ze śmiertelnością.
| Zmienna | Univariate HR (95% CI) | Multivariate model 1a HR (95%. CI) | Model wielowariantowy 2b HR (95% CI) | Model wielowariantowy 3c HR (95% CI) |
|---|---|---|---|---|
| Log-transformowane GGT | 1.310 (1,154-1,489) P0,0001 |
1,260 (1,095-1,449) P0,0001 |
1,174 (1,005-1,371) P=0.042 |
1,166 (1,010-1,347) P=0,036 |
| GT górny kwartyl | 1,459 (1,163-1,829) P=0,001 |
1,415 (1,119-1.788) P=0,004 |
1,329 (1,036-1,705) P=0,025 |
1,315 (1,064-1,714) P=0,013 |
| GGT>36IU/L | 1.513 (1,202-1,905) P0,0001 |
1,509 (1,185-1,923) P=0,001 |
1,393 (1,078-1,800) P=0,011 |
1,390 (1,089-1,779) P=0.009 |
| Log-transformed ALP | 1,635 (1,278-2,093) P0,0001 |
1,479 (1,149-1,904) P=0,002 |
1,395 (1.061-1,833) P=0,017 |
1,327 (1,008-1,746) P=0,044 |
| ALP górny kwartyl | 1,332 (1,062-1,670) P=0,013 |
1.288 (1,023-1,621) P=0,031 |
1,277 (1,001-1,630) P=0,049 |
1,261 (0,998-1,594) P=0,052 |
| ALP>120IU/L | 1.527 (1,197-1,947) P=0,001 |
1,419 (1,109-1,815) P=0,005 |
1,362 (1,048-1,770) P=0,021 |
1,305 (1,015-1,678) P=0.038 |
Skorygowane o wiek, płeć, wskaźnik współzachorowalności, cukrzycę, palenie tytoniu, choroby wątroby, BMI, eGFR i okresy badań.
Korygowane o wszystkie zmienne z modelu 1 oraz wapń, fosfor, PTH, kwas moczowy, triglicerydy, ALT, albuminy i białko C-reaktywne.
Najlepiej dopasowany model, który obejmuje wszystkie zmienne z modeli 1 i 2 plus GGT lub ALP, z automatycznym procesem wyboru zmiennych.
Współczynnik zagrożenia (HR) dla śmiertelności u pacjentów z wysokim poziomem GGT (>36IU/L) (HR=1,39) był podobny do obserwowanego u pacjentów z wysokim poziomem ALP (>120IU/L) (HR=1,31) w modelu w pełni skorygowanym (Tabela 4). Na rycinie 3 przedstawiono krzywe przeżycia Kaplana-Meiera ilustrujące ten związek oraz addytywny wpływ na skrócenie przeżycia jednoczesnego wysokiego GGT i ALP.
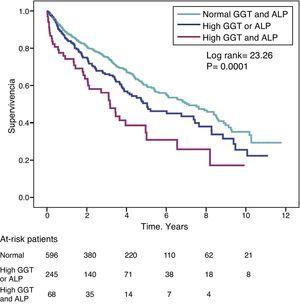
Krzywe przeżycia Kaplana-Meiera u badanych pacjentów w zależności od prawidłowego poziomu GGT i ALP, nieprawidłowo wysokiego poziomu GGT lub ALP (jednego lub drugiego) oraz jednocześnie wysokiego poziomu GGT i ALP.
Aby ocenić możliwy konfundujący wpływ współchorobowości wątroby na związek między GGT i ALP ze śmiertelnością, skonstruowano model regresji Coxa, wyłączając 27 pacjentów, u których wcześniej rozpoznano chorobę wątroby. W tym dopasowanym modelu wysokie GGT (>36IU/L) utrzymywało statystycznie istotny związek ze śmiertelnością (HR=1,316; 95% CI: 1,016-1,705; P=0,03), podczas gdy wysokie stężenie ALP (>120IU/L) wykazało związek na granicy istotności statystycznej (HR=1,296; 95% CI: 0,999-1,680; P=0,05).
Dyskusja
Wyniki obecnego badania pokazują, że podwyższone stężenie GGT lub ALP w surowicy jest niezależnie związane z wyższą śmiertelnością u pacjentów z CKD. Badanie to ujawnia również po raz pierwszy, że jednoczesne podwyższenie obu parametrów ma addytywny wpływ na przewidywanie śmiertelności, nawet u pacjentów bez choroby wątroby.
W tym badaniu pacjenci z CKD i wysokim stężeniem GGT mieli większą liczbę chorób współistniejących, zwłaszcza cukrzycę i niewydolność serca, oraz profil biochemiczny podobny do obserwowanego w zespole metabolicznym, chociaż wskaźnik BMI w tej podgrupie nie różnił się od wskaźnika BMI u reszty badanych pacjentów.
Zważywszy na wszechobecność ALP w organizmie, wysokie stężenie tego enzymu w surowicy może być wyrazem różnych procesów patologicznych. W tym sensie oznaczanie specyficznych izoenzymów ALP może być przydatne w rozróżnieniu ich pochodzenia w przypadkach, w których izolowane podwyższenia nie mogą być przypisane nasilonej przebudowie kości.
Nadmierna śmiertelność zgłaszana u pacjentów z CKD i wysokimi poziomami ALP była kontrowersyjnie przypisywana potencjalnym niekorzystnym skutkom sercowo-naczyniowym w wyniku bardzo poważnego braku kontroli nad metabolizmem kostno-mineralnym.2,3,13,14 W celu wyjaśnienia tego związku zaproponowano kilka mechanizmów patogenetycznych, w tym zwiększone zwapnienie naczyń poprzez hydrolizę pirofosforanów w ścianie tętnic,15 ogólnoustrojowe zapalenie16,17 i niedobór witaminy D.18. Jednak brak istotnego związku między stężeniem w surowicy izoenzymu ALP pochodzącego z kości (specyficznego dla kości ALP) a śmiertelnością u pacjentów z CKD19 budzi poważne wątpliwości co do hipotezy o patogennym związku z metabolizmem kostno-mineralnym.
W tym badaniu 11% pacjentów miało podwyższone stężenie ALP przy prawidłowym stężeniu GGT, a główną cechą tej podgrupy było wysokie średnie stężenie PTH, co sugeruje, że kość może być źródłem tego podwyższenia ALP. Jednak jednocześnie wysoki ALP i GGT charakteryzował podgrupę pacjentów z większym stopniem współwystępowania, głównie chorób sercowo-naczyniowych, i profilem biochemicznym, który był bardziej podobny do tego u pacjentów z samym wysokim GGT niż u pacjentów z samym wysokim ALP. Można zatem wyróżnić dwa profile ryzyka u pacjentów z CKD i wysokim ALP w zależności od obecności lub braku wysokiego poziomu GGT. Podczas gdy samo wysokie ALP wiązało się z umiarkowanym ryzykiem śmiertelności, jednoczesne podwyższenie obu enzymów wiązało się z wyższym ryzykiem śmiertelności.
GT jest enzymem odpowiedzialnym za hydrolizę zewnątrzkomórkowego zredukowanego glutationu (GSH), jednego z głównych wewnątrzkomórkowych antyoksydantów u ssaków, umożliwiając wykorzystanie prekursorowych aminokwasów do nowej wewnątrzkomórkowej syntezy GSH.6 Dlatego podwyższone GGT jest wyrazem wewnątrzkomórkowego zubożenia GSH i dlatego GGT można uznać za marker stresu oksydacyjnego.6
Wykazano, że GGT w surowicy jest biomarkerem kardiometabolicznym w populacji ogólnej. W różnych badaniach stwierdzono istotny, niezależny związek między stężeniem GGT a śmiertelnością zarówno z przyczyn sercowo-naczyniowych, jak i z powodu wszystkich przyczyn.20-22 Wykazano, że wysokie stężenie GGT wiąże się z gorszym rokowaniem w chorobie wieńcowej i niewydolności serca.23,24 Zaobserwowano również możliwy patogenny udział GGT w tworzeniu blaszki miażdżycowej, jej erozji i późniejszym pękaniu,25 co może pomóc w wyjaśnieniu jej związku z chorobowością i śmiertelnością z przyczyn sercowo-naczyniowych z biologicznego punktu widzenia.
Wartość predykcyjna GGT u pacjentów z CKD była rzadko badana. Postorino i wsp.9 zaobserwowali silny, niezależny związek między wysokim stężeniem GGT a śmiertelnością całkowitą i sercowo-naczyniową u 584 pacjentów z CKD dializowanych. W tym badaniu nie oznaczono jednak stężenia ALP w surowicy.
W innym badaniu wysokie stężenie GGT było związane z wyraźną dysfunkcją śródbłonka u pacjentów z CKD, co sugeruje związek między podwyższonym stężeniem tego markera a ryzykiem chorób sercowo-naczyniowych.10
Oprócz możliwego ogólnoustrojowego efektu prooksydacyjnego, inne hipotezy mogłyby pomóc w wyjaśnieniu związku między podwyższonym stężeniem GGT a śmiertelnością u pacjentów z CKD. Tak więc, wysokie GGT może po prostu wskazywać na nadużywanie alkoholu lub choroby wątroby, choroby współistniejące, które uzasadniałyby nadmierną śmiertelność. Jednak w tym badaniu GGT utrzymywało istotny związek ze śmiertelnością po wykluczeniu pacjentów z przewlekłym alkoholizmem, przewlekłymi chorobami wątroby lub zakażeniami wirusami hepatotropowymi, co wyklucza wyłączną rolę chorób wątroby w tym związku.
Niemniej jednak stłuszczeniowa choroba wątroby i zastoinowa choroba wątroby to dwa subkliniczne zaburzenia wątroby, które mogą powodować wysokie stężenie GGT.26,27 Choroba stłuszczeniowa wątroby jest stosunkowo częstym zjawiskiem u pacjentów z CKD i jest bardziej związana z czynnikami ryzyka sercowo-naczyniowego niż z rozwojem powikłań wątrobowych.27 Charakterystyka kliniczna i biochemiczna związana z chorobą stłuszczeniową wątroby jest podobna do obserwowanej w podgrupie pacjentów w naszym badaniu z wysokim GGT. Jednak w tym badaniu rozpoznanie choroby stłuszczeniowej wątroby nie było odpowiednio zbadane u większości pacjentów i dlatego nie można zagwarantować, że wysokie GGT wynikało głównie z tej choroby.
Kongestywna choroba wątroby odnosi się do spektrum nieprawidłowości wątroby przypisywanych biernemu przekrwieniu wtórnemu do prawostronnej niewydolności serca lub jakiejkolwiek przyczyny zwiększającej ośrodkowe ciśnienie żylne, w tym przeciążenia objętościowego, ciężkiego nadciśnienia płucnego lub walwulopatii.28 Podwyższone stężenie GGT lub ALP w surowicy jest charakterystyczną nieprawidłowością biochemiczną u chorych na CKD z dysfunkcją rozkurczową lewej komory, zwłaszcza jeśli towarzyszy jej zatorowość płucna,29 która jest również uznanym czynnikiem ryzyka śmiertelności u tych chorych.30
Podwyższone stężenie GGT może również odzwierciedlać indukcję enzymów mikrosomalnych.31 Oprócz spożycia alkoholu wiele leków może indukować enzymy wątrobowe. W tym badaniu żaden z leków najczęściej przepisywanych u pacjentów z CKD nie był istotnie związany z wysokim poziomem GGT lub ALP, chociaż nie można wykluczyć potencjalnego wpływu leków dostępnych bez recepty (zwłaszcza przeciwbólowych) na wysoki poziom GGT u naszych pacjentów.
To badanie ma szereg ograniczeń. Biorąc pod uwagę retrospektywny projekt, nie można było ustalić związków przyczynowych. Badanie przeprowadzono w jednym miejscu, a badana kohorta, choć reprezentatywna dla lokalnej populacji, była jednorodna etnicznie (kaukaska). GGT i ALP nie były analizowane jako zmienne w czasie, dlatego jest prawdopodobne, że znaczenie prognostyczne przejściowych wzrostów GGT jest inne niż wzrostów utrzymujących się w czasie. Jednak w tym badaniu wykrycie wysokiego GGT w analizie przekrojowej na pewnym etapie CKD było związane z fenotypem klinicznym o dużym znaczeniu ze względu na jego związek z chorobowością i śmiertelnością sercowo-naczyniową. Wreszcie, nie mierzono specyficznego dla kości ALP i innych parametrów związanych bardziej szczegółowo z przebudową kości.
Podsumowując, nieprawidłowo podwyższony poziom GGT jest częstym wynikiem u pacjentów z CKD, który jest obserwowany częściej u pacjentów z większą chorobą współistniejącą, szczególnie z chorobami sercowo-naczyniowymi, i jest niezależnie związany ze śmiertelnością. Równocześnie podwyższone stężenie GGT i ALP w surowicy krwi zwiększa ryzyko śmiertelności. Dlatego też łączny pomiar stężenia GGT i ALP w surowicy mógłby oferować dodatkowe informacje prognostyczne u pacjentów z CKD.
Konflikt interesów
Autorzy deklarują brak konfliktu interesów.
.