Glikogen i skrobia, megadaltonowej wielkości polimery glukozy, są głównym rezerwuarem łatwo dostępnej energii i związków węgla w większości organizmów żywych. U ssaków wchłanianie i wykorzystanie glukozy jest pod ścisłą kontrolą. Defekty w prawidłowej gospodarce glukozą są związane z różnymi patologiami ludzkimi, takimi jak choroby spichrzeniowe glikogenu i cukrzyca, w których utrzymująca się hiperglikemia jest skorelowana z wczesnym początkiem i większą ciężkością choroby. W szlakach metabolicznych katalitycznej przemiany glikogenu bierze udział kilka enzymów, wśród których syntaza glikogenu katalizuje wydłużanie, a fosforylaza glikogenu rozkład a(1,4)-poł±czeń glukanów. W ciągu ostatnich 30 lat dzięki badaniom biochemicznym i strukturalnym fosforylaz glikogenu i maltodekstryn uzyskano wiele informacji na temat degradacji glikogenu. Badania te wykazały, że regulacja fosforylazy glikogenu jest fascynującym przykładem kowalencyjnego i niekowalencyjnego allosteryzmu, doskonale koordynowanego przez kontrolę hormonalną. Informacje opisujące struktury trzecio- i czwartorzędowe są obecnie dostępne dla praktycznie wszystkich enzymów bezpośrednio zaangażowanych w przetwarzanie glikogenu. Co zaskakujące, bardzo mało informacji strukturalnych dotyczy syntazy glikogenu, która katalizuje wydłużanie glikogenu poprzez kolejne dodawanie ![]() -(1,4)-połączonych reszt glukozowych do nieredukującego końca polimeru, wykorzystując ADP/UDP-glukozę jako donor glukozy.
-(1,4)-połączonych reszt glukozowych do nieredukującego końca polimeru, wykorzystując ADP/UDP-glukozę jako donor glukozy.
Określiliśmy obecnie strukturę krystaliczną syntazy glikogenu z Agrobacterium tumefaciens (AtGS) w rozdzielczości 2,3 Å, zarówno w jej apo-formie, jak i w obecności ADP. Dane zostały zebrane na ID29, a struktura rozwiązana przy użyciu techniki SAD (single wavelength anomalous diffraction), po czym zastosowano procedury modyfikacji gęstości. Białko występuje jako dimer w jednostce asymetrycznej, przy czym każdy monomer składa się z dwóch domen „Rossmann-fold” (Rysunek 81), które są zorganizowane podobnie jak w strukturach fosforylazy glikogenu i innych glikozylotransferaz z nadrodziny GT-B . Głęboka szczelina pomiędzy obiema domenami zawiera centrum katalityczne. Zasadnicza różnica między syntazami glikogenowymi ssaków (rodzina GT3) i bakterii (GT5) polega na tym, że tylko enzymy GT3 s± ¶cisłe regulowane przez fosforylację i niekowalencyjn± modulację allosteryczn±. Zgodnie z opartymi na strukturze wielokrotnymi dopasowaniami sekwencji GT3, GT5 i fosforylazy glikogenu, regulacyjne miejsca fosforylacji w ludzkiej syntazie glikogenu są prawdopodobnie zlokalizowane w 25-rezidowych N-końcowych i 120-rezidowych C-końcowych wstawkach, poza nieregulowanym rdzeniem GT-B bakteryjnych syntaz glikogenu. Badania mutagenetyczne zidentyfikowały wcześniej dwa konserwowane klastry Arg w enzymach GT3 jako część miejsc allosterycznych zarówno dla reszt fosfo-Ser/Thr, jak i niekowalencyjnego aktywatora Glc-6P. Odpowiednie reszty w AtGS znajdują się na jednym końcu domeny C-końcowej, daleko od centrum reakcji, co wskazuje na długodystansowy efekt regulacyjny.
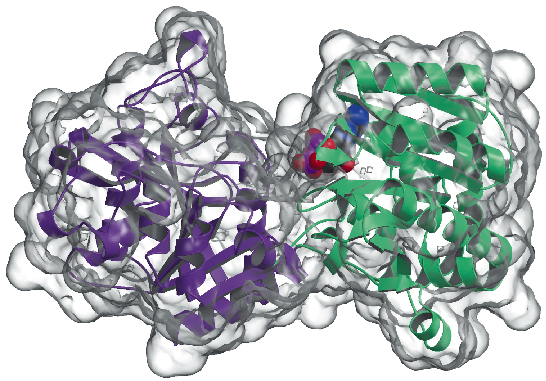
Fig. 81: Struktura syntazy glikogenu: powierzchnia dostępna dla rozpuszczalnika jest przedstawiona w kolorze przezroczystym. Należy zwrócić uwagę na związaną cząsteczkę ADP (narysowaną jako kulki VDW).
Struktura AtGS wykazuje uderzające topologiczne podobieństwo do struktur rdzeniowych fosforylaz glikogenu/maltodekstryn (rodzina GT35) (Rysunek 82a), mimo że identyczność sekwencji jest niska (~14%). Struktura każdej domeny Rossmann-fold AtGS jest znacznie bliższa strukturze fosforylaz z rodziny GT35 niż jakiejkolwiek innej nukleotydozależnej transferazy glikozylowej. Syntaza glikogenu i fosforylazy wykazują również silne podobieństwo w swoich miejscach katalitycznych (Rysunek 82b). Ryboza ADP i grupy pirydoksalowe leżą w równorzędnych pozycjach, podobnie jak dystalny fosforan ADP w AtGS i nieorganiczny fosforan substratu w fosforylazach. Konserwacji uległy również krytyczne aminokwasy, które oddziałują z cząsteczkami glukozy w substratach. Mechanizm katalityczny wykorzystywany przez syntazy i fosforylazy glikogenu jest więc prawdopodobnie podobny, a subtelne zmiany w strukturze tłumaczą ich ogólnie odmienne właściwości funkcjonalne.
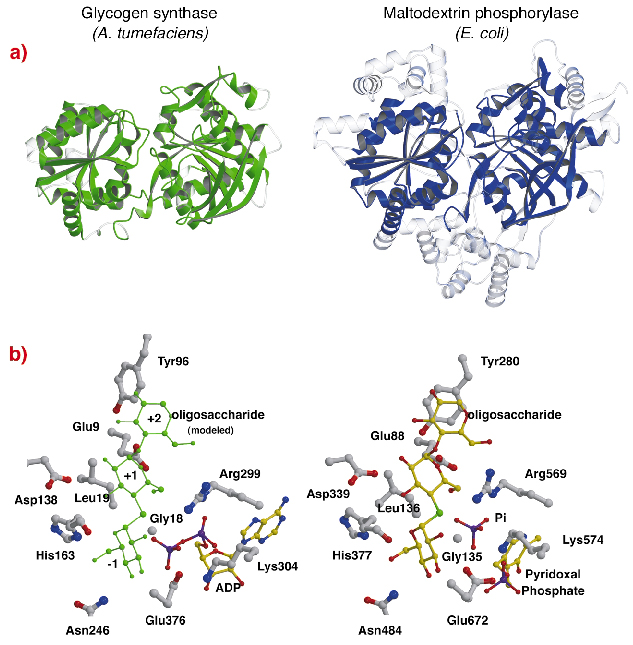
Fig. 82: Homologia do fosforylazy glikogenu: (a) po wyrównaniu strukturalnym, nałożone równoważne reszty między AtGS i fosforylazą maltodekstrynową E. coli MalP, są przedstawione w materiale stałym (regiony nie wyrównane, w przezroczystym); (b) miejsca katalityczne AtGS i MalP.
Początkowa sugestia, że synteza glikogenu stanowiła po prostu odwrócenie jego degradacyjnej fosforylazy, została wykazana jako błędna, ponieważ Leloir wykazał, że UDP-Glc i syntaza glikogenu, a nie Glc-1-P i fosforylaza glikogenu, były odpowiedzialne za wydłużanie polisacharydów. Nasza praca pokazuje jednak, że przeciwstawne, niezależne reakcje w przemianie glukozy w glikogen są katalizowane przez blisko spokrewnione, homologiczne enzymy.