- Abstract
- Słowa kluczowe
- Wprowadzenie
- Wczesne metody produkcji pigmentów
- Metoda kwasu siarkowego
- Metoda chlorowania
- Oddzielanie żelaza
- Proces pieca elektrycznego
- Trasa hydrometalurgiczna
- Metoda wysokociśnieniowa
- Proces atmosferyczny
- Oksyhydroliza
- Tlenohydroliza fluidalna
- Oksyhydroliza w prażalniku natryskowym
- Produkcja tytanu
Abstract
Niskiej jakości ilmenit może być ługowany stężonym HCl pod ciśnieniem atmosferycznym i w temperaturze 80oC. Po filtracji w celu oddzielenia substancji nierozpuszczalnych, roztwór zawierający TiO2+ i Fe2+ jest ogrzewany w celu wytrącenia wodorotlenku tytanu i odzyskania HCl. Wodorotlenek tytanu jest następnie kalcynowany do syntetycznego rutylu zawierającego 95+% TiO2, podczas gdy FeCl2 jest poddawany oksyhydrolizie lub fluidyzacji w celu odzyskania HCl i Fe2O3. Proces ten w naturalny sposób może być stosowany do wysokiej klasy ilmenitu. To omija proces pieca elektrycznego, który stosuje się tylko do wysokiej klasy ilmenitu i jest lepszy od procesu kwasu siarkowego, który jest bardzo zanieczyszczający. Produkt tego procesu może być stosowany do przygotowania białego pigmentu, jak również metalu tytanu.
Słowa kluczowe
ługowanie HCl, proces Magpei, syntetyczny rutyl, oksyhydroliza, piec elektryczny, chlorowanie, proces kwasu siarkowego
Wprowadzenie
Głównymi minerałami tytanu są rutyl, TiO2 i ilmenit, FeTiO3 (rysunek 1 i 2). Rutyl jest łatwy w obróbce do metalu tytanu lub pigmentu TiO2 metodą chlorowania, podczas gdy ilmenit jest bardziej skomplikowany ze względu na wysoką zawartość żelaza. Ponieważ światowe rezerwy tytanu w 90% występują w postaci ilmenitu, a tylko w 10% w postaci rutylu, obróbka ilmenitu jest ważnym zagadnieniem w metalurgii. Rysunek 1: Próbka muzealna rutylu, ~ 90 % TiO2

Rysunek 2: Próbka muzealna ilmenitu, FeTiO3 (59.4 % TiO2)
Złoża ilmenitu mogą być masywne, jak w prowincji Quebec (Rysunek 3) lub jako czarne piaski (Rysunek 4) związane z magnetytem, monacytem i innymi cennymi minerałami, które są oddzielane metodami fizycznymi (Rysunek 5). W pierwszej separacji magnetycznej słaby magnes jest używany do oddzielenia magnetytu, podczas gdy w drugiej separacji magnetycznej magnes o wysokiej intensywności jest używany do oddzielenia ilmenitu.

Rysunek 3: Próbka masywnego ilmenitu z Quebecu

Rysunek 4: Czarne piaski plażowe jak w Indiach
Wczesne metody produkcji pigmentów
Metoda kwasu siarkowego
W 1916 roku, Titanium Pigment Corporation z Niagara Falls, Nowy Jork i Titan Company z Norwegii jednocześnie rozpoczęły komercyjną produkcję tego nowego białego pigmentu. Następnie, główne białe pigmenty stosowane w farbach były biały ołów, biel cynkowa, i litopon. W tej metodzie ilmenit traktowano stężonym H2SO4 w temperaturze 110-120°C, tworząc siarczany żelaza i tytanu:
FeTiO3 + 4H+ → Fe2+ + TiO2+ + 2H2O
Reakcję prowadzi się w dużych betonowych zbiornikach wyłożonych kwasoodporną cegłą (rys. 6), ogrzewanych przez bezpośredni wtrysk pary pod wysokim ciśnieniem lub w młynie ślimakowym (rys. 7). Zestalona masa powstająca w reaktorze pod koniec reakcji była następnie usuwana z reaktora poprzez rozpuszczenie w wodzie lub rozcieńczonym kwasie. Po usunięciu nierozpuszczalnej pozostałości przez filtrację, roztwór zawierający 120-130 g/L TiO2 i 250-300 g/L FeSO4 zatężono pod próżnią w temperaturze 10°C do wykrystalizowania FeSO4-7H2O, który następnie odwirowano. Tlenek tytanu jest następnie wytrącany z roztworu przez rozcieńczenie i posiew, w wyniku czego powstaje rozcieńczony H2SO4 do usunięcia (rys. 8 i 9). Jednak największy producent pigmentu w Salvador w Brazylii nadal stosuje tę technologię, ponieważ usuwa produkty odpadowe do oceanu, które są usuwane przez pływy morskie.

Rysunek 5: Uszlachetnianie czarnych piasków w celu odzyskania ich cennych składników

Rysunek 6: Duże betonowe zbiorniki wyłożone cegłą kwasoodporną
Rysunek 7: Podgrzewany młyn pug

Figura 8: Produkcja pigmentu TiO2 w procesie z kwasem siarkowym

Figura 9: Biel tytanowa, ~ 100% TiO2
Metoda chlorowania
DuPont w USA produkuje pigment od 1950 r. przez bezpośrednie chlorowanie rudy ilmenitu, oddzielenie produktów przez destylację frakcyjną, a następnie utlenianie TiCl4 (rysunek 10):

Rysunek 10: Uproszczony proces Du Ponta do produkcji pigmentów z ilmenitu
2FeTiO3 + 7Cl2 + 3C → 2TiCl4 + 2FeCl3 + 3CO2
TiCl4 + O2 → TiO2 + 2Cl2
Problemem tego procesu jest odzysk chloru z chlorku żelazowego lub obrót dużymi ilościami tego produktu ubocznego.
Oddzielanie żelaza
Ze względu na problemy z zanieczyszczeniem związane z usuwaniem rozcieńczonego kwasu siarkowego i FeSO4, żelazo w rudzie jest oddzielane na wczesnym etapie. Osiąga się to na dwa sposoby: za pomocą pieca elektrycznego i hydrometalurgicznych dróg.
Proces pieca elektrycznego
Metoda pieca elektrycznego została opracowana w 1950 roku. Rudę mieszano z pewną ilością antracytu, która była wystarczająca do zredukowania składnika tlenku żelaza w rudzie, a następnie ładowano do pieca elektrycznego o temperaturze 1650°C, gdzie tlenek żelaza redukuje się do metalu, natomiast tytan oddziela się w postaci żużla (rys. 11). Reakcje zachodzące podczas redukcji są następujące:

Rysunek 11: Proces pieca elektrycznego do oddzielania żelaza
FeTiO3 + C → Fe + CO + TiO2(żużel)
Fe2O3 + 3C → 2Fe + 3CO
Metodę tę stosuje Rio Tinto QIT w zakładzie w Sorel koło Montrealu oraz w Richards Bay w RPA. Jest ona również stosowana w Związku Radzieckim w Zaporożu (Ukraina) i w Japonii.
Żużel tytanowy to głównie tytanian żelazowo-magnezowy, (Fe,Mg)Ti4O10, oraz niewielka ilość krzemianów; typowe analizy to 72-85% całkowitego TiO2. Niewielka ilość TiO2 ulega redukcji do Ti2O3. Redukcja tlenków żelaza nie jest przeprowadzana do końca, dlatego w żużlu pozostaje pewna ilość tlenku żelaza, który obniża jego temperaturę topnienia. Temperatura topnienia TiO2 1840°C i ilmenitu 1435°C.
Żużel ma wysoką zawartość tytanu i niską zawartość żelaza (rys. 12) i dlatego jest preferowany do ilmenitu w produkcji pigmentu TiO2 lub metalu tytanu. Jednak żużel produkowany w Quebecu nie nadaje się do chlorowania z powodu wysokiego poziomu zanieczyszczeń – około 16,6% w porównaniu do około 6% w innych żużlach. Zanieczyszczenia te nie tylko zużyją niepotrzebne ilości chloru, ale także stworzą problem z utylizacją. Ponadto, niektóre z tych zanieczyszczeń, np, wapń i magnez będą zakłócać sam proces chlorowania, który jest prowadzony w temperaturze 800°C, tworząc stopioną fazę (CaCl2 m.p. 770°C, MgCl2 m.p. 708°C).

Rycina 12: Mielony żużel tytanowy, FeTi4O10 (70-80 % TiO2)
Z tych powodów żużel tytanowy był używany tylko do wytwarzania pigmentu w procesie z kwasem siarkowym. Żużel był traktowany w taki sam sposób jak ilmenit z tym wyjątkiem, że nie było konieczne oddzielanie siarczanu żelazawego, ponieważ większość żelaza została już oddzielona przez redukcję we wcześniejszym etapie (Rysunek 13). Proces przetwarzania kwasu siarkowego żużla, jednak nadal cierpiał z powodu problemu usuwania odpadów kwasu, w wyniku czego został porzucony w latach 80. i zastąpiony przez nową technologię opartą na ulepszaniu żużla do 94,5% TiO2 przez wymywanie większości zanieczyszczeń przez HCl pod ciśnieniem, aby uczynić go odpowiednim do chlorowania.

Figura 13: ługowanie żużla tytanowego do produkcji pigmentu TiO2, obecnie przestarzała
Trasa hydrometalurgiczna
Trasa hydrometalurgiczna została opracowana w latach 60. i obejmowała ługowanie żelaza z ilmenitu oraz uzyskiwanie pozostałości bogatej w tytan (90-95% TiO2), znanej jako „syntetyczny rutyl”. W jednym przypadku, w procesie Altair, uzyskano TiO2 klasy pigmentowej. Wszystkie te procesy wykorzystują proces oksyhydrolizy do obróbki chlorku żelazawego w celu otrzymania HCl do recyklingu i Fe2O3 jako produktu ubocznego.
Metoda wysokociśnieniowa
W tej metodzie, ilmenit wysokiego gatunku jest rozkładany w autoklawach przez 20% HCl w 120°C i 200 kPa; żelazo jest rozpuszczane jako chlorek żelazawy pozostawiając ciało stałe zawierające około 95% TiO2, który ma analizę chemiczną do rutylu, dlatego nazywany jest syntetycznym rutylem (Rysunek 14):

Figura 14: Syntetyczny rutyl
FeTiO3 + 2H+ → TiO2 + Fe2+ + H2O
Niskiego gatunku ilmenitu nie można obrabiać tą metodą, ponieważ wszystkie krzemiany i substancje nierozpuszczalne zanieczyszczą produkt. Syntetyczny rutyl jest następnie traktowany chlorem w celu przygotowania TiCl4, z którego otrzymuje się TiO2 lub tytan metaliczny bez problemów związanych z zanieczyszczeniem środowiska. Proces ten jest stosowany w USA, Anglii, Japonii, na Tajwanie i w Australii. Oksyhydroliza może być prowadzona na różne sposoby, jak opisano poniżej.
Proces atmosferyczny
W 2014 roku stwierdzono przez Magpie Incorporation w Kanadzie, że ilmenit niskiej klasy można rozpuścić w temperaturze 80°C za pomocą stężonego HCl pod ciśnieniem atmosferycznym. Po filtracji w celu usunięcia nierozpuszczalnej materii, roztwór jest destylowany w celu odzyskania HCl i hydrolizy jonu tytanylowego do TiO2. Po filtracji, pozostałość jest kalcynowana w celu wytworzenia syntetycznego rutylu (Rysunek 16):

Rysunek 15: Produkcja syntetycznego rutylu z ilmenitu

Rysunek 16: Produkcja 98+% TiO2 z ilmenitu niskiej klasy
FeTiO3 + 4HCl → TiO2+ + Fe2+ + 4Cl- + 2H2O
TiO2+ + 2Cl- + H2O → TiO2 + 2HCl
Jasno widać, że nowa technologia ługowania pod ciśnieniem otoczenia przewyższa starą technologię wytapiania w piecu elektrycznym i ulepszania w autoklawie.
Oksyhydroliza
Roztwór chlorku żelazawego jest regenerowany do HCl i Fe2O3 przez oksyhydrolizę:
2FeCl2 + 2H2O + 1/2O2 → Fe2O3 + HCl
Jest to ta sama technologia, która jest używana do obróbki roztworu pikli. Stosowane są dwie metody
Tlenohydroliza fluidalna
W reaktorze fluidalnym roztwór chlorku żelaza jest wprowadzany na duże złoże gorącego tlenku żelaza, gdzie ogrzewanie jest zapewnione przez gorące gazy spalinowe fluidyzujące (Rysunek 17). Ponieważ gaz spalinowy przepływa przez dobrze wymieszane złoże tlenku, szybko osiąga on równowagę termiczną ze złożem. Roztwór jest podawany na wierzch złoża tlenków. Ciekła pasza zwilża zewnętrzną warstwę gorących cząstek tlenku i szybko odparowuje tworząc cebulowatą warstwę nowego stałego tlenku na wierzchu istniejącego tlenku, wytwarzając w ten sposób gęste jednorodne cząstki.

Rysunek 17: Reaktor ze złożem fluidalnym do oksyhydrolizy chlorku żelazawego
Oksyhydroliza w prażalniku natryskowym
W tym typie prażalnika do oksyhydrolizy roztwór chlorku żelazawego jest natryskiwany do pustego cylindrycznego zbiornika, podczas gdy wymagana energia jest dostarczana przez przepływ gorących gazów wytwarzanych w dolnych palnikach (rysunek 18). Prażarki natryskowe mają duże średnice, aby utrzymać niskie prędkości gazu. Jeśli prędkość gazu jest wysoka, zbyt wiele cząstek jest eluowanych z gazem odlotowym, a jakość produktu i wydajność prażarki spada. Gazy odlotowe i tlenki opuszczają prażalnik przeciwbieżnie w temperaturze około 400°C do 500°C. Czas przebywania rozpylonych cząstek w wysokotemperaturowej strefie reakcji jest bardzo krótki, dlatego poprzez atomizację należy wytworzyć bardzo małe kropelki cieczy, które mogą być szybko podgrzane. W wyniku szybkiego nagrzewania na powierzchni każdej kropli tworzy się skorupa ze stałego tlenku. W miarę ogrzewania się większej części kropli, woda odparowuje i przebija się przez skorupę tlenku. Dlatego wyprażony tlenek w aerozolu składa się z bardzo drobnych, „puszystych”, pustych w środku kulek.

Figura 18: Regeneracja HCl z roztworu chlorku żelaza przez oksyhydrolizę w prażarce natryskowej
Produkcja tytanu
Tytan metaliczny jest wytwarzany przez chlorowanie rutylu, syntetycznego rutylu lub żużla tytanowego, a następnie redukcję w reaktorze metalotermicznym TiCl4 przez magnez do tytanu (rysunki 19 i 20):
TiO2 + C + 2Cl2 → TiCl4 + CO2
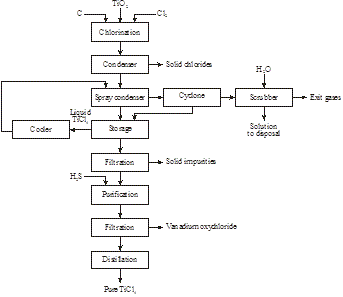
Figura19: Produkcja TiCl4 z rutylu, syntetycznego rutylu lub żużla tytanowego

Figura 20: Produkcja tytanu z TiCl4
TiCl4 + Mg → Ti + MgCl2
Chlorek magnezu jest następnie elektrolizowany w celu odzyskania magnezu i chloru do recyklingu. Rysunek 21 przedstawia reaktor metalotermiczny wyjęty z pieca po redukcji, z którego odzyskuje się gąbkę tytanową (rysunek 22).

Rysunek 21: Reaktor metalotermiczny usuwany z pieca

Rysunek 22: Gąbka tytanowa (góra) i MgCl2 (dół) usunięte z reaktora
- Barksdale J (1966) Titanium, Its Occurrence, Chemistry and Technology, Ronald Press, New York.
- Sibum H (1997) „Titanium”, pp. 1129-1179 w Handbook of Extractive Metallurgy edited by F. Habashi, published by WILEY-VCH, Weinheim, Germany.
- Habashi F (1993) A Textbook of Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Québec City, Canada.
- DuPont (2007) Brochure™ Ti-Pure® titanium dioxide.
- Habashi F (2002) Textbook of Pyrometallurgy, Métallurgie Extractive Québec, Québec City, Canada.
- Toromanoff I, Habashi F (1985) Transformation of a Low-Grade Titanium Slag into Synthetic Rutile Intern. J. Mineral Processing 15: 65-81
- Habashi F (1996) Pollution Problems in the Mineral and Metallurgical Industries, Metallurgy Extractive Quebec, Quebec City.
- Habashi F (1993) Pressure Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Québec City, Canada.
- Habashi F, Kamaleddine F, Bourricaudy E (2015) A New Process to Upgrade Ilmenite to Synthet-ic Rutile Proceedings Conference of Metallurgists, Canadian Institute of Mining, Metallurgy, and Petroleum, Montreal. Reprinted in Metall 69: 27-30
- Habashi F (1993) Two Hundred Years Titanium. The Processing of Titanium Rudes for Pigment and Metal Production. Arab Min J 11: 74-84
.