Rozdziały
- 1 Funkcja
- 2 Mechanizm hamowania transferu nici
- 3 HIV i AIDS
- 4 Wpływ struktury
- 5 Krystalizacja intasomu PFV.3 HIV i AIDS
- 4 Wpływ struktury
- 5 Krystalizacja intasomu PFV
- 5.1 Crystallization Technique
- 5.2 Crystallographic and Refinement Statistics
- 6 Overall Architecture & Components
- 6.1 Structure
- 6.2 Integrase and DNA interactions
- 6.3 Active Site
- 7 Integrase Inhibitors
- 7.1 Additional Resources
- 8 Struktury 3D retrowirusowej integrazy
Funkcja
Retrowirusowa integraza jest niezbędnym enzymem retrowirusowym, który wiąże się z wirusowym DNA i wstawia je do chromosomu komórki gospodarza. Odwrotnie transkrybowany cDNA ludzkiego wirusa niedoboru odporności typu 1 (HIV-1) jest wstawiany do genomu komórki gospodarza w celu zwiększenia sprawności patogenu i wirulencji. Integraza jest wytwarzana przez klasę retrowirusów (takich jak HIV) i jest wykorzystywana przez wirusa do wbudowywania jego materiału genetycznego do DNA komórki gospodarza. Mechanizm komórkowy gospodarza wytwarza mRNA, a następnie białko z wbudowanego materiału genetycznego, replikując w ten sposób wirusa. Mimo że zbadano kilka leków hamujących integrazę, mechanizm odpowiedzialny za hamowanie transferu nici nie został jeszcze wyjaśniony. Jednakże, Hare el al (2010) określił strukturalne składniki retrowirusowej integrazy. Dalsze poznanie pełnej struktury integrazy retrowirusowej i jej zastosowanie do regulacji aktywności funkcjonalnej i enzymatycznej może potencjalnie umożliwić naukowcom opóźnienie progresji chorób retrowirusowych. Ponadto, badania nad integrazą HIV-1 mogą doprowadzić do znalezienia obiecującego nowego celu i przyczynić się do wygenerowania farmakoforowych modeli dla terapii przeciwwirusowej.
HIV Inhibitory integrazy: Raltegravir, sprzedawany pod nazwą Isentress jest obecnie zatwierdzony jako terapeutyczny inhibitor integrazy HIV. Został on zatwierdzony 12 października 2007 r. W przypadku fagowej integrazy patrz fagowa integraza.
Mechanizm działania hamującego przeniesienie pasma
Caption
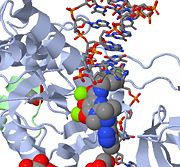
Powyżej znajduje się obraz JMOL MK-0518 blokującego 3′ koniec wirusowego DNA przed związaniem miejsca aktywnego. Zwróć uwagę na chelatujące metal atomy tlenu w MK-0518 oddziałujące z kationami magnezu znajdującymi się w miejscu aktywnym.
HIV integraza typu 1 jest stosunkowo nowym i nowatorskim celem dla inhibitorów. W 2007 roku, pierwszy inhibitor integrazy HIV-1, Raltegravir, został zatwierdzony przez FDA do stosowania w HIV-1 jako terapia skojarzona. Inhibitory przenoszenia pasm działają poprzez zapobieganie zgodnej integracji wirusowego DNA z chromosomem gospodarza. Po wejściu wirusa do komórki gospodarza, odwrotna transkryptaza przekształca wirusowy ssRNA w dsDNA. W tym momencie integraza tworzy kompleks z wirusowym DNA, tworząc kompleks przedintegracyjny (intasom). Kompleks przedintegracyjny jest następnie chaperonowany do jądra, gdzie następuje wycięcie dwóch nukleotydów z 3′ końca. Następnie DNA jest kowalencyjnie integrowany do DNA gospodarza. Inhibitory przenoszenia łańcucha przerywają ten proces, zapobiegając integracji wirusowego DNA z chromosomem gospodarza. Inhibitory transferu splotu działają poprzez zaangażowanie kofaktorów jonów metali znajdujących się w miejscu aktywnym retrowirusowej integrazy. Chelatujące metale atomy tlenu znajdujące się w inhibitorach oddziałują bezpośrednio z kofaktorami metali, podczas gdy grupa halobenzylowa pasuje do kieszeni utworzonej przez przesunięte 3′ wirusowego DNA w miejscu aktywnym.
HIV i AIDS

W 2010 roku na AIDS zmarło ponad 25 milionów ludzi, a szacuje się, że z HIV żyje około 33 milionów ludzi.
Do chwili obecnej na AIDS zmarło ponad 25 milionów ludzi, a szacuje się, że z HIV żyje obecnie około 33 milionów ludzi. W przypadku inhibitorów integrazy retrowirusowej patrz Raltegravir i Farmakokinetyka inhibitorów integrazy retrowirusowej.
Wpływ struktury
Trójwymiarowe struktury niektórych białek komórki gospodarza, krytycznych dla zrozumienia mechanizmu zakażenia HIV i wirulencji, powstały w wyniku analiz krystalografii rentgenowskiej. Struktury proteazy i integrazy HIV należą do struktur o najwyższej randze, które przyczyniły się do uratowania wielu istnień ludzkich i poprawiły jakość życia wielu osób dotkniętych HIV. Jest on stosowany w projektowaniu leków opartym na strukturze w celu opracowania inhibitorów proteazy i inhibitorów integrazy oraz jest wykorzystywany jako istotny składnik wysoce aktywnej terapii antyretrowirusowej (HAART).
Choć istniejące leki antyretrowirusowe poprawiają jakość życia, jak również przedłużają życie wielu pacjentów, nie udaje się wyeliminować choroby. Badania nad inhibitorami integrazy pokazują, że w połączeniu z innymi lekami antyretrowirusowymi zmniejszają adaptacje wirusów i mogą być potencjalnie stosowane w terapii ratunkowej u pacjentów, którzy nabyli oporność na inne leki. Więcej na ten temat można przeczytać w
- AIDS przed inhibitorami proteazy & Inhibitory proteazy HIV: A Breakthrough
- Treatments:Retroviral Integrase Inhibitor Pharmacokinetics References.
PFV Intasome Crystallization
Aby naśladować wirusowe końce DNA HIV-1, Hare i wsp. (2010) wykorzystali rozpuszczalne i w pełni funkcjonalne preparaty intasomu prototypowego wirusa piankowatego (PFV), uzyskane przy użyciu rekombinowanej integrazy PFV i dwuniciowych oligonukleotydów.
Wyjątkową stabilność kompleksów integraza-DNA określono na podstawie obserwacji reakcji transferu nici in vitro, które sklasyfikowano w trzech trybach migracji deproteinowej: (1) pojedyncze uzgodnione zdarzenia: zlinearyzowany plazmid docelowy; (2) wielokrotne uzgodnione zdarzenia: rozmaz; (3) zdarzenia połowiczne: otwarte koliste DNA. Dalsza charakterystyka intasomu PFV również wykazała strukturalną istotność, która implikuje silne interakcje białko-białko i białko-DNA, pomimo długotrwałej inkubacji w warunkach wysokiej siły jonowej. Kompleksowe testy krystalizacji doprowadziły do powstania realnej konfiguracji krystalicznej, która dyfrakcjonowała promieniowanie rentgenowskie z rozdzielczością 2,9 Angstremów. Ostatecznie ustalono trójwymiarową strukturę. Asymetryczna jednostka zawierała pojedynczy dimer integrazy z trwale związaną cząsteczką wirusowego DNA oraz parę dimerów integrazy związanych z symetrią, które tworzyły podłużny tetramer. Interfejs dimeru jest stabilizowany przez międzycz±steczkowe oddziaływania amino-końcówek i domen rdzenia katalitycznego (podjednostka wewnętrzna – podjednostka zewnętrzna). Ogólny kształt podłużnego tetrameru jest unikalny, aczkolwiek wykazuje podobieństwa do wcześniej opisanych kompleksów integrazy HIV-1.
Technika krystalizacji
Kompleksy białko-DNA zostały utworzone przy użyciu pełnowartościowego, dzikiego typu PFV IN i syntetycznego dsDNA, które modelowało wirusowy koniec.
Intasom został skrystalizowany przy użyciu techniki dyfuzji wiszącej w kroplach pary. Roztwór zbiornikowy składał się z 1,35 M siarczanu amonu, 25% (v/v) glicerolu, 4,8% (v/v) 1,6-heksanodiolu i 50mM kwasu 2-(N-morfolino) etanosulfonowego (MES) przy pH 6,5. Kryształy białko-DNA nasączano również w obecności MK0518, GS9137, Mg(II), i/lub Mn(II). Struktura krystaliczna została rozwiązana przy użyciu podstawienia molekularnego.
Statystyki krystalograficzne i rafinacyjne
Hare i wsp. (2010) opublikowali dane dotyczące siedmiu struktur krystalicznych. Dane te obejmują kompleks PFV IN (forma apo) i sześć dodatkowych struktur, w tym kompleks związany z Mg, Mn, Mg/MK0518, Mn/MK0518, Mg/GS9137 i Mn/GS9137. Wszystkie siedem struktur należy do grupy przestrzennej P41212. Zostały one udoskonalone do rozdzielczości między 2,85 a 3,25 Å.
Ogólna architektura & Komponenty
Struktura
Ogólna struktura złożonego intasomu PFV jest modelem tetrameru opartym na dwóch strukturach domenowych z interfejsem dimer-dimer. Poprzednie modele intasomu przedstawiały podobną, ale bardziej elastyczną strukturę, podczas gdy intasom PFV okazał się być wysoce ograniczony. Wykorzystując modelowanie homologiczne, Hare i wsp. (2010) proponują, że krótsze łączniki międzydomenowe mogą być czynnikiem wpływającym na elastyczność, szczególnie w integrazie HIV-1. Wewnętrzne podjednostki tetrameru są zaangażowane w ogólną tetrameryzację i wiązanie wirusowego DNA. Domeny rdzenia katalitycznego zewnętrznych podjednostek mogą działać jako nośniki, ale ponieważ domeny amino- i karboksy-końcowe są nierozpoznane na mapach gęstości elektronowej, ich funkcja pozostaje nierozstrzygnięta. Łącznik domeny rdzenia katalitycznego i domeny karboksy-terminalnej przyjmuje konformację wydłużoną na większości swojej długości i jest położony równolegle do łącznika domeny amino-terminalnej i domeny rdzenia katalitycznego podjednostki wewnętrznej. Łączniki międzydomenowe Łączniki międzydomenowe (łącznik CCD-CTD i łącznik NTD-CCD) wiążą obie połówki intasomu razem, a struktura jest dalej stabilizowana przez parę domen karboksy-końcowych oddziałujących z obiema wewnętrznymi domenami rdzenia katalitycznego.
Integraza i interakcje DNA
Silne interakcje białko-DNA znajdują się w obrębie końcowych sześciu nukleotydów. Każda karboksylowa domena końcowa oddziałuje z fosfodiestrowym szkieletem obu wirusowych cząsteczek DNA. Ponadto domena amino-końcowa – domena rozszerzająca i domena amino-końcowa oddziałują z wirusowym DNA w miejscu aktywnym przeciwstawnej domeny rdzenia katalitycznego.
Miejsce aktywne
Karboksylany miejsca aktywnego to łańcuchy boczne Asp 128, Asp 185, Glu 221.
Po jednym atomie cynku znajduje się w pobliżu miejsc aktywnych.
- .
- .
Inhibitory integrazy
| Nazwa | Marka | Firma | Patent | Uwagi |
| Raltegravir | Isentress | Merck & Co. | – | znany również jako MK-0518. Izopropyl i metylo-oksadiazol MK-0518 są zaangażowane w hydrofobowe i układające się interakcje z łańcuchami bocznymi Pro 214 i Tyr 212 w celu stabilizacji tego leku w miejscu aktywnym intasomu PFV. Ten sposób wiązania leku powoduje przemieszczenie reaktywnego 3′ końca wirusowego DNA z miejsca aktywnego intasomu PFV. Po związaniu MK-0518 z miejscem aktywnym, reaktywna 3′ grupa hydroksylowa odsuwa się od miejsca aktywnego intasomu PFV o ponad 6 Angstromów. Raltegrawir został zatwierdzony przez FDA 12 października 2007 roku do stosowania wraz z innymi środkami anty-HIV w leczeniu zakażenia HIV u dorosłych. Jest to pierwszy inhibitor integrazy zatwierdzony przez FDA. |
| Elvitegravir | – | Gilead Science | – | GS-9137 oddziałuje z Pro 214 intasomu PFV poprzez swoją zasadę chinolonową i grupę izopropylową. W fazie eksperymentalnej; ma wspólną strukturę z antybiotykami chinolonowymi. Zakończono badania II fazy elwitegrawiru u osób z doświadczeniem w leczeniu. Trwają badania III fazy u pacjentów z doświadczeniem w leczeniu. Trwa badanie fazy II elwitegrawiru u osób, które nigdy nie stosowały terapii antyretrowirusowej. Badanie to będzie również oceniane jako środek wspomagający w miejsce Norviru, obecnie zwanego GS9350. Elvitegravir jest obiecujący dla pacjentów zakażonych wirusem HIV, którzy w przeszłości przyjmowali inne leki przeciw HIV. |
| MK-2048 | – | Merck & Co. | – | Inhibitor integrazy drugiej generacji, przeznaczony do stosowania przeciw zakażeniom HIV. Jest lepszy od pierwszego dostępnego inhibitora integrazy, raltegrawiru, pod tym względem, że hamuje enzym HIV integrazę 4 razy dłużej. Jest badany pod kątem stosowania jako element profilaktyki przedekspozycyjnej (PrEP). |
Zobacz także Farmakokinetyka retrowirusowych inhibitorów integrazy.
.