Pacjent ze zmianą podnabłonkową żołądka
Martín Gómez Zuleta, MD (1)
(1) Gastroenterology Unit, Department of Internal Medicine, National University of Colombia. Hospital Tunal. Bogotá, Colombia..
Received: 05-10-10 Accepted: 25-11-10
Abstract
Although subepithelial lesions are rarely found in the upper gastrointestinal tract, they can cause uncertainty in diagnostic approach and management. Opisano wyniki badań endosonograficznych i dokonano przeglądu aktualnych zaleceń w świetle jednego przypadku, aby umożliwić racjonalne podejście do tych zmian.
Słowa kluczowe
Guz podśluzówkowy, ultrasonografia endoskopowa, GIST.
Przypadek kliniczny
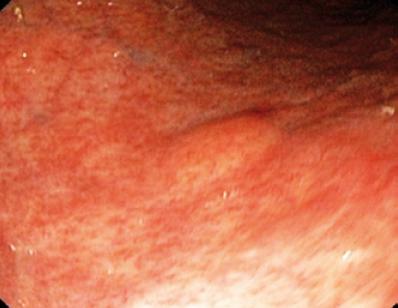
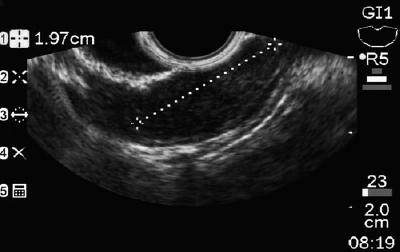
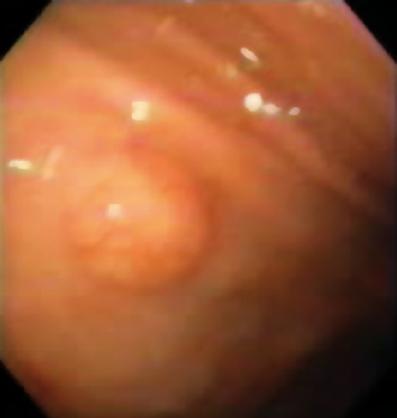
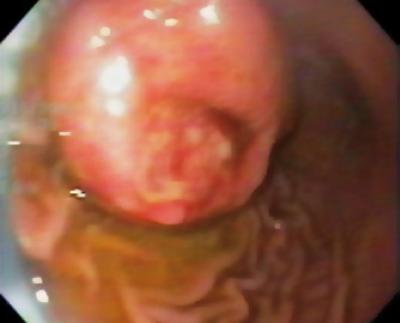
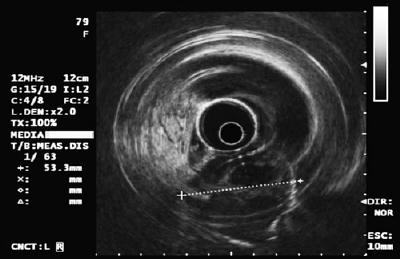
50-letni mężczyzna z dyspepsją został skierowany na górną endoskopię, w której stwierdzono 9-milimetrową zmianę podnabłonkową w trzonie żołądka (ryc. 1). Biopsja leżącej nad nią błony śluzowej była prawidłowa. Pacjent nie miał wcześniejszego wywiadu chorobowego, a jego badanie przedmiotowe było prawidłowe.
Rycina 1. Zmiana podnabłonkowa w żołądku.
Podejście wstępne: What could we do then?
Masa lub wypukłość w świetle narządu pokrytego prawidłowym nabłonkiem nazywana jest zmianą podnabłonkową. Są to rzadkie zmiany, których obecność przewiduje się w 1 na 300 endoskopii (1, 2). Przyczyną mogą być wewnątrzpochodne łagodne lub złośliwe zmiany ściany przewodu pokarmowego lub zewnątrzpochodny ucisk spowodowany przez prawidłowe lub patologiczne struktury sąsiednie (3).
Zmiany te są zwykle wykrywane przypadkowo i często nie mają związku z objawami, jak to miało miejsce w przypadku naszego pacjenta. Może to budzić wątpliwości lekarza, czy powinien on przeprowadzić bardziej szczegółowe badania i wykonać dodatkowe (4). Naszym zdaniem wszystkie te zmiany powinny być ocenione w celu wyjaśnienia ich pochodzenia. Zawsze powinniśmy pobrać biopsję z leżącej nad nimi błony śluzowej (chyba że podejrzewamy pochodzenie naczyniowe lub torbielowate), ponieważ wiele z tych zmian może mieć swoje źródło w blaszce właściwej lub mięśniówce błony śluzowej. W takich przypadkach można do nich dotrzeć za pomocą kleszczyków i postawić precyzyjną diagnozę. Jeśli biopsja jest prawidłowa, to właśnie w tym miejscu musimy określić, czy powinniśmy przerwać czy kontynuować badanie.
Po wykonaniu endoskopii i wykryciu zmiany podnabłonkowej możemy natychmiast przystąpić do jej oceny. Na początku musimy opisać jej wielkość, kształt, kolor i ruchomość, a także to, czy pulsuje, czy nie. Na koniec możemy ocenić jej konsystencję za pomocą zamkniętych kleszczyków biopsyjnych, co pozwoli nam stwierdzić, czy jest ona torbielowata, lita czy miękka, wgłębna i poduszkowata (zmiana, która powoli się odbudowuje). Poduszkowate zmiany z żółtą aureolą są wysoce sugestywne dla tłuszczaków. Jeśli zmiana jest lekko nieregularna w błonie śluzowej i ma centralne wgłębienie, sugeruje to ektopową trzustkę. Zazwyczaj torbiele lub żylaki mają gładką, symetryczną błonę śluzową. GIST-y (gastrointestinal stromal tumors) mogą być lekko owrzodzone, ale są twarde i ruchome (9). Przydatna jest również zmiana pozycji pacjenta, aby wykluczyć możliwość wystąpienia zmiany zewnątrzpochodnej, której wygląd endoskopowy zmieni się, jeśli pacjent zmieni pozycję, wykona wdech lub jeśli żołądek pacjenta wypełni się powietrzem (10-12).
Jaka jest diagnoza różnicowa?
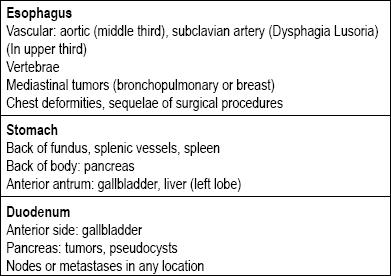
Istnieje wiele rodzajów zmian w przewodzie pokarmowym, które można zakwalifikować jako podnabłonkowe. Ich przyczyny zwykle zależą od tego, czy zmiana jest zlokalizowana w przełyku, żołądku, dwunastnicy czy odbytnicy. Kolejną kwestią, którą należy rozważyć, jest to, czy jest to rzeczywiście zmiana w ścianie, czy jest to ucisk zewnątrzpochodny, ponieważ istnieją struktury wokół całego przewodu pokarmowego, które mogą prowadzić do ucisku (Tabela 1) (5-8).
Tabela 1. Podstawowe przyczyny ucisków zewnątrzustrojowych górnego odcinka przewodu pokarmowego.
Czy wszystkie zmiany chorobowe powinny być oceniane za pomocą endoskopowej ultrasonografii (EUS)?
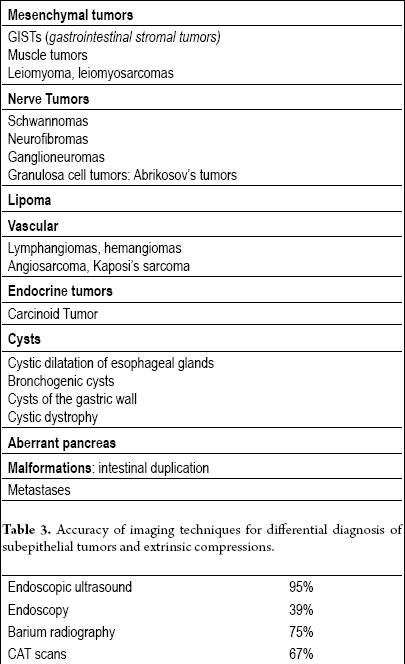
Właściwie wszystkie zmiany podnabłonkowe (Tabela 2) muszą być oceniane za pomocą dodatkowych technik obrazowania, ale jeśli zmiana ma mniej niż centymetr średnicy (zwłaszcza jeśli jest żółta), ocena nie jest konieczna, ponieważ istnieje duże prawdopodobieństwo, że jest to tłuszczak.
Tabela 2. Podnabłonkowe guzy przewodu pokarmowego.
Endoluminalna lub endoskopowa ultrasonografia (EUS) jest techniką z wyboru (13, 14). Dokładność EUS w różnicowaniu ucisku pozaluminalnego od guza podnabłonkowego wynosi ponad 95%. Jest to wynik znacznie lepszy niż w przypadku innych technik obrazowania, takich jak konwencjonalna ultrasonografia czy tomografia komputerowa (15-17) (Tabela 3).
Tabela 3. Dokładność technik obrazowania w diagnostyce różnicowej guzów podnabłonkowych i ucisków zewnątrzwydzielniczych.
Po ustaleniu, że zmiana jest wewnątrzścienna i nie jest uciskiem zewnątrzwydzielniczym, musimy ocenić, do której warstwy ściany odpowiada. Normalnie ściana żołądka dzieli się na błonę śluzową, podśluzową, mięśniówkę właściwą i błonę surowiczą. Warstwa śluzowa dzieli się na nabłonek, błonę podstawną, lamina propria i błonę śluzową mięśniową. Za pomocą EUS i sprzętu radiowego ścianę można podzielić na 5 warstw (18):
Pierwsza hiperechogeniczna warstwa odpowiada najbardziej powierzchownej części błony śluzowej żołądka.
Druga hipoechogeniczna warstwa odpowiada najgłębszej części błony śluzowej, która może być skorelowana z błoną mięśniową.
Trzecia hiperechogeniczna warstwa odpowiada warstwie podśluzówkowej.
Czwarta hipoechogeniczna warstwa odpowiada samej mięśniówce.
Piąta hiperechogeniczna warstwa odpowiada błonie surowiczej lub adventitii.
Normalnie nie ma zmian w warstwach pierwszej i piątej (19), więc są one ograniczone do trzech warstw. Są one zwykle hipoechogeniczne, bezechowe lub hiperechogeniczne.
Diagnostyka za pomocą ultrasonografii endoskopowej
Opiszemy każdą prezentację zgodnie z jej warstwą.
Warstwa druga
Odpowiada najgłębszej części błony śluzowej lub laminie propria i mięśniówce błony śluzowej. Zmiany powstające w tej warstwie są rzadkie i zwykle hipoechogeniczne.
Zmiany hipoechogeniczne: Większość guzów powstających w tej warstwie to mięśniaki, zwykle leiomyoma. Mogą one mieć zwapnienia, a duże mogą być niejednorodne i wykazywać guzki w przeciwieństwie do małych zmian, które są jednorodne. (20).
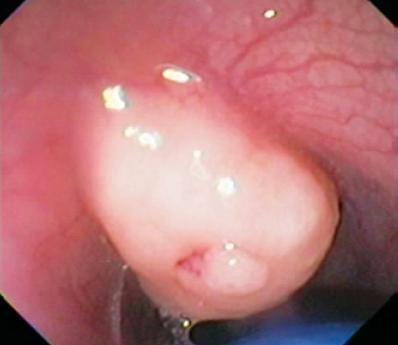
W tej warstwie spotykamy również guzy Abrikosovsa lub komórki ziarniste. Są one zwykle małe i w przeciwieństwie do leiomyoma deformują kulę endoskopu ze względu na swoją twardość (ryc. 2 i 3). W tej warstwie mogą również powstawać rakowiaki, zwykle w dnie lub odbytnicy (ryc. 4).
Ryc. 2. Żółto zabarwiona zmiana podnabłonkowa w dystalnym odcinku przełyku.
Ryc. 3. EUS pokazuje bezechową zmianę w trzeciej warstwie echa, która deformuje piłkę, sugerując 2 cm guz ziarnistokomórkowy
Ryc. 4. Zmiana podnabłonkowa z siateczkowatym wzorem w centrum sugerującym guz neuroendokrynny.
Zmiany bezechowe: Zazwyczaj widzimy, że w tej warstwie mogą powstawać torbiele inkluzyjne lub retencyjne.
Warstwa echa trzecia
Jest to pasmo tkanki, które wygląda hiperechogenicznie w EUS. W tej warstwie mogą powstawać liczne guzy.
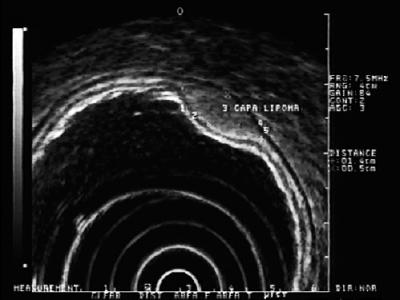
Zmiany hiperechogeniczne: Najczęściej spotykanymi zmianami w tej warstwie są tłuszczaki. Charakteryzują się one jako jednorodne zmiany hiperechogeniczne. Zazwyczaj są one poduszkowate po naciśnięciu kleszczykami endoskopowymi (Rycina 5) (9).
Rycina 5. EUS: hiperechogeniczna zmiana w warstwie podśluzowej 3 zgodna z lipoma.
Neurofibromas tendencyjnie hiperechogeniczne. Wywodzą się one z błony podśluzowej lub mięśniowej właściwej.
Hypoechogeniczne zmiany w tej warstwie mogą odpowiadać ektopowym lub nieprawidłowym trzustkom. Zmiany te są zwykle niejednorodne, a w ich centrum można niekiedy dostrzec bezechowe struktury kanałowe, które mogą odpowiadać przewodom. W endoskopii widoczna jest zmiana z wgłębionym centrum (21).
Zmiany hipoechogeniczne mogą również odpowiadać guzom rakowiaka. Chociaż nie są to guzy podnabłonkowe, ponieważ mają charakter neuroendokrynny, a nie mezenchymalny, mogą być zlokalizowane w ścianie przewodu pokarmowego i dawać ten sam typ guzków. Zwykle są one małe (poniżej 1 cm), hipoechogeniczne (ale bardziej echogeniczne niż mięśniowe) i umiejscowione w błonie śluzowej. Badanie histologiczne jest zwykle możliwe na podstawie biopsji (22, 23).
Chłoniaki żołądka mogą występować również jako hipoechogeniczne lub hiperechogeniczne zmiany w błonie podśluzowej (24).
Zmiany bezechowe obserwowane w tej warstwie są prawdopodobnie strukturami naczyniowymi lub torbielami (25).
Warstwa echogeniczna czwarta
Odpowiada warstwie mięśniowej. Stąd większość guzów w tej warstwie jest pochodzenia mięśniowego.
Zmiany hiperechogeniczne występują bardzo rzadko, ale mogą być związane z chłoniakami, guzami neurogennymi lub przerzutami (26).
Zmiany hipoechogeniczne: Większość guzów tej warstwy jest hipoechogeniczna, głównie guzy stromalne (GIST), gdy są zlokalizowane w żołądku. Jeśli jednak są zlokalizowane w przełyku, zwykle nazywa się je leiomyoma. Inne zmiany, które mogą mieć taki wygląd to przerzuty pochodzące z płuc lub piersi oraz glomus tumor (27). Chłoniaki również mogą naruszać tę warstwę, ale zazwyczaj towarzyszy im zajęcie górnych warstw.
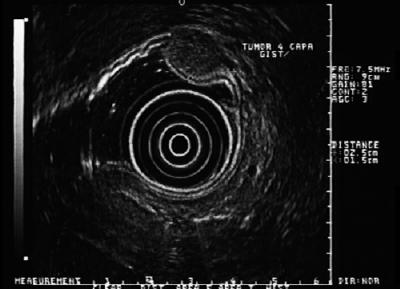
GIST (gastrointestinal stromal tumor) to nazwa zmiany, o której nasza wiedza w ostatnich latach znacznie się poszerzyła (28-30). Guzy te wydają się wywodzić z komórek totipotencjalnych, które są jednocześnie punktami wyjścia tzw. komórek śródmiąższowych Cajala. Można je podzielić na grupy: z przewagą mięśniową, z przewagą nerwową lub z kombinacją obu tych typów. Rozpoznanie stawiane jest na podstawie immunohistochemicznej identyfikacji białka CD-117 (znanego również jako białko c-kit), które jest receptorem błonowym o aktywności kinazy tyrozynowej (31).
Ważność tych zmian polega na tym, że 30% z nich może mieć charakter złośliwy i dawać przerzuty. W samych Stanach Zjednoczonych co roku odnotowuje się od 5 000 do 6 000 przypadków (32). Ich rozmieszczenie w przewodzie pokarmowym jest następujące: żołądek (40-70%), jelito cienkie (20-40%), okrężnica i odbytnica (5-15%) oraz przełyk (<5%) (33). Oznacza to, że jeśli mamy hipoechogeniczną zmianę czwartej warstwy w przełyku, to prawdopodobnie jest to leiomyoma, ale jeśli znajduje się ona w żołądku, to zwykle jest to GIST (Rycina 6, 7 y 8). Większość pacjentów jest w piątej lub szóstej dekadzie życia. Zazwyczaj mają zmianę zlokalizowaną w warstwie czwartej lub muscularis propria, chociaż może być ona również zlokalizowana w muscularis mucosa (34). Większość pacjentów jest bezobjawowa, dopóki guz nie stanie się wystarczająco duży, aby owrzodzić, krwawić lub dawać przerzuty.
Ryc. 6. EUS pokazuje hipoechogeniczną zmianę w warstwie czwartej zgodną z GIST.
Ryc. 7. Zmiana owrzodzona sugerująca GIST.
Ryc. 8. EUS z ryciny 7 pokazuje hipoechogeniczną zmianę w czwartej warstwie echa wysoce sugerującą GIST, ponad 5 cm.
Z tego powodu, jeśli zidentyfikujemy GIST większy niż 3 cm, jest to wskazanie do operacji, nawet jeśli jest bezobjawowy (inni autorzy sugerują granicę 4 cm). (35). Natomiast zmiany mniejsze niż 3 cm stanowią wyzwanie dla postępowania, ponieważ większość z nich jest łagodna. Niemniej jednak, należy wyjaśnić, że wszystkie GIST-y są potencjalnie złośliwe, a małe GIST-y z przerzutami były opisywane, szczególnie w dolnym odcinku przewodu pokarmowego. Obecnie nie jesteśmy w stanie przewidzieć za pomocą ultrasonografii endoskopowej potencjału złośliwości GIST. Niemniej jednak wiemy, że zmiany większe niż 4 cm, mające nieregularne granice i/lub torbielowate przestrzenie w ich obrębie, lub posiadające ogniska echogeniczne mają wysokie prawdopodobieństwo złośliwości (36).
Z drugiej strony endoskopowa aspiracja cienkoigłowa pod kontrolą USG (EUS-FNA) może nie tylko zdiagnozować GIST poprzez identyfikację CD-117, ale również obecność białka Ki-67, które wskazuje na proliferację i sugeruje złośliwość (37). Należy podkreślić, że zmiany typu GIST są bardzo niebezpieczne. Musimy je stale obserwować, oceniając wielkość guza i tempo proliferacji zgodnie z ustalonym ryzykiem. Nawet po całkowitej resekcji zmiany te mogą nawracać, szczególnie w miejscu pochodzenia, ale także w otrzewnej czy wątrobie. 40% do 90% zmian nawraca pomimo całkowitej resekcji. 50% nawrotów dotyczy wątroby. GIST-y mają 4-krotnie większe ryzyko nawrotu, gdy miejscem pierwotnym jest jelito, niż gdy znajduje się ono w żołądku (38).
Jaka jest dokładność endoskopowej ultrasonografii?
Wielokrotne badania wykazały, że EUS jest bardzo dokładna w określaniu, czy zmiana znajduje się na ścianie, czy nie, oraz w ustalaniu, z której warstwy ściany pochodzi zmiana. Pozwala to na wybór najlepszego podejścia diagnostycznego. W jednym z badań określono warstwę źródłową u 48 z 50 pacjentów (96%) z potwierdzeniem chirurgicznym (39). Zgodność międzyobserwacyjna jest bardzo dobra, szczególnie w przypadku identyfikacji zmian takich jak leiomyoma i zmiany naczyniowe. Należy zaznaczyć, że wygląd sonograficzny zmian nie pozwala ze 100% pewnością określić ich przyczyny. Badanie Karaca i wsp. (40) przeprowadzone na 22 pacjentach, u których wykonano EUS, a następnie mukozektomię wykazało, że dokładność EUS wynosiła tylko 45%. Jednak zmiany były w większości mniejsze niż 20 mm, a dokładność USG wzrosła do 66% w odróżnianiu guzów złośliwych od łagodnych. Ponieważ kryteria sonograficzne mogą być nieprecyzyjne, wydaje się rozsądne, że powinniśmy, jeśli to możliwe, dążyć do uzyskania konkretnego rozpoznania. Można to osiągnąć za pomocą EUS-FNA lub resekcji błony śluzowej zmiany, jak wykazano w niniejszej pracy. Mekky i wsp. badali 141 pacjentów poddanych EUS-FNA sprawdzanych chirurgicznie. Stwierdzili dokładność 95,6% dla swoich ostatecznych wyników (41).
Monitorowanie, biopsja punkcyjna czy resekcja?
Decyzja o monitorowaniu, zastosowaniu lub wykonaniu resekcji zależy od kilku czynników, w tym od wielkości zmiany, jej wyglądu endoskopowego, warstwy pochodzenia i jej cech echogenicznych. Jeśli mamy do czynienia ze zmianą podnabłonkową mniejszą niż 1 cm, nie ma potrzeby wykonywania większej liczby badań, ale należy wykonać kontrolną endoskopię. Jeśli zmiana jest większa niż 1 cm, konieczne jest wykonanie EUS. Jeśli zmiana jest mała i dotyczy pierwszej, drugiej lub trzeciej warstwy echa, można wykonać diagnostyczną resekcję błony śluzowej, która ma również działanie terapeutyczne. Jeśli jednak zmiana znajduje się w czwartej warstwie i ma mniej niż 2 cm, zaleca się monitorowanie wyłącznie za pomocą endoskopii. Jeśli zmiana mierzy od 2cm do 5cm, idealnym rozwiązaniem jest EUS-FNA. Jeśli okaże się, że jest to zmiana łagodna, badanie kontrolne można wykonać po 6 miesiącach. Jeśli nie urosła, nie jest wymagana dalsza obserwacja. Jeśli jest złośliwa, ma potencjał złośliwości lub jest większa niż 5 cm, zalecane jest leczenie (42).
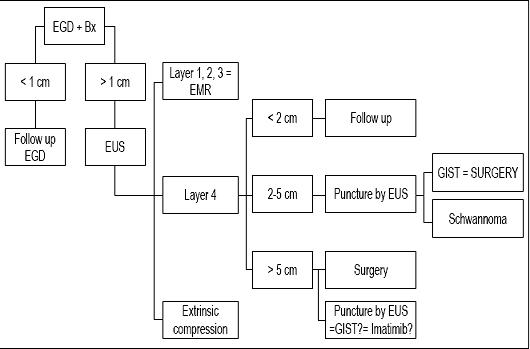
Podsumowując, ponieważ u naszego pacjenta zmiana była mniejsza niż 1 cm, uważamy, że jego zmiana zasługiwała jedynie na kontrolną endoskopię (patrz algorytm, ryc. 9). Ponowne badanie kontrolne zaproponowano za rok. Jeśli zmiana nie powiększy się, dodatkowe badania kontrolne będą planowane co 2 lub 3 lata, ale jeśli będzie się powiększać, zaproponujemy EUS-FNA i badanie immunohistochemiczne.
Rys. 9. Algorytm postępowania w zmianach podnabłonkowych. EGD: górna endoskopia. Bx: biopsja. EUS: endoskopowa ultrasonografia. EMR: endoskopowa resekcja błony śluzowej.
1. Polkowski M, Butruk E. Submucosal lesions. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Endoscopic approach to gastrointestinal stromal tumors. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Czak A. EUS w guzach podśluzówkowych. Gastrointest Endosc 2002; 56(4 Suppl.): S43-8.
4. Polkowski M. Endoskopowa ultrasonografia i endoskopowa ultrasonograficzna aspiracja cienkoigłowa w diagnostyce złośliwych guzów podśluzówkowych. Endoskopia 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. American gastroenterological association institute technical review on the management of gastric subepithelial masses. Gastroenterology 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Accuracy of endoscopic ultrasonography in upper gastrointestinal submucosal lesions: a prospective multicenter study. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, et al. Endosonographic features of gastric ectopic pancreases distinguishable from mesenchymal tumors. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. Endosonographic features of esophageal granular cell tumors. Endoscopy 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Rola ultrasonografii endoskopowej w postępowaniu w guzach podśluzówkowych przełyku i żołądka. Acta Endoscop 1996; 26: 307-12.
10. Ponder TB. Collins BT. Fine needle aspiration biopsy of gastric duplication cysts with endoscopic ultrasound guidance. Acta cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Endoscopic mucosal resection for gastric neoplasms. Techniki w endoskopii przewodu pokarmowego 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Endoskopowa resekcja błony śluzowej. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Endoscopic ultrasonography in gastrointestinal stromal tumors (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografia digestiva. Barcelona: Ed. Masson 1998. s. 21-27.
15. Yamada Y, Kida M, Sakaguchi. A study on myogenic tumors of the upper gastrointestinal tract by endoscopic ultrasonography with special reference to the differential diagnosis of benign and malignant lesions. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr MV, Rosch T, et al. Evaluation of submucosal upper gastrointestinal tract lesions by endoscopic ultrasound. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Interobserver agreement for EUS in the evaluation and diagnosis of submucosal masses. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Endoscopic ultrasonography in the diagnosis of gastric submucosal tumor. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Haggitt RC, et al. Histologic correlates of gastrointestinal ultrasound images. Gastroenterology 1989; 96: 433-41.
20. Czak A, Isenberg G, Kobayashi K, et al. Prospective evaluation of an over-the-wire catheter US probe. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Endoscopic ultrasonography for the evaluation of smooth muscle tumors in the upper gastrointestinal tract: an experience with 42 cases. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Ultrasonografia endoskopowa. Endoscopy 2003; 35: 127-35
23. Byrne MF, Jowell PS. Gastrointestinal imaging: endoscopic ultrasound. Gastroenterologia 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Faigel DO. Yield of tissue sampling for submucosal lesions evaluated by EUS. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Endoscopic ultrasonography for the initial staging and follow-up in patients with low-grade gastric lymphoma of mucosa-associated lymphoid tissue treated medically. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, DiMagno EP. Diagnosis of foregut duplication cysts by endoscopic ultrasonography. Gastroenterology 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. Endosonographic differentiation of benign and malignant stromal cell tumors. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Endosonographic features predictive of benign and malignant gastrointestinal stromal cell tumours. Gut 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. Pathology and diagnostic criteria of gastrointestinalstromal tumors (GISTs): A review. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, et al. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med 2002; 347: 472-480.
31. Greenson JK. Gastrointestinal stromal tumors and other mesenchymal lesions of the gut. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Gastrointestinal stromal tumors: From a surgical to a molecular approach. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. Management of malignant gastrointestinal stromal tumours. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. GI stromal tumors. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Measurement of lesions by endoscopy: an overview. Endoscopy 1995; 27: 694-697.
36. Roberts PJ, Eisenberg B. Clinical presentation of gastrointestinal stromal tumors and treatment of operable disease. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. A study on myogenic tumors of the upper gastrointestinal tract by endoscopic ultrasonography with special reference to the differential diagnosis of benign and malignant lesions. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, et al. Prognostic assessment of gastrointestinal stromal tumor. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Gastric stromal tumors. A clinicopathologic study of 77 cases with correlation of features with nonagressive and aggressive clinical behaviors. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. Submucosal tumors and thick gastric fols. ASGE- 2002. s. 77-81.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. Accuracy of EUS in the evaluation of small gastric subepithelial Lesions. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. Diagnostic utility of EUS-guided FNA in patients with gastric submucosal tumors. Gastrointest Endosc 2010; 71: 913-9.
1. Polkowski M, Butruk E. Submucosal lesions. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Endoscopic approach to gastrointestinal stromal tumors. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Czak A. EUS w guzach podśluzówkowych. Gastrointest Endosc 2002; 56(4 Suppl.): S43-8.
4. Polkowski M. Endoscopic ultrasound and endoscopic ultrasound-guided fine needle aspiration for the diagnosis of malignant submucosal tumors. Endoscopy 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. American gastroenterological association institute technical review on the management of gastric subepithelial masses. Gastroenterology 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Accuracy of endoscopic ultrasonography in upper gastrointestinal submucosal lesions: a prospective multicenter study. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, et al. Endosonographic features of gastric ectopic pancreases distinguishable from mesenchymal tumors. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. Endosonographic features of esophageal granular cell tumors. Endoscopy 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Rola ultrasonografii endoskopowej w postępowaniu w guzach podśluzówkowych przełyku i żołądka. Acta Endoscop 1996; 26: 307-12.
10. Ponder TB. Collins BT. Fine needle aspiration biopsy of gastric duplication cysts with endoscopic ultrasound guidance. Acta cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Endoscopic mucosal resection for gastric neoplasms. Techniki w endoskopii przewodu pokarmowego 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Endoskopowa resekcja błony śluzowej. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Endoscopic ultrasonography in gastrointestinal stromal tumors (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografia digestiva. Barcelona: Ed. Masson 1998. s. 21-27.
15. Yamada Y, Kida M, Sakaguchi. A study on myogenic tumors of the upper gastrointestinal tract by endoscopic ultrasonography with special reference to the differential diagnosis of benign and malignant lesions. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr MV, Rosch T, et al. Evaluation of submucosal upper gastrointestinal tract lesions by endoscopic ultrasound. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Interobserver agreement for EUS in the evaluation and diagnosis of submucosal masses. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Endoscopic ultrasonography in the diagnosis of gastric submucosal tumor. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Haggitt RC, et al. Histologic correlates of gastrointestinal ultrasound images. Gastroenterology 1989; 96: 433-41.
20. Czak A, Isenberg G, Kobayashi K, et al. Prospective evaluation of an over-the-wire catheter US probe. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Endoscopic ultrasonography for the evaluation of smooth muscle tumors in the upper gastrointestinal tract: an experience with 42 cases. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Ultrasonografia endoskopowa. Endoscopy 2003; 35: 127-35
23. Byrne MF, Jowell PS. Gastrointestinal imaging: endoscopic ultrasound. Gastroenterology 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Faigel DO. Yield of tissue sampling for submucosal lesions evaluated by EUS. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Endoscopic ultrasonography for the initial staging and follow-up in patients with low-grade gastric lymphoma of mucosa-associated lymphoid tissue treated medically. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, DiMagno EP. Diagnosis of foregut duplication cysts by endoscopic ultrasonography. Gastroenterology 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. Endosonographic differentiation of benign and malignant stromal cell tumors. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Endosonographic features predictive of benign and malignant gastrointestinal stromal cell tumours. Gut 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. Pathology and diagnostic criteria of gastrointestinalstromal tumors (GISTs): A review. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, et al. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med 2002; 347: 472-480.
31, Greenson JK. Gastrointestinal stromal tumors and other mesenchymal lesions of the gut. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Gastrointestinal stromal tumors: From a surgical to a molecular approach. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. Management of malignant gastrointestinal stromal tumours. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. GI stromal tumors. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Measurement of lesions by endoscopy: an overview. Endoscopy 1995; 27: 694-697.
36. Roberts PJ, Eisenberg B. Clinical presentation of gastrointestinal stromal tumors and treatment of operable disease. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. A study on myogenic tumors of the upper gastrointestinal tract by endoscopic ultrasonography with special reference to the differential diagnosis of benign and malignant lesions. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, et al. Prognostic assessment of gastrointestinal stromal tumor. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Gastric stromal tumors. A clinicopathologic study of 77 cases with correlation of features with nonagressive and aggressive clinical behaviors. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. guzy podśluzówkowe i grube pęcherzyki żołądkowe. ASGE- 2002. s. 77-81.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. Accuracy of EUS in the evaluation of small gastric subepithelial Lesions. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. Diagnostic utility of EUS-guided FNA in patients with gastric submucosal tumors. Gastrointest Endosc 2010; 71: 913-9.