Zawartość
- 1 Wprowadzenie
- 2 Najważniejsze cechy strukturalne
- 3 Function
- 4 Relevance to Human Health & Disease
- 5 External Links
Wprowadzenie
Human gastric lipase (HGL, E.C. 3.1.1.3) (PBD ID: 1hlg) jest lipazą, która jest odpowiedzialna za rozpoczęcie trawienia tłuszczów pokarmowych w żołądku. Ten kwaśno-stabilny enzym jest wydzielany przez komórki główne dna żołądka ludzkiego i katalizuje 10-20% wszystkich procesów lipolitycznych (tj. tych, które obejmują rozkład tłuszczów) u zdrowych osób dorosłych. HGL specyficznie katalizuje hydrolizę triacylogliceroli w celu wytworzenia diacylogliceroli i produktu ubocznego karboksylanu, procesu, który ułatwia późniejszy rozkład tłuszczu przez lipazę trzustkową. Jeśli chodzi o implikacje chorobowe, istnieją dowody sugerujące, że wydzielanie HGL jest zmienione u osób z zapaleniem błony śluzowej żołądka (najczęstszy stan żołądka, w którym wyściółka żołądka jest w stanie zapalnym). Ponadto osoby z upośledzoną funkcją trzustki (a zatem zmniejszonym poziomem lipazy trzustkowej) muszą w dużym stopniu polegać na HGL w celu trawienia tłuszczów w diecie.
Najważniejsze cechy strukturalne
HGL, enzym hydrolase składający się z dwóch podjednostek o długości 379 reszt aminokwasowych, posiada strukturę zawierającą reszty Ser-153, His-353 i Asp-324. Struktura ta jest niezbędna do rozkładu lipidów, skoordynowana z resztami Leu-67 i Gln-154, które służą do stabilizacji stanu przejściowego. Strukturalnie, ludzka lipaza żołądkowa wykazuje złożoność (arkusze beta pokazane na żółto, heliksy alfa pokazane na pomarańczowo, zwoje spiralne pokazane na zielono, a rozdzielone węglowodany pokazane jako fioletowe). HGL przy resztach 215-244 ustępuje miejsca (hydrofobowym regionom zaznaczonym na czerwono) zarówno otaczającym miejsce aktywne, jak i łączącym się z pokrywą. Uważa się, że te obszary przyciągają lipidy i promują dokowanie .
Funkcja
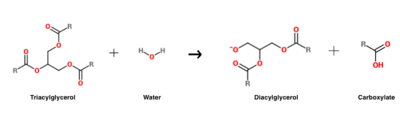
Reakcja hydrolizy triacylogliceroli, która jest katalizowana przez HGL .
HGL funkcjonuje w optymalnym pH około pięciu i głównie katalizuje hydrolizę krótkołańcuchowych triacylogliceroli .
Jako esteraza z katalitycznie aktywną seryną, HGL wykazuje mechanizm przypominający ustalony mechanizm esterazy serynowej. Seryna w miejscu aktywnym, zlokalizowana w obrębie , jest ułatwiana najpierw przez sąsiednie utworzenie mostka solnego pomiędzy Asp-136 i His-152, co indukuje przywłaszczenie protonu z Ser-153. Teraz silnie nukleofilowy Ser-153 zaatakuje węgiel karbonylowy grupy octanowej w cząsteczce triacyloglicerolu. Tetraedryczny gatunek jest stabilizowany przez dziurę oksyanionową. Jednakże, jak tylko gatunek ten rozpadnie się na kowalencyjnie połączony octan i lipazę, seryna ulega deacylacji, w której woda działa jako nukleofil. Ten ostatni krok przywraca Ser-153 do stanu protonowanego.
Znaczenie dla zdrowia ludzkiego & Choroba
Działanie hydrolityczne HGL jest nieco pomocnicze w zdrowych dorosłych, w których HGL moduluje 10-20% dietetycznego rozkładu tłuszczu najwyżej . Jednak obecność HGL jest kluczowa u wcześniaków, które często wykazują słabą funkcję trzustki, jak również dorosłych z patologiczną niewydolnością trzustki (np. przewlekłe zapalenie trzustki). Osoby te nie są w stanie wyprodukować odpowiedniej ilości lipazy trzustkowej i dlatego muszą polegać głównie na HGL do trawienia tłuszczów w diecie. U tych osób, HGL jest odpowiedzialny za hydrolizę 30-60% triglicerydów z diety .
Tomasik i wsp. (2013) badali hormonalną regulację wydzielania HGL u dzieci i młodzieży z zapaleniem błony śluzowej żołądka. Aktywność HGL porównywano w trzech grupach: jedna grupa eksperymentalna składająca się z nastolatków, u których zdiagnozowano zapalenie żołądka wywołane przez Helicobacter pylori (n = 10), druga grupa eksperymentalna składająca się z nastolatków z postacią zapalenia żołądka nie wywołaną przez H. pylori (n = 10) oraz jedna grupa kontrolna zdrowych nastolatków (n = 14). Aktywność HGL, oprócz osoczowych stężeń glukagonopodobnego peptydu-1, cholecystokininy i glukozozależnego peptydu insulinotropowego, była obserwowana poprzez analizę próbek soku żołądkowego, które zostały pobrane poprzez pomiary endoskopowe od każdego pacjenta.
Pacjenci, u których powierzchowne zapalenie żołądka zostało wywołane przez patogeny inne niż H. pylori, wykazywali niższe poziomy aktywności HGL w porównaniu zarówno ze zdrową młodzieżą (p < .005), jak i tymi, u których rozpoznano zapalenie żołądka wywołane przez H. pylori (p < .005). Średnie osoczowe stężenia glukozozależnego peptydu insulinotropowego były niższe u osób zdrowych (p < 0,005) niż u osób z zapaleniem żołądka bez H. pylori (p < .003) i u osób z zapaleniem żołądka wywołanym przez H. pylori (p < 0,01). Regulacja wydzielania HGL przez glukagonopodobny peptyd-1 (GLP-1) i cholecystokininę (CCK) była zatem zmieniona u młodzieży z zapaleniem błony śluzowej żołądka; na poparcie tego odkrycia sugeruje się w istniejącej literaturze, że GLP-1 i CCK hamują wydzielanie HGL . Ponadto stwierdzono, że peptyd insulinotropowy zależny od glukozy jest silnym aktywatorem aktywności ludzkiej lipazy żołądkowej we wszystkich grupach eksperymentalnych i kontrolnych .
PDB – 1HLG: http://www.rcsb.org/pdb/explore.do?structureId=1HLG
.