- What makes a molecule polar?
- Take a look at the structural formula of carbon dioxide:
- Why is water polar?
Woda jest cząsteczką polarną, ponieważ jej tlen jest silnie elektroujemny i jako taki przyciąga parę elektronów do siebie (z dala od dwóch atomów wodoru), zyskując w ten sposób lekko ujemny ładunek.
Polarność cząsteczki zależy nie tylko od atomów wchodzących w jej skład, ale także od tego, jak są one rozmieszczone wokół atomu centralnego, czyli od przestrzennego rozmieszczenia tych atomów. Aby to lepiej zrozumieć, omówmy ten temat bardziej szczegółowo.
Co sprawia, że cząsteczka jest polarna?
Polarność cząsteczki związana jest z przesunięciem elektronów w określonym kierunku. To z kolei zależy od polarności wiązań obecnych w cząsteczce, ponieważ wiązania te również zawierają elektrony.
W obrębie cząsteczki atom o większej sile przyciągania elektronów do siebie (tzn, jest bardziej elektroujemny niż drugi atom) uzyska niewielki ładunek ujemny na sobie, a wiązanie między tymi dwoma atomami stanie się polarne.
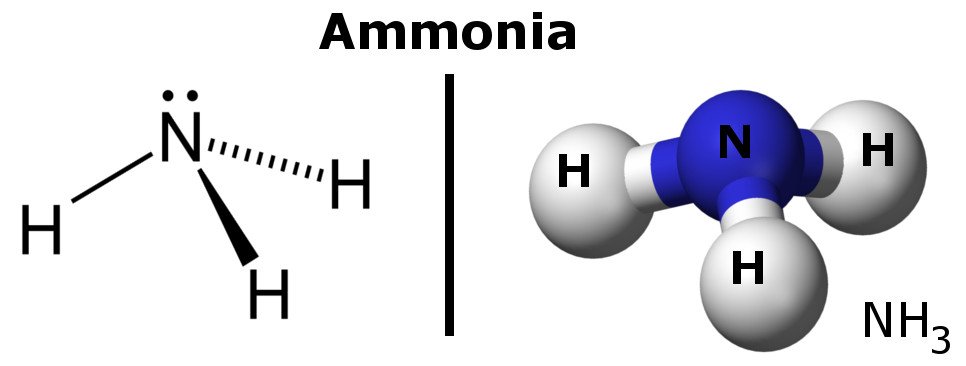
Ammoniak jest cząsteczką polarną, ponieważ posiada regiony niewielkich ładunków ujemnych i dodatnich.
W sumie można powiedzieć, że gęstość elektronów w wiązaniu polarnym gromadzi się w kierunku jednego końca wiązania, co powoduje, że ten koniec posiada niewielki ładunek ujemny, podczas gdy drugi koniec posiada niewielki ładunek dodatni. To sprawia, że cząsteczka jest polarna.
Podobnie, jeśli cząsteczka nie posiada regionów o ładunku dodatnim i ujemnym, jest uważana za niepolarną.
Jednakże ciekawą rzeczą do zauważenia jest to, że im większa różnica elektroujemności, tym bardziej polarne będzie wiązanie w cząsteczce. Związki karbonylowe są polarne, ponieważ węgiel karbonylowy jest lekko dodatni. Tak więc, czy dwutlenek węgla, który zawiera dodatni węgiel i dwa częściowo ujemne oksygeny, nie powinien być polarny?
Dwutlenek węgla składa się z dwóch atomów tlenu przyłączonych do atomu węgla. Atomy tlenu są o wiele bardziej elektronegatywne niż atomy węgla, i jako takie powinny posiadać częściowo ujemny ładunek, podczas gdy atom węgla powinien być lekko dodatnio naładowany. Jednak, co ciekawe, tak się nie dzieje.
Spójrz na wzór strukturalny dwutlenku węgla:
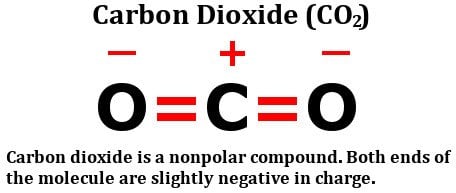
Składa się on z dwóch jednakowo elektronegatywnych atomów tlenu, owszem, ale spójrz, jak te atomy są rozmieszczone wokół atomu węgla. Oba stoją pod doskonałymi kątami 180 stopni od węgla. W konsekwencji, ciągną gęstość elektronów od węgla z równą siłą w przeciwnych kierunkach. W rezultacie gęstość elektronów na atomie węgla pozostaje nienaruszona, co sprawia, że cząsteczka dwutlenku węgla jest niepolarna.
Dwutlenek węgla jest doskonałym przykładem tego, jak geometria cząsteczki odgrywa kluczową rolę w określaniu, czy jest ona polarna czy niepolarna. Przyjrzyjmy się teraz cząsteczce wody:
Dlaczego woda jest polarna?
Wzór chemiczny wody to H20, co oznacza, że zawiera ona dwa atomy wodoru i jeden atom tlenu. Atomy wodoru mają tylko jeden elektron w swojej powłoce, podczas gdy atom tlenu ma 6 elektronów walencyjnych.
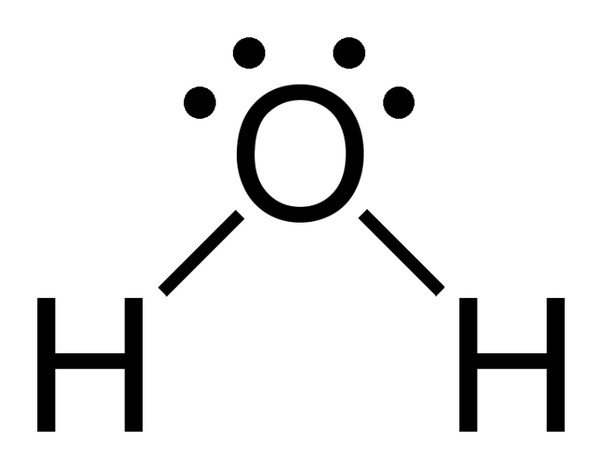
Zauważ 2 samotne pary elektronów na atomie tlenu w wodzie.
Ponieważ tlen ma 6 elektronów w swojej powłoce walencyjnej, dzieli elektron z każdym atomem wodoru. W ten sposób, to jest w lewo z 4 unbonded elektronów w jego 2 orbitali. Te związane i niezwiązane pary elektronów układają się w kształt tetraedryczny wokół tlenu, dlatego dwa wiązania wydają się mieć wygięty kształt.
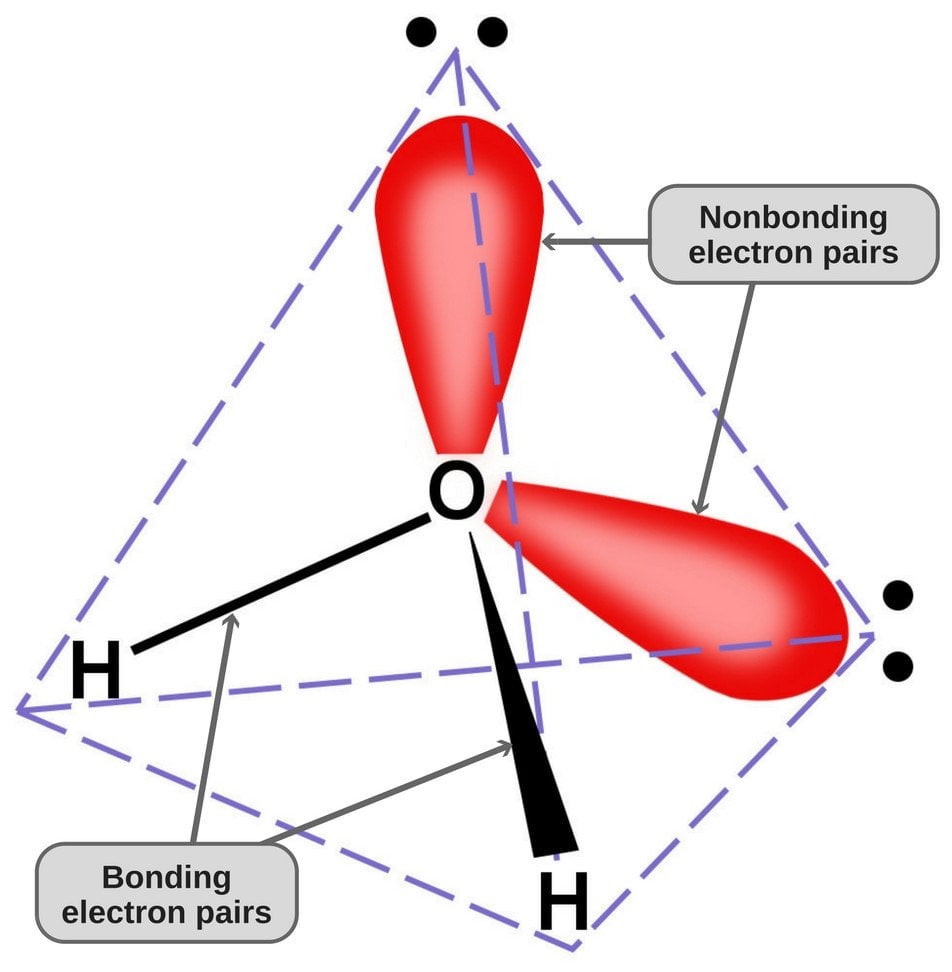
Tetraedryczna geometria cząsteczki wody.
Teraz, oba atomy tlenu i wodoru mają różne wartości elektroujemności (wartość elektroujemności wodoru wynosi 2,1, podczas gdy elektroujemność tlenu wynosi 3,5); dlatego oba wiązania są polarne. Ponieważ tlen jest bardziej elektronegatywny niż wodór, gęstość elektronów przesuwa się w kierunku tlenu w obu tych wiązaniach, czyniąc w ten sposób region wokół tlenu bardziej ujemnym niż obszary wokół dwóch atomów wodoru.
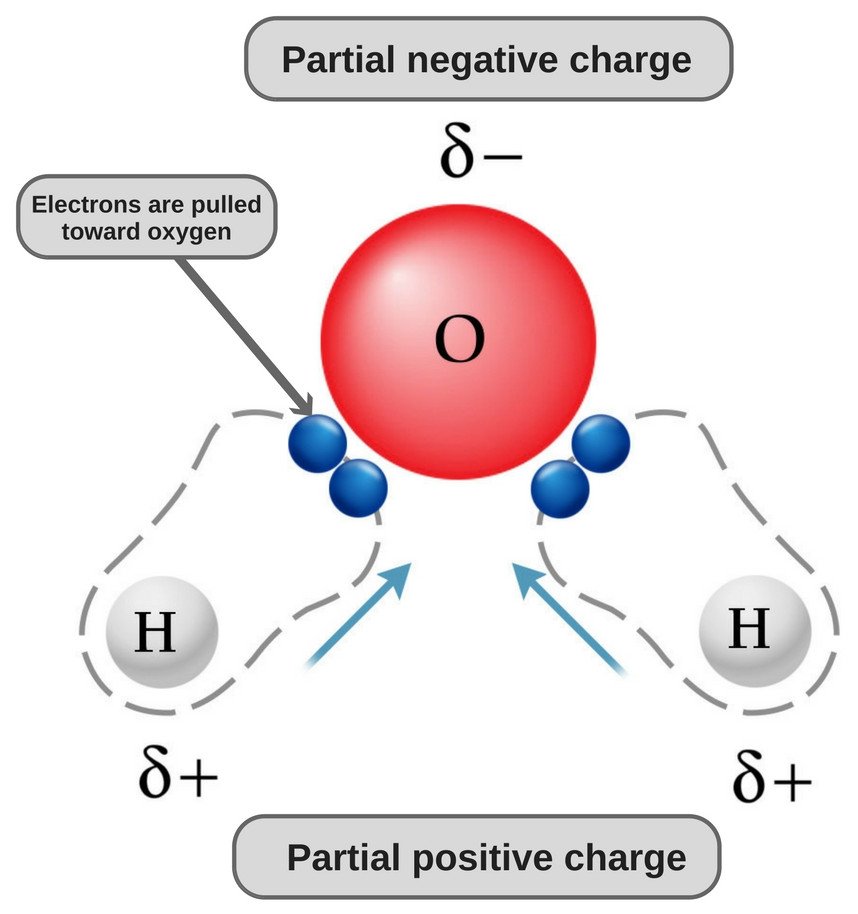
To dlatego cząsteczka wody staje się polarna!
.