Interleukina 12 (IL-12) jest cytokiną prozapalną o masie cząsteczkowej 70 kDa składającą się z dwóch podjednostek, IL-12p35 (35 kDa) i IL-12p40 (40 kDa). Unikalna heterodimeryczna struktura jest wspólna z trzema członkami rodziny tj. IL-23 (p19/p40), IL-27(p28/Ebi3) i IL-35 (p35/Ebi3).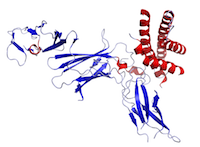
IL-12, określana również jako IL-12p70, została niezależnie odkryta w 1989 roku przez Kobayashi M. et al. (określona jako czynnik stymulujący komórki natural killer) oraz w 1990 roku przez Stern A.S. et al. (określany jako czynnik dojrzewania limfocytów cytotoksycznych).
Figura To jest struktura IL-12 utworzona przy użyciu danych z Protein Data Bank (PDB: 1F45) i wyrenderowana przy użyciu PyMOL.
IL-12 indukuje różnicowanie naiwnych komórek T CD4+ w komórki Th1 i aktywuje komórki NK. Po aktywacji, komórki NK produkują IFN-γ i IL-2, ale także IL-12, co wskazuje na mechanizm dodatniego sprzężenia zwrotnego. IL-12 chroni komórki CD4+ Th1 przed indukowaną antygenem śmiercią apoptotyczną i wykazuje synergistyczne działanie z IL-18 w rozwoju komórek Th1. Ponadto IL-12 odgrywa rolę w handlu i migracji komórek T poprzez indukowanie funkcjonalnych cząsteczek adhezyjnych, takich jak ligand P- i E-selektyny, na komórkach Th1, ale nie na komórkach Th2. Dlatego też komórki Th1 są selektywnie rekrutowane do miejsc promujących odpowiedź immunologiczną Th1. Funkcjonalnie komórki te pomagają w usuwaniu patogenów wewnątrzkomórkowych, w przeciwieństwie do komórek Th2, które są odpowiedzialne za odporność humoralną, chroniącą przed najeźdźcami zewnątrzkomórkowymi. Równowaga między IL-12, sprzyjającą odpowiedzi Th1, a IL-4, sprzyjającą odpowiedzi Th2, określa wczesną preferencję wyrażoną w odpowiedzi immunologicznej.
IL-12p35 dzielą znaczną homologię sekwencji z cytokiną IL-6, podczas gdy łańcuch p40 jest strukturalnie homologiczny z zewnątrzkomórkową domeną łańcucha α receptora IL-6 (IL-6R). Sugeruje to, że struktura IL-12 wyewoluowała z pierwotnej cytokiny z rodziny IL-6 i jednego z jej receptorów. Chociaż transkrypty IL-12p35 znajdują się w wielu typach komórek, wolna IL-12p35 nie jest wydzielana bez podjednostki IL-12p40. Ta ostatnia podjednostka jest produkowana głównie przez aktywowane monocyty, makrofagi, neutrofile i komórki dendrytyczne. W aktywności biologicznej IL-12p70 pośredniczy wiązanie się z błonowym kompleksem receptorowym (IL-12R) złożonym z dwóch podjednostek: IL-12R-β1 i IL-12R-β2. Podczas gdy podjednostka IL-12R-β1 ulega konstytutywnej ekspresji, ekspresja IL-12R-β2 na komórkach Th1 jest zwiększana przez IFN-γ i koreluje z reaktywnością na IL-12. Po związaniu IL-12 dochodzi do aktywacji szlaku sygnalizacyjnego JAK-STAT, przy czym STAT4 jest dominującym mediatorem odpowiedzi komórek T.
.