Ważne jest, aby znać strukturę Lewisa cząsteczki, aby zrozumieć jej właściwości fizyczne, hybrydyzację i kształt cząsteczki. Dzisiaj będziemy przechodzić przez strukturę Lewisa I3- lub znany również jako jon triodowy, ponieważ ma ładunek ujemny na nim. W cząsteczce tej znajdują się trzy cząsteczki jodu i stąd nazwa związku – Triodek. Dla zrozumienia struktury Lewisa cząsteczki, powinniśmy znać elektrony walencyjne cząsteczki jodu.
Struktura Lewisa
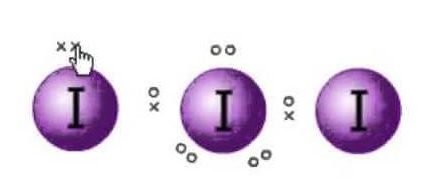
Struktura Lewisa jest reprezentacja elektronów cząsteczek. Istnieją samotne pary i elektrony walencyjne, które pomagają w określaniu hybrydyzacji i kształt cząsteczki. Ponieważ istnieją molekuły jodu, jedna molekuła jodu będzie w centrum. Ponadto, jod znajduje się w siódmej grupie układu okresowego i ma siedem elektronów walencyjnych na swojej zewnętrznej orbicie.

Mamy tu trzy cząsteczki jodu, które wraz z dodatkowym elektronem nadają mu ładunek ujemny. Zatem całkowita liczba elektronów walencyjnych wynosi : 7×3 + 1= 22.
W sumie w tej cząsteczce są 22 elektrony walencyjne. Teraz istnieje reguła oktetu, której przestrzega każdy atom. Zgodnie z tą regułą, każdy atom powinien mieć osiem elektronów na swojej zewnętrznej orbicie. Jeśli w zewnętrznej powłoce centralnego atomu znajduje się 8 elektronów, to dwa inne atomy muszą uzupełnić swój oktet. Ponieważ wszystkie atomy będą potrzebowały ośmiu elektronów w swojej zewnętrznej powłoce aby skompletować oktet, jeden elektron z centralnego atomu jodu zostanie zabrany przez oba sąsiednie atomy jodu. To znaczy 8-1-1=6.
Jak elektrony zostaną podjęte przez obu atomów.
Więc teraz elektrony walencyjne na centralnego atomu jodu będzie sześć. Te sześć elektronów będzie tworzyć samotne pary elektronów, które nie wiążą. Jak tworzy pary elektronów teraz, nie będzie trzy samotne pary i dwie pary wiązań elektronów, jak każdy atom jodu ma wiązanie z centralnego atomu dzieląc jeden elektron każdy w sumie tam 3 samotne pary i 2 pary wiązań na centralnym atomie.
Hybrydyzacja
Do poznania hybrydyzacji każdej cząsteczki, istnieje prosty wzór, który może być używany. Wzór ten jest używany do znalezienia liczby hybrydyzacji, która pomaga w poznaniu hybrydyzacji cząsteczki.
Liczby hybrydowe i hybrydyzacja, którą określa są podane w następujący sposób:
- 2: hybrydyzacja sp
- 3: hybrydyzacja sp2
- 4: hybrydyzacja sp3
- 5: hybrydyzacja
Wzór na znalezienie liczby jest,
Liczba hybrydyzacyjna: Liczba elektronu walencyjnego + monowalentny + (ładunek ujemny) – (ładunek dodatni)/2
Elektronów walencyjnych atomów jodu jest 7, ponieważ istnieje siedem elektronów w najbardziej zewnętrznej powłoki. Liczba atomów monowalentnych wynosi dwa, ponieważ dwa z trzech jodków są monowalentne. Teraz, gdy dochodzimy do ładunku jonu I3-, ma on ładunek ujemny, więc wartość tego ładunku ujemnego będzie wynosić 1.
Teraz umieść wszystkie wartości zgodnie ze wzorem,
7+1+2/2
=10/2
=5
Tak więc liczba hybrydyzacji wynosi 5, co oznacza, że hybrydyzacja jest sp3d.
Innym sposobem na znalezienie hybrydyzacji danej cząsteczki jest pomoc samotnych par i elektronów walencyjnych. Liczba par samotnych w tej cząsteczce wynosi 3, a liczba atomów dzielących elektrony walencyjne wynosi 2.
Stąd 3+2=5, co również określa hybrydyzację sp3d.
Kształt jonu I3-

Kształt cząsteczki I3- jest liniowy. Istnieją trzy atomy jodu, z których jeden ma dodatkowy ładunek ujemny. Ze względu na ten jeden dodatkowy elektron tam 3 samotne pary elektronów i 2 pary wiązań co to jest liczba steryczna 5. Ponieważ istnieją trzy samotne pary na centralnym atomie jodku, pary te starają się odpychać od siebie tak bardzo jak to tylko możliwe. Tak więc w celu oddalenia się na większą odległość, pary te przyjmują pozycje równikowe, a pozostałe dwa atomy jodu są oddalone od siebie o 180 stopni. Tak więc ogólny kształt jonu I3- jest linear.
Polarity
Więc tutaj jest trudna część o tym jonie, po pierwsze jak to jako ładunek na nim możemy nazwać go jako jon poliomerów zamiast nazywając go cząsteczka. Jony są ładunkami, które widzimy na molekułach. Ponieważ I3- ma jeden elektron, jon ten ma ogólnie ładunek ujemny. Molekuły mają biegunowość, ponieważ mają oba ładunki, które są częściowo dodatnio naładowane i częściowo ujemnie naładowane. Na cząsteczkach występuje moment dipolowy zależny od separacji ładunków na cząsteczce. Jeśli odległość między oboma ładunkami jest większa, moment dipolowy będzie również większy.
Ale kiedy mówimy o jonie I3-, jest to jon naładowany ujemnie. Nawet kiedy rysujemy jego strukturę Lewisa, nie widzimy w niej żadnego momentu dipolowego ani wiązań polarnych, ponieważ ogólny ładunek jonu jest ujemny. Tak więc nie jest on ani polarny ani niepolarny. Jednakże, jeśli masz do opisania jonu, można użyć wyrażenia ” jak cząsteczka polarna”, ponieważ I3- jest rozpuszczalny w wodzie.
W uwagach końcowych, aby podsumować, ten cały artykuł, I3- jest jon poliomerów, który ma 22 elektronów walencyjnych, 3 samotne pary, 2 pary wiązań, i hybrydyzacji sp3d. Jest to liniowy kształt i nie ma polarności.
.