- Introduction
- Materiały i metody
- Uczestnicy
- Obrazy rezonansu magnetycznego
- Akwizycja i przetwarzanie danych
- Atlas Extraction
- Analiza statystyczna
- Wyniki
- Patients With SCA3 Revealed Significant Lesions in Typical Infratentorial Lesions Regions
- Patients With SCA3 Revealed Cerebral Lateralized Supratentorial Lesions
- Dyskusja
- Wnioski
- Oświadczenie o dostępności danych
- Oświadczenie o etyce
- Author Contributions
- Funding
- Konflikt interesów
- Podziękowania
- Materiały uzupełniające
Introduction
Ataksja móżdżkowa typu 3 (SCA3) jest dziedzicznym zaburzeniem neurodegeneracyjnym spowodowanym ekspansją CAG w regionie kodującym chromosomu 14q32.1 (1, 2). Klinicznie pacjenci z SCA3 wykazują zespół móżdżkowy, parkinsonizm, chód ataktyczny, dyzartrię, dysmetrię, oczopląs, neuropatię obwodową, objawy piramidowe i pozapiramidowe (3-5). Pacjenci z SCA3 cierpieli również z powodu zaburzeń emocjonalnych, takich jak depresja i lęk (6, 7). Te dysfunkcje wyższego rzędu w SCA3 sugerują dalsze zaangażowanie struktur pozamóżdżkowych, a nie konwencjonalny „olivopontocerebellarny” wzorzec neurodegeneracji (8-12). Dodatkowo, zaburzenie SCA3 zostało opisane jako móżdżkowy zespół afektywny poznawczy (CCAS) (6, 8).
Badania wykorzystały pozytonową tomografię emisyjną (PET) i tomografię komputerową z emisją pojedynczego fotonu do identyfikacji subklinicznych nieprawidłowości w korze mózgowej (13, 14). Jednakże, badania te donoszą, że zaburzenie szlaku móżdżkowo-móżdżkowego nie może całkowicie wyjaśnić zaburzeń poznawczych i afektywnych u pacjentów z SCA3. Na przykład, deficyty wzrokowo-przestrzenne u pacjentów z SCA3 są wyraźnie związane z płatem ciemieniowym i są mniej powiązane z móżdżkiem. Niewiele badań koncentrowało się na roli regionów supratentorialnych w SCA3. Ilościowe określenie degeneracji w regionach nadnamiotowych może być kluczowe dla oceny dysfunkcji u pacjentów z SCA3. W badaniach neuroobrazowych pomiar regionalnej atrofii korowej jest kluczowy dla oceny jej związku z zaburzeniami poznawczymi i dysfunkcją emocjonalną.
Obrazowanie tensora dyfuzji (DTI) może ułatwić wizualizację i charakterystykę istoty białej (WM), a DTI jest również skuteczną metodą badania SCA3 (15). SCA3 został zweryfikowany jako choroba neurodegeneracyjna z dominującą atrofią WM (16). Poprzednie badania wykazały, że pacjenci z SCA3 wykazują spadek anizotropii frakcyjnej (FA) w obszarach móżdżku i pnia mózgu, ale wzrost dyfuzyjności radialnej (RD) w móżdżku, pniu mózgu, wzgórzu oraz płatach czołowych i skroniowych (17). W innym badaniu DTI zidentyfikowano rozległe obniżenie FA w obustronnych płatach czołowych, ciemieniowych, skroniowych i potylicznych WM, móżdżku WM, wzgórzu i pniu mózgu u pacjentów z SCA3 (16). Ponadto, średnia dyfuzyjność (MD) wzrosty były wykryte w podobnym, szeroko nakładającym się wzorze w dwustronnym mózgowo-czołowym, ciemieniowym, -temporalnym, i -occipital WM; móżdżkowy WM; wzgórze; i pnia mózgu (16).
W tym badaniu, oceniliśmy atrofię w stosunkowo ogniskowych regionach i wyjaśniliśmy supratentorial zaangażowanie w SCA3. W tym badaniu użyto metody wymiaru fraktalnego (FD), która ma tę zaletę, że daje wyniki o minimalnej zmienności (18), do ilościowej oceny korowych zmian morfologicznych i pomiaru regionalnego zaniku korowego w regionach nadnamiotowych. W obecnym badaniu, zmierzyliśmy wartości 3D-FD 97 segmentów istoty szarej z całego mózgu dla każdego uczestnika. Dalej porównaliśmy te wyniki zmian w istocie szarej z analizą DTI zmian w istocie białej w SCA3 z naszego ostatniego badania. Przewidywaliśmy, że oceniane regiony zmian GM w tym badaniu są związane z regionami zmian WM z badania DTI, a wynik może zweryfikować związek między upośledzeniem związanym z motoryką a atrofią regionów supratentorialnych u pacjentów z SCA3.
Materiały i metody
Uczestnicy
W badaniu wzięło udział łącznie 48 pacjentów z SCA3 i 50 zdrowych osób dobranych pod względem płci i wieku, jako grupa kontrolna. Badanie zostało przeprowadzone zgodnie z Deklaracją Helsińską i zostało zatwierdzone przez Institutional Review Board of Taipei Veterans General Hospital. Wszyscy uczestnicy wyrazili pisemną świadomą zgodę na udział w tym badaniu. Wszyscy uczestnicy zostali zrekrutowani z Department of Radiology, Taipei Veterans General Hospital. Skala SARA (scale for the assessment and rating of ataxia) została zastosowana do klinicznej oceny ataksji u pacjentów z SCA3 (19). Objawy postępu choroby Parkinsona w SCA3 mierzono za pomocą zmodyfikowanej skali Hoehn i Yahr (20). Punktacja SARA, która była oceną nasilenia objawów ataksji w zakresie od 0 do 40, została użyta jako punkt odniesienia do wskazania progresji nasilenia klinicznego w porównaniu z degeneracją móżdżku. Od każdego pacjenta uzyskano informację o wieku początku choroby, czyli wieku, w którym u pacjentów wystąpił pierwszy objaw ataksji (21). Długość powtórzenia CAG u każdego pacjenta SCA3 została określona za pomocą łańcuchowej reakcji polimerazy, jak opisano wcześniej (22). Tabela 1 przedstawia dane demograficzne, kliniczne i obrazowe MR obu grup. Pacjenci z SCA3 spełniali kryteria włączenia, jeśli mieli postępującą i w inny sposób niewyjaśnioną ataksję i testowali dodatni dla genotypu SCA3. Czas trwania choroby u pacjentów z SCA3 wynosił 8,89 ± 6,432 roku. Osoby z grupy kontrolnej nie chorowały na ośrodkowy układ nerwowy i nie wykazywały żadnych zaburzeń neurologicznych w okresie badania. Doświadczony neuroradiolog zbadał obrazy T1- i T2-zależne grupy kontrolnej, aby upewnić się, że nie ma niepokrytych objawów innej choroby neurologicznej lub nieoczekiwanych nieprawidłowości.
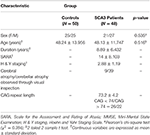
Tabela 1. Dane demograficzne, kliniczne i obrazy MR grupy kontrolnej i grupy pacjentów.
Obrazy rezonansu magnetycznego
Akwizycja i przetwarzanie danych
Ośmiokątne obrazy MR ludzkiego mózgu obejmujące cały móżdżek i móżdżek uzyskano przy użyciu skanera 1,5-T Vision Siemens (Erlangen, Niemcy). Uczestnicy byli skanowani za pomocą kołowo spolaryzowanej cewki głowicy w celu uzyskania obrazów T1-ważonych (TR = 14,4 ms; TE = 5,5 ms; rozmiar matrycy: 256 × 256; 1,5 mm osiowe plasterki; FOV = 256 × 256 mm2; rozmiar voxel, 1,0 × 1,0 × 1,5 mm3, liczba plasterków = 128). Uzyskane obrazy T1-ważone każdego uczestnika zostały przekształcone w obraz osiowy i przekonwertowane do formatu analizy za pomocą oprogramowania MRIcro (Chris Rorden, University of Nottingham, Wielka Brytania; www.sph.sc.edu/comd/rorden/mricro.html). Rysunek 1 ilustruje schemat blokowy przetwarzania danych i analizy statystycznej. Aby poprawić dokładność ekstrakcji tkanki mózgowej, za pomocą narzędzia do ekstrakcji mózgu w oprogramowaniu MRIcro zastosowano zautomatyzowaną funkcję skull-stripping do objętości obrazu (Figura 1B). Kolejne procesy przeprowadzono przy użyciu DiffeoMap (Li, X.; Jiang, H.; i Mori, S.; Johns Hopkins University, www.MriStudio.org). W tej procedurze do normalizacji każdego obrazu T1-ważonego w kierunku wzorca JHU_MNI_SS_T_ss T1 użyto 12-parametrowej transformacji afinicznej (23).
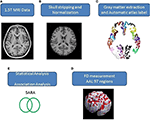
Rysunek 1. (A-E) Procedura procesu obrazowania i analizy statystycznej.
Atlas Extraction
Przetwarzanie danych obrazowych zostało wykonane przy użyciu zestawu narzędzi SPM8 (Wellcome Department of Cognitive Neurology, Institute of Neurology, University College London, London, UK, http://www.fil.ion.ucl.ac.uk/spm/) oraz zestawu narzędzi IBASPM (Individual Brain Atlases using Statistical Parametric Mapping, http://www.thomaskoenig.ch/Lester/ibaspm.htm), oba uruchomione przy użyciu oprogramowania MATLAB 2010 (Mathworks, Natick, MA, USA).
Procedura obejmuje trzy kroki po normalizacji: (1) segmentację znormalizowanego obrazu na istotę szarą, istotę białą i płyn mózgowo-rdzeniowy w przestrzeni natywnej, (2) parcelację istoty szarej na 116 regionów na podstawie etykiet anatomicznych atlasu anatomicznego Montreal Neurological Institute (MNI) (24), oraz (3) transformację obrazów istoty szarej do przestrzeni MNI i wyrównanie anatomiczne każdego woksela istoty szarej do 116 struktur automatycznych etykiet anatomicznych przy użyciu IBASPM (24), lewy móżdżek: 45 regionów, prawy móżdżek: 45 regionów, móżdżek: 26 regionów; (Figura 1C). 26 regionów móżdżku zostało połączonych w siedem regionów zgodnie z ich strukturami anatomicznymi, a objętości 97 oznakowanych (45 dla każdej półkuli mózgowej i siedem dla móżdżku, Tabela uzupełniająca 1) struktur mózgu zostały wyodrębnione dla każdej osoby (Rysunek 1C).
Metoda FD została pierwotnie zaproponowana przez Mandelbrota do kwantyfikacji złożoności obiektów związanych z kształtem w pojedynczą wartość liczbową (25). Metoda FD jest używana do topologicznego pomiaru złożoności; wyższa wartość FD reprezentuje większą topologiczną złożoność badanej tkanki (18, 26). Wielu neurologów wykazało, że wartość FD może służyć jako miara ilościowa do dokładnego opisania morfologicznej złożoności fałdów mózgowych (18, 26, 27). Ponieważ analiza FD oparta jest na skali logarytmicznej, nawet niewielki wzrost wartości FD może odpowiadać znacznemu wzrostowi złożoności (18). W tym badaniu przyjęto metodę liczenia pudełek 3D w celu zmierzenia wartości 3D-FD 97 segmentów istoty szarej z całego mózgu dla każdego uczestnika (rysunek 1D). W powiązanym badaniu szczegółowo opisano algorytm metody liczenia pudełkowego (18).
Analiza statystyczna
Różnice między grupami związane z płcią i wiekiem zmierzono za pomocą testu chi kwadrat Pearsona (χ2 = 0,384, p = 0,535) i 2-ogonowego testu t (p = 0,516), oddzielnie. Regresję liniową zastosowano w celu usunięcia wpływu wieku i płci. W celu określenia, czy istnieje istotna różnica między grupą kontrolną a grupą pacjentów w zakresie wartości 3D-FD każdego regionu korowego, zastosowano 2-spadkowy test t-t. Istotność wyników była oparta na współczynniku fałszywego odkrycia (FDR-corrected p = 0,05) (28). Wielkość związku między wartością 3D-FD poszczególnych regionów mózgu a cechami klinicznymi, takimi jak czas trwania choroby i SARA, określono za pomocą pomiaru r Pearsona (Rycina 1E). Analizy te przeprowadzono przy użyciu Statistics Toolbox w MATLAB 2010.
Wyniki
Patients With SCA3 Revealed Significant Lesions in Typical Infratentorial Lesions Regions
Doświadczeni neuroradiolodzy przedstawili wyniki badania MRI pacjentów z SCA3 (Tabela 1). Rycina 2 ilustruje porównanie wartości 3D-FD w każdym płacie między grupą zdrową a grupą z SCA3. Ogólnie rzecz biorąc, pacjenci z SCA3 wykazywali znacznie zmniejszone wartości 3D-FD w każdym płacie, a móżdżek był związany z najbardziej znaczącym zmniejszeniem wartości 3D-FD (Figura 2). Wartości 3D-FD kory móżdżku pacjentów z SCA3 wykazywały istotną korelację z ich punktacją w skali SARA (r = -0,3346; p = 0,023). Następnie dokonaliśmy parcelacji kory mózgowej i móżdżkowej na 97 regionów i oceniliśmy ilościowo zanik w każdym z nich. Pacjenci z SCA3 mieli typowe obszary zmian infratentorialnych, w tym jądra ponadzwojowe, korę móżdżku i oliwki dolne. Szczegóły znacząco zmniejszonych wartości 3D-FD regionów zanikowych pomiędzy grupą zdrową a grupą SCA3 podsumowano w Tabeli 2.
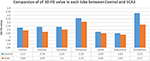
Rysunek 2. Porównanie wartości 3D-FD w każdym płacie między grupą zdrową a grupą SCA3. Wartość 3D-FD w każdym płacie SCA3 wykazała istotnie niższe wartości w stosunku do grupy kontrolnej. P-value of significant difference of cerebellum, frontal lobe, parietal lobe, and occipital lobe are smaller than 0.01, and for other lobes are smaller than 0.05.
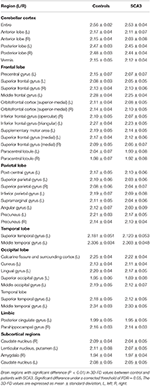
Table 2. Significant atrophied regions in patients with SCA3 (p < 0.05).
Patients With SCA3 Revealed Cerebral Lateralized Supratentorial Lesions
Beside the infratentorial lesions, lesions in supratentorial regions were also observed in all patients with SCA3. Wykazały one rozległe zmiany w 39 mózgowych regionach parcelowanych (p < 0,05), w tym płacie czołowym, ciemieniowym, potylicznym i skroniowym. Wykazały one atrofię lateralizowaną i dominującą w lewej półkuli (prawa/lewa: 12/27). Szczególnie w płatach potylicznym i skroniowym pacjenci z SCA3 wykazywali istotnie obniżone wartości 3D-FD tylko w lewej półkuli. Istotnie zanikłymi regionami w obszarach czołowych były: kora przedruchowa (lewa kora przedśrodkowa, obustronna górna kora czołowa i lewa środkowa kora czołowa), dodatkowa kora ruchowa (lewy dodatkowy obszar ruchowy) i podstawowa kora ruchowa (lewa kora przedśrodkowa) (Rycina 3).
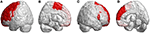
Rysunek 3. Regiony w obrębie płata czołowego wskazujące niższe wartości 3D-FD u pacjentów z SCA3 w porównaniu z kontrolami. (A) Widok z lewej strony na zewnątrz, (B) widok z lewej strony do wewnątrz, (C) widok z prawej strony na zewnątrz i (D) widok z prawej strony do wewnątrz. Pacjenci z SCA3 mieli znacząco zmniejszone wartości 3D-FD w regionach czołowych, w tym w korze przedruchowej (lewa kora przedśrodkowa, obustronna górna kora czołowa i lewa środkowa kora czołowa), dodatkowej korze ruchowej (lewy dodatkowy obszar ruchowy) i pierwotnej korze ruchowej (lewa kora przedśrodkowa). Inne zanikłe obszary zaobserwowano w lewym dolnym zakręcie czołowym (opercular), lewym dolnym zakręcie czołowym (triangular), obustronnej korze oczodołowo-czołowej (superior-1 medial), obustronnym górnym zakręcie czołowym (medial) i obustronnym płacie przyśrodkowym u pacjentów z SCA3. Wszystkie znacząco zmniejszone regiony wartości 3D-FD są zilustrowane na czerwono.
Inne zanikłe regiony były w lewym dolnym zakręcie czołowym (opercular), lewym dolnym zakręcie czołowym (triangular), dwustronnej korze oczodołowo-czołowej (superior-medial), dwustronnym górnym zakręcie czołowym (medial) i dwustronnym płacie przyśrodkowym. W płacie ciemieniowym obniżone wartości FD wykryto w lewym zakręcie postcentralnym, lewym zakręcie nadskroniowym, lewym zakręcie kątowym, obustronnym górnym zakręcie ciemieniowym i obustronnym płacie przedczołowym u pacjentów z SCA3 (rysunek 4).
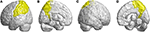
Rysunek 4. Regiony w obrębie płata ciemieniowego wskazujące na zmniejszenie wartości 3D-FD u pacjentów z SCA3 w porównaniu z kontrolą. (A) Widok z lewej strony na zewnątrz, (B) widok z lewej strony do wewnątrz, (C) widok z prawej strony na zewnątrz i (D) widok z prawej strony do wewnątrz. W porównaniu z grupą kontrolną, pacjenci z SCA3 mieli znacząco niższe wartości 3D-FD w lewej bruździe postcentralnej, lewej bruździe nadskroniowej, lewej bruździe kątowej, obustronnej górnej bruździe ciemieniowej i obustronnej bruździe przedczołowej płata ciemieniowego. Wszystkie regiony o znacznie obniżonych wartościach 3D-FD są zilustrowane kolorem żółtym.
W płacie potylicznym pacjenci z SCA3 ujawnili znacznie niższe wartości FD w szczelinie ciemieniowej i otaczającej ją korze mózgowej, zakręcie obręczy, zakręcie językowym oraz górnym i środkowym zakręcie potylicznym w lewej półkuli (rysunek 5A, kolor niebieski). W płacie skroniowym regiony z obniżonymi wartościami FD znajdowały się w lewym-górnym skroniowym i lewym-środkowym skroniowym gyrze u pacjentów z SCA3 (Rysunek 5A, kolor fioletowy). Wartości 3D-FD w lewym-przednim zakręcie obręczy w obszarze limbicznym były również znacząco zmniejszone u pacjentów z SCA3 (Ryc. 5B,D, kolor zielony). U pacjentów z SCA3 zaobserwowano obszary znacznego zaniku w zwojach podstawy, w tym w obustronnym jądrze ogoniastym i lewym putamenie (ryc. 5B,D, kolor niebieski). W prawym zewnętrznym płacie potylicznym nie zaobserwowano znaczących zanikowych regionów u pacjentów z SCA3 (Figura 5C).
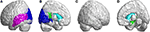
Figure 5. Regiony w obrębie płata potylicznego, płata skroniowego i podkorowego wskazujące na istotnie niższe wartości 3D-FD u pacjentów z SCA3 w porównaniu z kontrolami. (A) Widok z lewej strony na zewnątrz, (B) widok z lewej strony do wewnątrz, (C) widok z prawej strony na zewnątrz i (D) widok z prawej strony do wewnątrz. Niebieskie regiony pokazują znacząco niższe wartości 3D-FD w płacie potylicznym, włączając szczelinę ciemieniową i otaczającą ją korę, cuneus i lingual gyrus oraz superior i middle occipital gyrus w lewej półkuli. Fioletowe regiony oznaczają niższe wartości 3D-FD w lewym górnym zakręcie skroniowym i lewym środkowym zakręcie skroniowym. Aqua-niebieskie regiony reprezentują niższe wartości 3D-FD w regionach podkorowych, włączając w to obustronny ogoniasty i lewy putamen. Zielone regiony reprezentują znacząco niższe wartości 3D-FD w lewym-przednim zakręcie obręczy i zakręcie przyhipokampowym układu limbicznego.
W Figurze 6, znaleźliśmy wiele mózgowych atrofii regionów włączonych móżdżek, móżdżek-podwzgórze-korowe i zwoje podstawy-korowe obwody łączące, które implikowały pacjentów z SCA3 ujawniły móżdżek-podwzgórze-korowe i zwoje podstawy-korowe uszkodzone w tych ścieżkach.

Rysunek 6. SCA3 jest zaangażowany zarówno w szlaki móżdżkowo-wzgórzowo-korowe, jak i zwoje podstawy-wzgórzowo-korowe. (A) widok z lewej strony na zewnątrz, (B) widok z lewej strony do wewnątrz, (C) widok z prawej strony na zewnątrz i (D) widok z prawej strony do wewnątrz. W pętli móżdżkowo-wzgórzowo-korowej, pacjenci z SCA3 wykazują znacząco niższe wartości 3D-FD w korze móżdżku, korze przedruchowej i dodatkowej korze ruchowej. Obniżone wartości 3D-FD w korze móżdżku i innych obszarach mózgu związanych z motoryką u pacjentów z SCA3 tłumaczą występowanie objawów klinicznych. W pętli zwojów podstawnych-wzgórzowo-korowych pacjenci z SCA3 wykazują istotnie niższe wartości 3D-FD w korze czołowej, pierwotnej korze ruchowej, putamenach i ogoniastych. Wyniki te ujawniają morfologiczne zmiany w pętli zwojów podstawy-kora wzgórza u pacjentów z SCA3.
Dyskusja
Klinicznie, pacjenci z SCA3 wykazują zespół móżdżkowy i parkinsonizm (3-5). Zanikłe regiony infratentorialnej i supratentorialnej kory wymienione w Tabeli 2, wykazały szeroki zakres nakładających się obszarów, jak w dwóch funkcjonalnych regionach, mianowicie kora związana z móżdżkiem (CB-related) (29) i kora związana ze zwojami podstawnymi (BG-related) (30). Kora związana z CB obejmuje móżdżek, korę przedczołową, kory sensomotoryczne, korę przedczołową i płat skroniowy, a kora związana z BG obejmuje pierwotną korę ruchową, dodatkowy obszar ruchowy, korę przedruchową i zwoje podstawy. Nasze wyniki wykazały zgodność z wcześniejszymi konwencjonalnymi badaniami neuroobrazowymi, że móżdżek jest najbardziej dotkniętym i zanikłym regionem u pacjentów z SCA3 (4, 31, 32). Dodatkowo, wartość 3D-FD w korze móżdżku pacjentów z SCA3 miała istotnie ujemną korelację z punktacją SARA (r = -0,3346; p = 0,023), jak Rezende i wsp. wcześniej donosili (33).
W regionach infratentorialnych, pacjenci z SCA3 mieli istotnie zmniejszone wartości 3D-FD w putamen i caudate. Badania neuropatologiczne wykazały utratę neuronów w putamen i caudate, co może prowadzić do atrofii zwojów podstawy w powiązaniu z parkinsonizmem (34). Cechy parkinsonizmu są dominującym fenotypem mutacji SCA3 i zwykle towarzyszą im objawy ze zwojów podstawy (35-37). W badaniach nekropsyjnych u pacjentów z SCA3 często stwierdza się zajęcie zwojów podstawnych. Obrazowanie czynnościowe z wykorzystaniem badań PET wykazało również wczesny ubytek czynnościowy koguta i putamenu u pacjentów z SCA3. Dodatkowo, pacjenci z SCA3 mieli znacząco mniejszą objętość zwojów podstawy (35). Jednak powiązane badania koncentrowały się tylko na zwojach podstawy i regionach infratentorialnych. Na rycinie 6 sprawdziliśmy, że SCA3 może mieć nie tylko uszkodzenia zwojów podstawy, ale także uszkodzenia dróg móżdżkowo-podwzgórzowo-korowych i zwojów podstawy-podwzgórzowo-korowych.
Pacjenci z SCA3 wykazują znacznie zmniejszone wartości 3D-FD kory przedruchowej i dodatkowej kory ruchowej w ich pętli móżdżkowo-podwzgórzowo-korowej. Kora przedruchowa i uzupełniający obszar ruchowy są związane z kontrolą ruchu, taką jak siła mięśni i kierunek ruchu. Uszkodzenia w tych regionach mogą wywoływać ataksję chodu, postawy i kończyny, a także dekompozycję ruchu (38, 39). Obniżone wartości 3D-FD kory móżdżku i innych obszarów mózgu związanych z motoryką u pacjentów z SCA3 mogą tłumaczyć występowanie objawów klinicznych. Dodatkowo, w pętli zwojów podstawy-wzgórzowo-korowej, pacjenci z SCA3 wykazują istotnie zmniejszone wartości 3D-FD w korze czołowej i pierwotnej korze ruchowej. Pierwotna kora ruchowa jest również głównym miejscem docelowym dla wyjścia zwojów podstawnych (40). Zaburzenia pętli zwojów podstawnych-wzgórzowo-korowych mogą również przyczyniać się do parkinsonowskiej dysfunkcji motorycznej (41). Wyniki tego badania podkreślają morfologiczne zmiany w zwoju podstawnym-pętli wzgórzowo-korowej u pacjentów z SCA3, które poprzednie neuroobrazowanie studia nie zaadresowały.
Później, użyliśmy obrazowania tensora dyfuzji (DTI) by zmierzyć molekularną dyfuzję wody istoty białej (WM) alteracji w SCA3 (15). Znaleźliśmy SCA3 ujawnił rozległe zmiany istoty białej w dwustronnym mózgowo-czołowym, ciemieniowym, skroniowym i potylicznym WM; móżdżku WM; wzgórzu i pniu mózgu. Identycznie, w tym badaniu zaobserwowaliśmy SCA3 pokazał prawie w tych samych parcelowanych regionach tych WM zmian , które ujawniły GM zmiany. Te aktualne ustalenia potwierdzają zaangażowanie supratentorial regionów u pacjentów z SCA3. Braga i wsp. przedstawili podobne wyniki, wykazując, że SCA3 powoduje CCAS poprzez upośledzenie funkcji wykonawczych, płynności słownej, abstrakcyjnego rozumowania i pamięci operacyjnej (8). W badaniach neuropatologicznych wykazano, że CCAS wynika z zaburzeń obwodu móżdżkowego, który jest związany z korą przedczołową, ciemieniową górną, skroniową górną i limbiczną (42, 43). Badania potwierdziły rolę móżdżku w funkcjach poznawczych, jednak funkcje poznawcze, afektywne i wzrokowo-przestrzenne są bezpośrednio związane ze zwyrodnieniem kory mózgowej. Istotnie zanikłe obszary regionów nadnamiotowych u pacjentów z SCA3 były bardziej rozległe niż obszary związane z CCAS. Zanik kory nadtwardówkowej może być głównym czynnikiem związanym z dysfunkcją obszarów związanych z ataksją i parkinsonizmem. Te ustalenia sugerują, że SCA3 nie powinien być już uważany za chorobę ograniczoną do móżdżku i jego połączeń; raczej powinien być uważany za patologię wpływającą na cały mózg.
Jednakże to badanie nadal miało pewne ograniczenia. Główne ograniczenia w tym badaniu to brak specyficznych ocen poznawczych i parametrów klinicznych do oceny CCAS w NZK. Uzasadnione są dalsze badania dotyczące korelacji pomiędzy obecnymi wynikami a danymi klinicznymi, takimi jak dane funkcjonalnego MRI. To może pomóc dostarczyć bardziej precyzyjną metodę dla oceny związku między poznawczym z motorycznym związanym zaangażowaniem i regionalnym zanikiem u pacjentów z SCA3.
Wnioski
W tym badaniu, użyliśmy metody 3D-FD do ilościowego określenia regionalnych morfologicznych zmian u pacjentów z SCA3 i oceny związku między nadtwardówkowym zanikiem i motorycznym związanym zaangażowaniem u pacjentów z SCA3. Nasze wyniki wykazały znaczącą degenerację kory mózgowej w określonych regionach, które mogą być związane z móżdżkiem lub zwojami podstawnymi. Nasze odkrycia mogą korelować z powszechnymi objawami SCA3, takimi jak ataksja, parkinsonizm, dyzartria i dysmetria. SCA3 nie powinien już być uważany za chorobę ograniczoną do móżdżku i jego połączeń; raczej powinien być uważany za patologię wpływającą na cały mózg.
Oświadczenie o dostępności danych
Wszystkie zestawy danych wygenerowane dla tego badania są zawarte w artykule/Materiale uzupełniające.
Oświadczenie o etyce
Badania z udziałem ludzi zostały przejrzane i zatwierdzone przez Institutional Review Board of Taipei Veterans General Hospital. The patients/participants provided their written informed consent to participate in this study.
Author Contributions
P-SW and Y-TW organized the research project, reviewed and critiqued the manuscript. T-YW napisał manuskrypt. H-MW uzyskał dostęp do danych badawczych. B-WS zorganizował badania i przeprowadził zbieranie danych. C-WJ wykonał analizę statystyczną, napisał i poprawił manuskrypt.
Funding
To badanie zostało sfinansowane przez Ministerstwo Nauki i Technologii, Tajwan (MOST108-2634-F-010-002); National Health Research Institutes, Tajwan (NHRI-EX106-10526EI); National Yang-Ming University i Shin-Kong Wu-Ho Su Memorial Hospital Research Program (107GB006).
Konflikt interesów
Autorzy deklarują, że badania były prowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowania
Autorzy pragną podziękować wszystkim osobom, które uczestniczyły w tym badaniu oraz dziękują Wallace Academic Editing za edycję tego manuskryptu.
Materiały uzupełniające
Materiały uzupełniające do tego artykułu można znaleźć online pod adresem: https://www.frontiersin.org/articles/10.3389/fneur.2020.00124/full#supplementary-material
1. Kawaguchi Y, Okamoto T, Taniwaki M, Aizawa M, Inoue M, Katayama S, et al. CAG expansions in a novel gene for Machado-Joseph disease at chromosome 14q32.1. Nat Genet. (1994) 8:221-8. doi: 10.1038/ng1194-221
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Riess O, Rub U, Pastore A, Bauer P, Schols L. SCA3: cechy neurologiczne, patogeneza i modele zwierzęce. Cerebellum. (2008) 7:125-37. doi: 10.1007/s12311-008-0013-4
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Stevanin G, Durr A, Brice A. Clinical and molecular advances in autosomal dominant cerebellar ataxias: from genotype to phenotype and physiopathology. Eur J Hum Genet. (2000) 8:4-18. doi: 10.1038/sj.ejhg.5200403
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Schols L, Bauer P, Schmidt T, Schulte T, Riess O. Autosomal dominant cerebellar ataxias: clinical features, genetics, and pathogenesis. Lancet Neurol. (2004) 3:291-304. doi: 10.1016/S1474-4422(04)00737-9
PubMed Abstract | CrossRef Full Text
5. Roeske S, Filla I, Heim S, Amunts K, Helmstaedter C, Wüllner U, et al. Progressive cognitive dysfunction in spinocerebellar ataxia type 3. Movement Disord. (2013) 28:1435-8. doi: 10.1002/mds.25512
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Braga-Neto P, Pedroso JL, Alessi H, Dutra LA, Felicio AC, Minett T, et al. Móżdżkowy poznawczy zespół afektywny w chorobie machado joseph: podstawowe cechy kliniczne. Cerebellum. (2012) 11:549-56. doi: 10.1007/s12311-011-0318-6
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Zawacki TM, Grace J, Friedman JH, Sudarsky L. Executive and emotional dysfunction in Machado-Joseph disease. Movement Disord. (2002) 17:1004-10. doi: 10.1002/mds.10033
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Braga-Neto P, Dutra LA, Pedroso JL, Barsottini OGP. Cognitive dysfunction in spinocerebellar ataxia type 3: variable topographies and patterns. Movement Disord. (2014) 29:156-7. doi: 10.1002/mds.25756
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Lopes TM, D′Abreu A, Junior MCF, Yasuda CL, Betting LE, Samara AB, et al. Widespread neuronal damage and cognitive dysfunction in spinocerebellar ataxia type 3. J Neurol. (2013) 260:2370-9. doi: 10.1007/s00415-013-6998-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Roeske S, Filla I, Heim S, Amunts K, Helmstaedter C, Wüllner C, et al. Reply to: cognitive dysfunction in spinocerebellar ataxia type 3: variable topographies and patterns. Movement Disord. (2014) 29:157-8. doi: 10.1002/mds.25755
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Barbas H. Anatomiczne podstawy interakcji poznawczo-emocjonalnych w korze przedczołowej naczelnych. Neurosci Biobehav R. (1995) 19:499-510. doi: 10.1016/0149-7634(94)00053-4
PubMed Abstract | CrossRef Full Text | Google Scholar
12. D’Abreu A, Franca MC Jr, Yasuda CL, Campos BA, Lopes-Cendes I, Cendes F, et al. Neocortical atrophy in machado-joseph disease: a longitudinal neuroimaging study. J Neuroimaging. (2012) 22:285-91. doi: 10.1111/j.1552-6569.2011.00614.x
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Soong BW, Liu RS. Pozytonowa tomografia emisyjna u bezobjawowych nosicieli genu choroby Machado-Joseph. J Neurol Neurosur PS. (1998) 64:499-504. doi: 10.1136/jnnp.64.4.499
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Wullner U, Reimold M, Abele M, Burk K, Minnerop M, Dohmen BM, et al. Dopamine transporter positron emission tomography in spinocerebellar ataxias type 1, 2, 3, and 6. Arc Neurol. (2005) 62:1280-5. doi: 10.1001/archneur.62.8.1280
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Jao CW, Soong BW, Huang CW, Duan CA, Wu CC, Wu YT, et al. Rezonans magnetyczny z tensorem dyfuzji do różnicowania atrofii wieloukładowej typu móżdżkowego i ataksji spinocerebellarnej typu 3. Brain Sci. (2019) 9:354. doi: 10.3390/brainsci9120354
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Kang JS, Klein JC, Baudrexel S, Deichmann R, Nolte D, Hilker R. White matter damage is related to ataxia severity in SCA3. J Neurol. (2014) 261:291-9. doi: 10.1007/s00415-013-7186-6
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Guimarães RP, D’Abreu A, Yasuda CL, Franca MC Jr, Silva BH, Cappabianco FA, et al. A multimodal evaluation of microstructural white matter damage in spinocerebellar ataxia type 3. Mov Disord. (2013) 28:1125-32. doi: 10.1002/mds.25451
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Wu YT, Shyu KK, Jao CW, Wang ZY, Soong BW, Wu HM, et al. Fractal dimension analysis for quantifying cerebellar morphological change of multiple system atrophy of the cerebellar type (MSA-C). NeuroImage. (2010) 49:539-51. doi: 10.1016/j.neuroimage.2009.07.042
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Schmitz-Hübsch T, du Montcel ST, Baliko L, Berciano J, Boesch S, Depondt C, et al. Scale for the assessment and rating of ataxia. Development of a new clinical scale. Neurology. (2006) 66:1717-20. doi: 10.1212/01.wnl.0000219042.60538.92
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Hoehn MM, Yahr MD. Parkinsonizm: początek, progresja i śmiertelność. Neurology. (1998) 50:318. doi: 10.1212/WNL.50.2.318
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Jardim LB, Pereira ML, Silveira I, Ferro A, Sequeiros J, Giugliani R. Neurologic findings in Machado-Joseph disease: relation with disease duration, subtypes, and (CAG)n. Arch Neurol. (2001) 58:899-904. doi: 10.1001/archneur.58.6.899
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Soong B-W, Lu Y-C, Choo K-B, Lee H-Y. Analiza częstości występowania autosomalnych dominujących ataksji móżdżkowych u tajwańskich pacjentów oraz kliniczna i molekularna charakterystyka ataksji spinocerebellarnej typu 6. Arch Neurol. (2001) 58:1105-9. doi: 10.1001/archneur.58.7.1105
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Woods RP, Grafton ST, Holmes CJ, Cherry SR, Mazziotta JC. Automated image registration: I. General methods and intrasubject, intramodalitym validation. J Comput Assist Tomo. (1998) 22:139-52. doi: 10.1097/00004728-199801000-00027
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Tzourio-Mazoyer N, Landeau B, Papathanassiou D, Crivello F, Etard O, Delcroix N, et al. Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain. NeuroImage. (2002) 15:273-89. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Mandelbrot BB. Fractals: Form, Chance and Dimension. San Francisco, CA: Freeman (1977). s. 365.
Google Scholar
26. Esteban FJ, Sepulcre J, de Mendizabal NV, Goni J, Navas J, de Miras JR, et al. Wymiar fraktalny i zmiany istoty białej w stwardnieniu rozsianym. NeuroImage. (2007) 36:543-9. doi: 10.1016/j.neuroimage.2007.03.057
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Ha TH, Yoon U, Lee KJ, Shin YW, Lee JM, Kim IY, et al. Fractal dimension of cerebral cortical surface in schizophrenia and obsessive-compulsive disorder. Neurosci Lett. (2005) 384:172-6. doi: 10.1016/j.neulet.2005.04.078
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Benjamini Y, Hochberg Y. Kontrolowanie współczynnika fałszywego odkrycia: praktyczne i potężne podejście do testowania wielokrotnego. J R Stat Soc B. (1995) 57:289-300. doi: 10.1111/j.2517-6161.1995.tb02031.x
CrossRef Full Text | Google Scholar
29. Schmahmann JD, Pandya DN. Anatomical investigation of projections to the basis pontis from posterior parietal association cortices in rhesus monkey. J Comp Neurol. (1989) 289:53-73. doi: 10.1002/cne.902890105
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Girard B, Tabareau N, Berthoz A, Slotine JJ. Selektywna amplifikacja przy użyciu kurczącego się modelu zwojów podstawy. Pont A Mousson: NeuroComp (2006). s. 30-3.
Google Scholar
31. Burk K, Abele M, Fetter M, Dichgans J, Skalej M, Laccone F, et al. Autosomal dominant cerebellar ataxia type I clinical features and MRI in families with SCA1, SCA2 and SCA3. Brain. (1996) 119:1497-505. doi: 10.1093/brain/119.5.1497
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Dohlinger S, Hauser TK, Borkert J, Luft AR, Schulz JB. Magnetic resonance imaging in spinocerebellar ataxias. Cerebellum. (2008) 7:204-14. doi: 10.1007/s12311-008-0025-0
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Rezende TJ, D’Abreu A, Guimaraes RP, Lopes TM, Lopes-Cendesc I, Cendes F, et al. Cerebral cortex involvement in Machado-Joseph disease. Eur J Neurol. (2015) 22:277-83, e23-4. doi: 10.1111/ene.12559
CrossRef Full Text | Google Scholar
34. Lu CS, Chang HC, Kuo PC, Liu YL, Wu WS, Weng YH, et al. The parkinsonian phenotype of spinocerebellar ataxia type 3 in a Taiwanese family. Parkinsonism Relat D. (2004) 10:369-73. doi: 10.1016/j.parkreldis.2004.03.009
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Klockgether T, Skalej M, Wedekind D, Luft AR, Welte D, Schulz JB, et al. Autosomal dominant cerebellar ataxia type I. MRI-based volumetry of posterior fossa structures and basal ganglia in spinocerebellar ataxia types 1, 2 and 3. Brain. (1998) 121:1687-93. doi: 10.1093/brain/121.9.1687
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Socal MP, Emmel VE, Rieder CRM, Hilbig A, Saraiva-Pereira ML, Jardim LB. Intrafamilial zmienność Parkinson fenotypu w SCAs: nowe przypadki z powodu SCA2 i SCA3 ekspansji. Parkinsonism Relat D. (2009) 15:374-8. doi: 10.1016/j.parkreldis.2008.09.005
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Bettencourt C, Santos C, Coutinho P, Rizzu P, Vasconcelos J, Kay T, et al. Parkinsonian phenotype in Machado-Joseph disease (MJD/SCA3): a two-case report. BMC Neurol. (2011) 11:131. doi: 10.1186/1471-2377-11-131
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Kandel ER, Schwartz JH, Jessell TM. Zasady nauki o neuronach. New York, NY: McGraw-Hill (1991). s. 626-46.
Google Scholar
39. Asbury AK, McKhann GM. Diseases of the Nervous System: Clinical Neurobiology. Philadelphia, PA: W.B. Saunders (1992). s. 319-341.
40. Hoover JE, Strick PL. Multiple output channels in the basal ganglia. Science. (1993) 5:819-21. doi: 10.1126/science.7679223
CrossRef Full Text | Google Scholar
41. Jan C, Pessiglione M, Tremblay L, Tandé D, Hirsch EC, François C, et al. Quantitative analysis of dopaminergic loss in relation to functional territories in MPTP-treated monkeys. Eur J Neurosci. (2003) 18:2082-6. doi: 10.1046/j.1460-9568.2003.02946.x
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Rub U, de Vos RA, Brunt ER, Sebesteny T, Schols L, Auburger G, et al. Spinocerebellar ataxia type 3 (SCA3): thalamic neurodegeneration occurs independently from thalamic ataxin-3 immunopositive neuronal intranuclear inclusions. Brain Pathol. (2006) 16:218-27. doi: 10.1111/j.1750-3639.2006.00022.x
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Rub U, Seidel K, Ozerden I, Gierga K, Brunt ER, Schöls L, et al. Consistent affection of the central somatosensory system in spinocerebellar ataxia type 2 and type 3 and its significance for clinical symptoms and rehabilitative therapy. Brain Res Rev. (2007) 53:235-49. doi: 10.1016/j.brainresrev.2006.08.003
PubMed Abstract | CrossRef Full Text | Google Scholar
.