- Introduction
- Materiały i metody
- Indukcja ICH
- Western Blotting
- Immunohistochemia
- Enzyme Linked Immunosorbent Assay
- Genetyczne wyłączenie galektyny-3
- Analiza statystyczna
- Wyniki
- Temporal Expression Pattern of Galectin-1 and Galectin-3 After ICH
- Cellular Localization of Galectin-1 and Galectin-3 After ICH
- Galectin-1 and Galectin-3 Mediated Regulation of Inflammatory Response
- Dyskusja
- Wnioski
- Oświadczenie etyczne
- Wkład autorów
- Funding
- Oświadczenie o konflikcie interesów
- Materiały uzupełniające
- Skróty
Introduction
Krwotok śródmózgowy jest śmiertelnym podtypem udaru mózgu (Qureshi et al., 2001a), który odpowiada za śmiertelność wewnątrzszpitalną i niepełnosprawność wynoszącą odpowiednio 40 i 80% (van Asch i wsp., 2010). ICH jest odpowiedzialne za 10-15% wszystkich udarów mózgu, a częstość występowania ICH na świecie wynosi 2 miliony przypadków rocznie (van Asch i in., 2010), z czego około 120 000 przypadków rocznie w Stanach Zjednoczonych (Ribo i Grotta, 2006; Broderick i in., 2007; Aguilar i Freeman, 2010). Oczekuje się jednak, że do 2050 roku częstość występowania podwoi się (Qureshi et al., 2001b) z powodu starzenia się społeczeństwa i rozpowszechnienia stosowania leków przeciwzakrzepowych (Wang, 2010). W szczególności nie istnieje skuteczne leczenie ICH, a patofizjologia choroby jest słabo poznana.
Neurozapalenie charakteryzujące się aktywacją mikrogleju, komórek neuroimmunologicznych OUN, jest kluczowym czynnikiem przyczyniającym się do wywołanego przez ICH wtórnego uszkodzenia mózgu i utraty funkcji neurologicznych (Wang i Dore, 2007; Carmichael i in., 2008; Wang, 2010). Wprowadzenie do mózgu składników krwi, w tym trombiny, Hb i metabolitów Hb, takich jak hemina, stwarza podstawę dla odpowiedzi neurozapalnej po ICH (Wang i Dore, 2007; Carmichael i in., 2008; Robinson i in., 2009; Wang, 2010; Cai i in., 2011; Dang i in., 2011; Babu i in., 2012; Lin i in., 2012; Weng i in., 2015; Min i in., 2017). Warto zauważyć, że prozapalna aktywacja mikrogleju po ICH koreluje z uszkodzeniem bariery krew-mózg, obrzękiem mózgu, powiększeniem krwiaka, pogorszeniem stanu neurologicznego i słabym funkcjonalnym powrotem do zdrowia (Platt i in., 1998; Hickenbottom i in., 1999; Leira i in., 2004; Zhao i in., 2007). Co więcej, odpowiedź zapalna po ICH reguluje również mózgową rekrutację pochodzących z krwi monocytów/makrofagów, o których wiadomo, że regulują uszkodzenie mózgu wywołane ICH, a tym samym funkcjonalny powrót do zdrowia (Tessier i in., 1997; Shiratori i in., 2010; Starossom i in., 2012).
Galektyny są rodziną ewolucyjnie konserwowanych białek wiążących węglowodany (Barondes i in., 1994a,b; Kasai i Hirabayashi, 1996) zaangażowanych w aktywację komórek, różnicowanie, proliferację, migrację i apoptozę (Perillo i in., 1995; Yang i in., 1996; Perillo i in., 1998; Moiseeva i in., 1999; Vespa i in., 1999; Yamaoka i in., 2000; Goldring i in., 2002). Wśród różnych członków rodziny galektyn, pojawiające się dowody wskazują na kluczową rolę galektyny-1 i galektyny-3 w odpowiedzi neuroimmunologicznej w kilku stanach neuropatologicznych (Jeon i in., 2010; Starossom i in., 2012; Parikh i in., 2015). Jednakże, istnieje krytyczna luka w wiedzy na temat ich komórkowej ekspresji i funkcji po ICH. Celem obecnego manuskryptu jest wyjaśnienie wywołanej urazem krwotocznym modulacji i ekspresji komórkowej ekspresji Galektyny-1 i Galektyny-3 w mózgu w przedklinicznym modelu ICH.
Materiały i metody
Indukcja ICH
Wykrwawienie domózgowe wywołano u dorosłych samców myszy CD-1 (8-12 tygodni; n = 43), jak zgłoszono wcześniej (Sukumari-Ramesh i in., 2012a,b, 2016; Bonsack et al., 2016; Sukumari-Ramesh i Alleyne, 2016; Ahmad et al., 2017; Chen-Roetling et al., 2017). Krótko mówiąc, mysz została znieczulona (ketamina i ksylazyna) i wykonano małe nacięcie w celu odsłonięcia czaszki. Używając wiertła o dużej prędkości, wykonano otwór (0,5 mm) na czaszce około 2,2 mm bocznie od bregmy. Następnie mysz umieszczono na stereotaksyjnej ramie głowy i za pomocą strzykawki Hamiltona 26-G wstrzyknięto 0,04U bakteryjnej kolagenazy typu IV (Sigma, St. Louis, MO, Stany Zjednoczone) w 0,5 μL Phosphate Buffer Saline (pH 7,4; PBS) do lewej striatum (3,0 mm) pod kontrolą stereotaksji. Po wyjęciu igły otwór uszczelniano woskiem kostnym. Myszy utrzymywano w temperaturze 37 ± 0,5°C za pomocą regulatora temperatury dla małych zwierząt przez cały czas trwania procedury. The temporal pattern of hematoma after ICH is provided (Supplementary Figure S1).
Western Blotting
Mice były znieczulane i perfundowane przezskórnie PBS. Ipsilateralna tkanka mózgowa (zarówno hematomalne, jak i peryhematomalne regiony mózgu) została zebrana w buforze RIPA zawierającym inhibitory proteazy i fosfatazy i poddana sonikacji. Następnie próbki odwirowywano przy 14 000 obr/min przez 5 min w 4°C w celu zebrania supernatantu. Przy użyciu zestawu do oznaczania stężenia białka BCA (Pierce, Rockford, IL, Stany Zjednoczone) oceniano stężenie białka, a 30-50 mikrogramów próbek przesuwano na 4-20% żel dodecylosiarczanu sodu-poliakrylamidowy i przenoszono na membranę z poliwinylidenu difluorku (PVDF). Kleksy były inkubowane z odpowiednim przeciwciałem pierwotnym przez noc w temperaturze 4°C. Następnie przeprowadzono 2-godzinną inkubację z odpowiednim przeciwciałem drugorzędowym znakowanym Alexa Fluorem. Kleksy odczytywano przy użyciu systemu obrazowania w bliskiej podczerwieni Li-Cor Odyssey, a kwantyfikację przeprowadzono przy użyciu oprogramowania Quantity One (Bio-Rad, Foster City, CA, Stany Zjednoczone).
Immunohistochemia
Myszy były znieczulane i perfundowane przezskórnie PBS. Mózgi pobierano i umieszczano w 4% paraformaldehydzie na noc w temperaturze 4°C, a następnie zamrażano migawkowo. Następnie mózgi pocięto na 25-mm sekcje koronalne za pomocą kriostatu i umieszczono na szklanych szkiełkach. Sekcje inkubowano przez 2 godziny w 10% normalnej surowicy oślej w temperaturze pokojowej. Następnie przeprowadzono całonocną inkubację z odpowiednim przeciwciałem pierwotnym w temperaturze 4°C. Po przemyciu, sekcje inkubowano z odpowiednim przeciwciałem drugorzędowym znakowanym Alexa Fluorem przez 1 h w temperaturze pokojowej. Immunofluorescencję oznaczano przy użyciu laserowego mikroskopu konfokalnego Zeiss LSM510 Meta i określano kolokalizację komórek, jak opisano wcześniej (Laird i in., 2010). Analizowaliśmy trzy nie następujące po sobie sekcje na zwierzę i minimum 3 losowe pola wokół krwiaka.
Enzyme Linked Immunosorbent Assay
RAW 264.7, linię komórkową makrofagów myszy, umieszczono na 24-dołkowej płytce i pozwolono na inkubację przez 48 h w DMEM (Dulbecco’s Modified Eagle Medium) zawierającym 5% płodowej surowicy bydlęcej, 5% surowicy wzrostowej bydła i 1% penicyliny/ streptomycyny. Następnie komórki inkubowano z mysią rekombinowaną Galektyną-1 (6,25 lub 12,5 μg/ml; R&D Systems, Minneapolis, MN, Stany Zjednoczone) przez 1 h, po czym poddawano je 18-h działaniu LPS (100 ng/ml) lub heminy (30 μg/ml). Supernatant był zbierany i używany do wykrywania IL-6, metodą ELISA, zgodnie z instrukcjami producenta (Biolegend, San Diego, CA, Stany Zjednoczone). Krótko mówiąc, 96-dołkowa płytka została pokryta na noc w temperaturze 4°C specyficznym przeciwciałem wychwytującym. Po 1-godzinnej blokadzie, supernatant z hodowli komórkowej został dodany do dołków i inkubowany przez 2 godziny w temperaturze pokojowej. Wszelkie niezwiązane materiały zostały usunięte przez płukanie, a do dołków dodano roztwór przeciwciała wykrywającego i pozostawiono do inkubacji na 1 h w temperaturze pokojowej. Po kolejnym płukaniu, do każdego dołka dodano 100 μl roztworu Avidin- Horse Radish Peroxidase (HRP) na 30 min w temperaturze pokojowej. Po płukaniu do dołków dodawano roztwór substratu w celu rozwinięcia barwy. Zastosowano roztwór zatrzymujący, a płytkę odczytano przy 450 nm przy użyciu czytnika płytek mikrotitracyjnych (Bio-Tek, Epoch).
Genetyczne wyłączenie galektyny-3
RAW 264.7 poddano transfekcji za pomocą kontrolnego siRNA (ON-TARGET plus Non-targeting Pool; GE Dharmacon) lub siRNA dla Galektyny-3 (ON-TARGET plus Mouse Lgals3 siRNA; GE Dharmacon) przy użyciu HiPerFect Transfection Reagent (QIAGEN) zgodnie z instrukcjami producenta. Znokautowanie galektyny-3 weryfikowano 48h po transfekcji metodą western blotting, jak opisano wcześniej.
Analiza statystyczna
Dane analizowano za pomocą testu t lub jednokierunkowej analizy wariancji, a następnie testu post hoc Studenta-Newmana-Keulsa i wyrażono jako średnią ± błąd standardowy (SE). Wartość p < 0,05 uznawano za istotną.
Wyniki
Temporal Expression Pattern of Galectin-1 and Galectin-3 After ICH
Aby ocenić, czy uraz krwotoczny powoduje modulację ekspresji Galectin-1 i Galectin-3 w mózgu, wywołano u myszy ICH lub Sham, stosując metodę wstrzyknięcia kolagenazy. Biorąc pod uwagę wyłaniającą się rolę Galektyny-1 i Galektyny-3 w odpowiedziach neuroimmunologicznych, ipsilateralne sekcje mózgu myszy z sham lub ICH poddano ocenie z zastosowaniem analizy western blotting i immunohistochemii w różnych punktach czasowych od 1. do 7. dnia po operacji, czyli w okresie po urazie, który wykazał znaczącą indukcję zarówno pro-, jak i przeciwzapalnej aktywacji mikrogleju/makrofagów, a także astrocytów po ICH (Sukumari-Ramesh i in., 2012b, 2016; Bonsack et al., 2016).
Natomiast wycinki mózgu z obszarów mózgu pozorowanych lub kontralateralnych z ICH wykazywały bardzo marginalną lub niewykrywalną ekspresję Galektyny-1 i Galektyny-3, podczas gdy zwiększona ekspresja Galektyny-1 i Galektyny-3 była obserwowana w 3, 5 i 7 dniu po ICH (Ryc. 1, 2). W związku z tym liczba komórek immunopozytywnych dla Galektyny-1 znacząco wzrosła o około 4, 6 i 4-krotnie, odpowiednio w 3, 5 i 7 dniu po ICH, w porównaniu z pozorowanym (Figura 1B). Obserwacja ta została potwierdzona przez analizę Western Blotting, która ujawniła znaczącą indukcję Galektyny-1 począwszy od 3 dnia po ICH w porównaniu do pozorowanej (Figura 1C,D). Ponadto indukcja Galektyny-3 (Figura 2) odzwierciedlała ekspresję Galektyny-1 po ICH, a komórki immunopozytywne Galektyny-3 były około 15, 28 i 24-krotnie wyższe w dniu 3, dniu 5 i dniu 7 po ICH (Figura 2B) w porównaniu do szamki, a analiza western blotting, a następnie analiza densytometryczna potwierdziła indukowaną urazem zwiększoną ekspresję Galektyny-3 po ICH (Figury 2C, D).
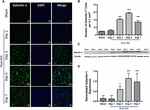
Rysunek 1. Zwiększona ekspresja Galektyny-1 po ICH. (A) Obrazy konfokalne przedstawiające czasowy wzór ekspresji Galektyny-1 po ICH (pasek skali = 20 μm; n = 3-5 na grupę). (B) Średnia liczba komórek Galectin-1-pozytywnych na 0,1 mm2 w ipsilateralnej striatum. (C) Zwiększona ekspresja Galektyny-1 została potwierdzona przez western blotting tkanki mózgowej z ipsilateralnej striatum. (D) Analiza densytometryczna (n = 3-5 na grupę) danych z western blotting. ∗p < 0,05, ∗∗∗p < 0,001 vs. sham.
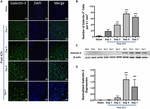
Rysunek 2. Zwiększona ekspresja galektyny-3 po ICH. (A) Czasowy wzór ekspresji Galektyny-3 w obszarze około-krwotocznym po ICH. Reprezentatywne obrazy konfokalne pokazują wyraźny wzrost ekspresji Galektyny-3 po ICH w porównaniu z Sham (pasek skali = 20 μm; n = 3-5 na grupę). (B) Średnia liczba komórek Galectin-3 pozytywnych na 0,1 mm2 w ipsilateralnej striatum. (C) Czasowa ekspresja Galektyny-3 została potwierdzona przy użyciu Western blotting. (D) Analiza densytometryczna (n = 3-5 na grupę) danych z Western Blotting. ∗∗p < 0,01, ∗∗∗p < 0,001 vs. sham.
Cellular Localization of Galectin-1 and Galectin-3 After ICH
Aby określić komórkową lokalizację Galektyny-1 i Galektyny-3 po ICH, sekcje mózgu poddano podwójnemu znakowaniu immunologicznemu. Ekspresję Galektyny-1 obserwowano głównie w astrocytach GFAP-pozytywnych (Figura 3A), a stereotaktyczne liczenie komórek ujawniło, że 85% komórek pozytywnych Galektyny-1 współekspresjonowało GFAP po ICH. Ponadto, ekspresja Galektyny-1 była również obserwowana w Iba1- pozytywnych mikroglejach/makrofagach po ICH (Figura 3B), ale tylko 12% komórek pozytywnych dla Galektyny-1 współekspresjonowało Iba1.
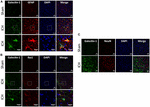
Rysunek 3. Ekspresja galektyny-1 jest obserwowana głównie w komórkach glejowych po ICH. Sekcje mózgu były podwójnie barwione immunostymulacyjnie dla (A) Galektyny-1 i GFAP, (B) Galektyny-1 i Iba1, (najniższy panel przedstawia obrazy w dużym powiększeniu) i (C) Galektyny-1 i NeuN (pasek skali = 20 μm; n = 3 na grupę). Ekspresja galektyny-1 była obserwowana głównie w komórkach GFAP-dodatnich i w podgrupie komórek Iba1-dodatnich. Komórki NeuN dodatnie nie wyrażały Galektyny-1 (n = 3 na grupę).
W przeciwieństwie do tego, ekspresja Galektyny-3 była głównie ograniczona do komórek Iba1-dodatnich (Figura 4A), a ekspresja Galektyny-3 była nieobecna w komórkach GFAP-dodatnich (Figura 5A), wskazując na zróżnicowaną ekspresję komórkową Galektyny-1 i Galektyny-3 po ICH. Ponadto, ekspresja Galektyny-3 była obserwowana w prozapalnych, M1 markerach mikrogleju lub makrofagów, CD16/32-dodatnich komórkach (Figura 4B) implikując nową rolę Galektyny-3 w odpowiedzi neurozapalnej po ICH. Warto zauważyć, że 88 i 92% komórek pozytywnych Galektyny-3 współekspresjonowało komórki Iba1 i CD16/32-dodatnie, odpowiednio. Zwraca uwagę fakt, że mikroglej i makrofagi wykazują fenotyp fagocytarny (ryc. 4A,B), co wskazuje na jej niezbadaną rolę w fagocytozie pośredniczonej przez mikroglej i makrofagi po ICH. Ponadto, komórki NeuN-pozytywne nie wykazywały ekspresji ani Galektyny-1 ani Galektyny-3 (Figury 3C, 5B).
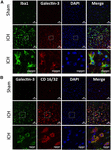
Rysunek 4. Ekspresja galektyny-3 w mikrogleju/makrofagach po ICH. Sekcje mózgu były barwione immunostymulacyjnie dla (A) Galektyny-3 i Iba1, oraz (B) Galektyny-3 i CD 16/32. Zarówno Iba1 (marker mikrogleju/makrofagów), jak i CD16/32 (marker prozapalnych mikroglejów lub makrofagów M1) -pozytywne komórki, współwyrażały Galectin-3 (n = 3 na grupę).
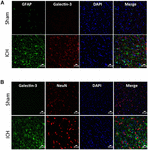
Rysunek 5. Komórkowa lokalizacja galektyny-3 po ICH. Sekcje mózgu były podwójnie barwione immunostymulacyjnie z (A) Galektyną-3 i GFAP, oraz (B) Galektyną-3 i NeuN. Ekspresja galektyny-3 była nieobecna w komórkach GFAP-pozytywnych lub NeuN-pozytywnych. Scale bar = 20 μm; n = 3 na grupę.
Galectin-1 and Galectin-3 Mediated Regulation of Inflammatory Response
Aby ustalić możliwą funkcjonalną rolę Galectin-1 i Galectin-3 po ICH, przeprowadziliśmy badania in vitro. Rekombinowana Galektyna-1 (6,25 i 12,5 μg/ml) znacząco zmniejszała indukowane przez LPS uwalnianie cytokiny prozapalnej, Interleukiny -6 (IL-6) z komórek RAW 264.7 ocenianych metodą ELISA w porównaniu do kontroli (Figura 6), wskazując na negatywną rolę regulacyjną Galektyny-1 w zapaleniu.

Rysunek 6. Rekombinowana Galektyna-1 i odpowiedź zapalna. Przed stymulacją LPS (100 ng/ml), komórki Raw 264.7 traktowano rekombinowaną Galektyną-1, a uwalnianie IL-6 mierzono za pomocą testu ELISA, jak szczegółowo opisano w metodach. Rekombinowana Galektyna-1 znacząco zmniejszyła indukowane przez LPS uwalnianie IL-6 z komórek RAW 246.7 (n = 4 na grupę). ∗∗∗p < 0,001 vs. LPS.
Aby przetestować funkcjonalną rolę Galektyny-3, przeprowadziliśmy genetyczny knockdown Galektyny-3 za pomocą siRNA w komórkach RAW 264.7 i badano odpowiedź zapalną. Wyciszenie genu za pomocą siRNA znacząco zmniejszyło ekspresję Galektyny-3 w komórkach RAW 264.7 o 52,95%, co wykazano metodą western blotting (Rysunki 7A,B). Warto zauważyć, że genetyczne wyłączenie Galektyny-3 za pomocą siRNA nie modulowało indukowanego przez LPS uwalniania IL-6 (Figura 7C), podczas gdy genetyczne wyłączenie Galektyny-3 znacznie zwiększyło uwalnianie IL-6 indukowane heminą (metabolit hemoglobiny, który gromadzi się w wysokim stężeniu w krwiakach wewnątrzczaszkowych) (Figura 7D), sugerując niezbadaną rolę Galektyny-3 w modulowaniu odpowiedzi zapalnej po ICH.
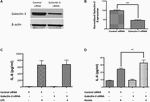
Rysunek 7. Galektyna-3 i odpowiedź zapalna (A) Komórki RAW 246.7 traktowano albo kontrolnym siRNA, albo siRNA Galektyny-3, jak szczegółowo opisano w metodach, a genetyczny knockdown Galektyny-3 weryfikowano za pomocą (A) western blotting, a następnie (B) analizy densytometrycznej. ∗∗∗∗p < 0,001 vs. kontrola siRNA. (C) Nokautowanie galektyny-3 nie modulowało indukowanego LPS uwalniania IL-6 (D), natomiast znacząco rozregulowało indukowane heminą uwalnianie IL-6 z komórek RAW 246.7 w porównaniu z kontrolą (n = 3 na grupę). ∗∗p < 0,01 vs. hemina.
Dyskusja
Galektyny są rodziną endogennych białek wiążących węglowodany, które odgrywają krytyczne role zarówno w warunkach fizjologicznych, jak i patologicznych poprzez oddziaływanie z glikozylowanymi receptorami na powierzchni komórek i modulowanie wewnątrzkomórkowych szlaków sygnałowych (Perillo i wsp., 1995, 1998; Yang i in., 1996; Moiseeva i in., 1999; Vespa i in., 1999; Yamaoka i in., 2000; Goldring i in., 2002; Laaf i in., 2019). Galektyny wykazują znaczne podobieństwo sekwencji w ich domenie rozpoznającej węglowodany (CRD) z podwyższonym powinowactwem do β-galaktozydów i są pierwotnie zdefiniowane przez ich zdolność do rozpoznawania disacharydu N-acetylolaktozaminy (Barondes i in., 1994a,b; Kasai i Hirabayashi, 1996). Jednakże ostatnie badania wykazują istotne różnice w ich właściwościach wiązania węglowodanów (Hirabayashi i in., 2002; Leffler i in., 2002; Carlsson i in., 2007).
Galektyna-1, najbardziej wszechobecnie wyrażany członek rodziny galektyn (Stillman i in., 2006) została włączona w regulację wrodzonej i adaptacyjnej odporności i jest obecna zarówno w lokalizacji wewnątrzkomórkowej, jak i zewnątrzkomórkowej (Verschuere i in., 2014). Pozakomórkowe funkcje Galektyny-1 zależą w dużej mierze od właściwości wiązania węglowodanów, podczas gdy funkcje wewnątrzkomórkowe obejmują głównie interakcje niezależne od węglowodanów (Verschuere i in., 2014). Zgodnie z rolą Galektyny-1 w odpowiedzi immunologicznej na obwodzie, wiadomo, że Galektyna-1 tłumi aktywację makrofagów (Barrionuevo i wsp., 2007), promuje selektywną apoptozę komórek T (Toscano i wsp., 2007), indukuje wydzielanie cytokiny przeciwzapalnej, IL-10 (van der Leij i wsp., 2004; Cedeno-Laurent et al., 2012) i zmniejsza produkcję tlenku azotu (NO) przez makrofagi (Correa et al., 2003).
Galektyna-1 ulega szerokiej ekspresji w tkankach nerwowych na etapie embrionalnym, ale po dojrzeniu staje się ograniczona głównie do tkanek obwodowych (Horie i Kadoya, 2002). Konsekwentnie, nieuszkodzone striatum mózgu wykazywało marginalną ekspresję Galektyny-1. Jednakże po krwotocznym uszkodzeniu mózgu zaobserwowano bardzo wyraźną ekspresję Galektyny-1 w astrocytach GFAP-pozytywnych. W związku z tym, Galektyna-1 jest zaangażowana w różnicowanie astrocytów i późniejsze uwalnianie BDNF (Brain Derived Neurotrophic factor) po urazie mózgu, co sugeruje rolę Galektyny-1 w neuroprotekcji (Sasaki i in., 2004; Qu i in., 2010). Ponadto, Galektyna-1 jest jednym z kluczowych regulatorów neurogenezy u dorosłych poprzez zdolność wiązania węglowodanów i promuje funkcjonalny powrót do zdrowia po udarze mózgu (Ishibashi i in., 2007). Podawanie galektyny-1 zmniejszyło apoptozę neuronów, zmniejszyło objętość zawału mózgu i poprawiło funkcje neurologiczne wywołane niedokrwieniem mózgu (Qu et al., 2011). Ponadto natywna i rekombinowana galektyna-1 chroniła neurony móżdżku myszy i szczurów przed neurotoksycznym działaniem glutaminianu (Lekishvili i in., 2006). Warto zauważyć, że galektyna-1 dezaktywuje zapalne mikroglej i chroni przed neurodegeneracją wywołaną zapaleniem (Starossom i in., 2012). Ponadto nasze badania wykazały, że rekombinowana galektyna-1 hamuje uwalnianie prozapalnej cytokiny, IL-6 z makrofagów myszy RAW 264.7 stymulowanych LPS w porównaniu do kontroli, co wskazuje na negatywną rolę regulacyjną galektyny-1 w zapaleniu.
Galektyna-1 jest jednym z endogennych ligandów CD45 (Walzel i in., 1999), który reguluje aktywację mikrogleju/makrofagów. Ponadto, interakcja galektyny-1 z CD45 prowadzi do zatrzymania tej glikoproteiny na błonie plazmatycznej i zwiększenia jej aktywności fosfatazowej. Ostatnie badania wykazały, że CD45 negatywnie reguluje prozapalną aktywację M1 mikrogleju, ale promuje przeciwzapalny fenotyp M2 poprzez modulację szlaków sygnałowych kinazy białkowej aktywowanej mitogenem p38 (p38MAPK), wiązania elementu odpowiedzi na cAMP (CREB) i jądrowego czynnika kappa-light-chain-enhancer of activated B cells (NF-kB) (Starossom i in., 2012). Efekt ten obejmował wiązanie się Galektyny-1 z rdzeniem 2 O-glikanów na CD45, co sugeruje, że ekspresja cząsteczek glikanu na aktywowanych mikroglejach/makrofagach jest wymagana do wiązania się Galektyny-1 i jej funkcji (Starossom i in., 2012). Ponadto, Galektyna-1 tłumiła indukowany metamfetaminą stan neurozapalny w ludzkich komórkach śródbłonka mikronaczyniowego mózgu (Parikh i in., 2015), a sugeruje się, że Galektyna-1 jest zaangażowana w wyrastanie neurytów i łączność synaptyczną. W sumie dane te sugerują, że indukcja Galektyny-1 w reaktywnych astrocytach po ICH może być mechanizmem komunikacji międzykomórkowej ułatwiającym pośredniczącą przez astrocyty regulację neuroprotekcji po ICH, uzasadniającą dalsze badania.
Galektyna-3 jest białkiem typu chimerycznego o masie 25-35 kDa, którego funkcje ściśle zależą od lokalizacji (Thomas i Pasquini, 2018). Ekspresja Galektyny-3 została stwierdzona w jądrze, oraz cytoplazmie (Liu i wsp., 2002). Ponadto makrofagi i aktywowane mikroglej mogą uwalniać Galektynę-3 w przestrzeni pozakomórkowej, co prowadzi odpowiednio do przebudowy macierzy pozakomórkowej i zmienionej odpowiedzi zapalnej (Li i in., 2008; Jeon i in., 2010). Zamiast klasycznego szlaku sekrecji w retikulum endoplazmatycznym/Golgim, Galektyna-3 podąża alternatywnym szlakiem sekrecyjnym w celu wydzielenia i eksportu (Mehul i Hughes, 1997), a po uwolnieniu Galektyna-3 oddziałuje z kilkoma receptorami zewnątrzkomórkowymi. Chociaż Galektyna-3 jest ściśle związana z kaskadą reakcji zapalnych, dokładna rola funkcjonalna Galektyny-3 w neurozapaleniu jest w dużej mierze kontrowersyjna. Jednakże, donosi się, że galektyna-3 uwalniana przez mikroglej działa jako endogenny ligand TLR-4 (Toll Like Receptor-4) (Burguillos i in., 2015). Co więcej, genetyczna delecja Galektyny-3 zmniejszała utratę neuronów, a podanie przeciwciała Galektyny-3 wywierało działanie neuroprotekcyjne w przedklinicznym modelu urazowego uszkodzenia mózgu (Yip i wsp., 2017), co łącznie sugeruje szkodliwą rolę Galektyny-3 po urazie mózgu. Z kolei celowana delecja Galektyny-3 nasilała niedokrwienne uszkodzenie mózgu i neurodegenerację po niedokrwieniu mózgu (Lalancette-Hebert i in., 2012) sugerując neuroprotekcyjną rolę Gelektyny-3 po uszkodzeniu mózgu. Ponadto, Galektyna-3 przyczynia się do angiogenezy i neurogenezy, co sugeruje jej możliwą rolę w naprawie niedokrwionego mózgu (Yan i in., 2009). Galektyna-3 promuje również różnicowanie oligodendrogleju, przyczyniając się do funkcjonalnego powrotu do zdrowia po zaburzeniach demielinizacyjnych (Pasquini i in., 2011). Te sprzeczne funkcjonalne role Galektyny-3 po neuropatologii mogą wynikać z różnej ekspresji subkomórkowej Galektyny-3 lub z powodu różnic w patofizjologii zaburzeń mózgu, które wymagają dalszych badań.
Zgodnie z innymi warunkami neuropatologicznymi, obserwowaliśmy podwyższoną ekspresję Galektyny-3 po ICH i ekspresja była głównie obserwowana w komórkach Iba1 pozytywnych, komórkach zapalnych OUN. Komórki Iba1 dodatnie po ICH mogą być mikroglejem lub makrofagami naciekającymi, które odgrywają rolę we wrodzonej odpowiedzi immunologicznej. Ostatnie badania pokazują, że mikroglej i makrofagi mogą mieć różne role po patologii mózgu (Gao et al., 2017). Zgodnie z tą linią, badania z hodowlą pierwotnych mikroglejów dokumentują prozapalną rolę Galektyny-3 (Burguillos i in., 2015), podczas gdy badania z makrofagami wykazują rolę przeciwzapalną (MacKinnon i in., 2008), co uzasadnia dalsze badania. Ponadto, genetyczny knockdown Galektyny-3 w komórkach RAW 246.7 zwiększał indukowane heminą uwalnianie IL-6, cytokiny prozapalnej, co sugeruje rolę Galektyny-3 w odpowiedzi zapalnej po ICH. Ponadto, mikroglej i makrofagi wykazują fenotyp fagocytarny, co wskazuje na jej niezbadaną rolę w fagocytozie pośredniczonej przez mikroglej i makrofagi, która odgrywa kluczową rolę w usuwaniu krwiaków i regeneracji mózgu po ICH. Konsekwentnie, ostatnie doniesienia sugerują, że makrofagi, które gromadzą się w OUN podczas infekcji pasożytami, obficie wyrażają Galectin-3 (Quenum Zangbede et al., 2018), a aktywowane mikroglejki fagocytują komórki za pośrednictwem Galectin-3 (Nomura et al., 2017). Ponadto, podwyższone poziomy Galektyny-3 w osoczu były silnie związane z zapaleniem, ciężkością i złymi wynikami u pacjentów z ostrym ICH (Yan i in., 2016). Dlatego też potrzebne są dalsze badania wyjaśniające funkcjonalne role Galektyny-3 po ICH.
Wnioski
Galektyna-1 i Galektyna-3 wykazywały bardzo głęboką i zwiększoną ekspresję od dnia 3 do dnia 7-post-injury, w okołomózgowym regionie mózgu po ICH w porównaniu do Sham. Ponadto, ekspresja Galektyny-1 była obserwowana głównie w astrocytach GFAP-pozytywnych, podczas gdy ekspresja Galektyny-3 była obserwowana głównie w komórkach Iba1 oraz CD16/32-pozytywnych, komórkach zapalnych OUN. Ponadto badania genetyczne wykazały negatywn± regulacyjn± rolę zarówno Galektyny-1, jak i Galektyny-3 w uwalnianiu cytokiny prozapalnej IL-6 w zależno¶ci od bodĽca. W sumie dane te sugerują, że Galektyna-1 i Galektyna-3 mogą być ukierunkowane w modulowaniu odpowiedzi glejowych, a tym samym uszkodzenia mózgu po ICH, co zasługuje na dalsze badania.
Oświadczenie etyczne
Badania na zwierzętach zostały przejrzane i zatwierdzone przez Committee on Animal Use for Research and Education na Augusta University, zgodnie z wytycznymi NIH i USDA.
Wkład autorów
FB przeprowadziła badania immunohistochemiczne, badania hodowli komórkowych i western blotting oraz uczestniczyła w analizie danych. SS-R wymyślił i zaprojektował eksperymenty, przeprowadził operacje na zwierzętach, badania genetyczne i analizę danych, a także sporządził manuskrypt. Obaj autorzy przeczytali i zatwierdzili ostateczną wersję manuskryptu.
Funding
Ta praca była wspierana przez granty od National Institutes of Health (R01NS107853) i American Heart Association (14SDG18730034) dla SS-R.
Oświadczenie o konflikcie interesów
Autorzy deklarują, że badania były prowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Materiały uzupełniające
Materiały uzupełniające do tego artykułu można znaleźć online pod adresem: https://www.frontiersin.org/articles/10.3389/fncel.2019.00157/full#supplementary-material
RYSUNEK S1 | Wzorzec czasowy krwiaka po ICH.
Skróty
CD16/32, Cluster of Differentiation 16/32; CD45: Cluster of Differentiation 45; CNS, ośrodkowy układ nerwowy; ELISA, enzyme linked immunosorbent assay; GFAP, glial fibrillary acidic protein; Hb, hemoglobina; Iba1, zjonizowana cząsteczka adaptorowa wiążąca wapń 1; ICH, krwotok domózgowy; LPS, lipopolisacharyd; NeuN, jądra neuronów; PBS, sól fizjologiczna buforu fosforanowego; RIPA, radioimmunoprecypitacja.
Aguilar, M. I., and Freeman, W. D. (2010). Spontaneous intracerebral hemorrhage. Semin. Neurol. 30, 555-564.
Google Scholar
Ahmad, A. S., Mendes, M., Hernandez, D., and Dore, S. (2017). Skuteczność laropiprantu w minimalizowaniu urazu mózgu po doświadczalnym krwotoku śródmózgowym. Sci. Rep. 7:9489.
PubMed Abstract | Google Scholar
Babu, R., Bagley, J. H., Di, C., Friedman, A. H., and Adamson, C. (2012). Thrombin and hemin as central factors in the mechanisms of intracerebral hemorrhage-induced secondary brain injury and as potential targets for intervention. Neurosurg. Focus 32:E8.
PubMed Abstract | Google Scholar
Barondes, S. H., Castronovo, V., Cooper, D. N., Cummings, R. D., Drickamer, K., Feizi, T., et al. (1994a). Galectins: a family of animal beta-galactoside-binding lectins. Cell 76, 597-598. doi: 10.1016/0092-8674(94)90498-7
CrossRef Full Text | Google Scholar
Barondes, S. H., Cooper, D. N., Gitt, M. A., and Leffler, H. (1994b). Galektyny. Structure and function of a large family of animal lectins. J. Biol. Chem. 269, 20807-20810.
Google Scholar
Barrionuevo, P., Beigier-Bompadre, M., Ilarregui, J. M., Toscano, M. A., Bianco, G. A., Isturiz, M. A., et al. (2007). A novel function for galectin-1 at the crossroad of innate and adaptive immunity: galectin-1 regulates monocyte/macrophage physiology through a nonapoptotic ERK-dependent pathway. J. Immunol. 178, 436-445. doi: 10.4049/jimmunol.178.1.436
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonsack, F. T., Alleyne, C. H. Jr., and Sukumari-Ramesh, S. (2016). Augmented expression of TSPO after intracerebral hemorrhage: a role in inflammation? J. Neuroinflamm. 13:151.
PubMed Abstract | Google Scholar
Broderick, J., Connolly, S., Feldmann, E., Hanley, D., Kase, C., Krieger, D., et al. (2007). Guidelines for the management of spontaneous intracerebral hemorrhage in adults: 2007 update: a guideline from the American heart association/american stroke association stroke council, high blood pressure research council, and the quality of care and outcomes in research interdisciplinary working group. Circulation 116,e391-e413.
Google Scholar
Burguillos, M. A., Svensson, M., Schulte, T., Boza-Serrano, A., Garcia-Quintanilla, A., Kavanagh, E., et al. (2015). Microglia-secreted galectin-3 acts as a toll-like receptor 4 ligand and contributes to microglial activation. Cell Rep. 10, 1626-1638. doi: 10.1016/j.celrep.2015.02.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Cai, Y., Cho, G. S., Ju, C., Wang, S. L., Ryu, J. H., Shin, C. Y., et al. (2011). Activated microglia are less vulnerable to hemin toxicity due to nitric oxide-dependent inhibition of JNK and p38 MAPK activation. J. Immunol. 187, 1314-1321. doi: 10.4049/jimmunol.1002925
PubMed Abstract | CrossRef Full Text | Google Scholar
Carlsson, S., Oberg, C. T., Carlsson, M. C., Sundin, A., Nilsson, U. J., Smith, D., et al. (2007). Affinity of galectin-8 and its carbohydrate recognition domains for ligands in solution and at the cell surface. Glycobiology 17, 663-676. doi: 10.1093/glycob/cwm026
PubMed Abstract | CrossRef Full Text | Google Scholar
Carmichael, S. T., Vespa, P. M., Saver, J. L., Coppola, G., Geschwind, D. H., Starkman, S., et al. (2008). Genomic profiles of damage and protection in human intracerebral hemorrhage. J. Cereb. Blood Flow Metab. 28, 1860-1875. doi: 10.1038/jcbfm.2008.77
PubMed Abstract | CrossRef Full Text | Google Scholar
Cedeno-Laurent, F., Opperman, M., Barthel, S. R., Kuchroo, V. K., and Dimitroff, C. J. (2012). Galectin-1 triggers an immunoregulatory signature in Th cells functionally defined by IL-10 expression. J. Immunol. 188, 3127-3137. doi: 10.4049/jimmunol.1103433
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen-Roetling, J., Kamalapathy, P., Cao, Y., Song, W., Schipper, H. M., and Regan, R. F. (2017). Astrocyte heme oxygenase-1 reduces mortality and improves outcome after collagenase-induced intracerebral hemorrhage. Neurobiol. Dis. 102, 140-146. doi: 10.1016/j.nbd.2017.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Correa, S. G., Sotomayor, C. E., Aoki, M. P., Maldonado, C. A., and Rabinovich, G. A. (2003). Opposite effects of galectin-1 on alternative metabolic pathways of L-arginine in resident, inflammatory, and activated macrophages. Glycobiology 13, 119-128. doi: 10.1093/glycob/cwg010
PubMed Abstract | CrossRef Full Text | Google Scholar
Dang, T. N., Robinson, S. R., Dringen, R., and Bishop, G. M. (2011). Uptake, metabolizm i toksyczność heminy w hodowlanych neuronach. Neurochem. Int. 58, 804-811. doi: 10.1016/j.neuint.2011.03.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Gao, H., Danzi, M. C., Choi, C. S., Taherian, M., Dalby-Hansen, C., Ellman, D. G., et al. (2017). Opposing functions of microglial and macrophagic TNFR2 in the pathogenesis of experimental autoimmune encephalomyelitis. Cell Rep. 18, 198-212. doi: 10.1016/j.celrep.2016.11.083
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldring, K., Jones, G. E., Thiagarajah, R., and Watt, D. J. (2002). The effect of galectin-1 on the differentiation of fibroblasts and myoblasts in vitro. J. Cell Sci. 115(Pt 2), 355-366.
PubMed Abstract | Google Scholar
Hickenbottom, S. L., Grotta, J. C., Strong, R., Denner, L. A., and Aronowski, J. (1999). Nuclear factor-kappaB and cell death after experimental intracerebral hemorrhage in rats. Stroke 30, 2472-2477.
Google Scholar
Hirabayashi, J., Hashidate, T., Arata, Y., Nishi, N., Nakamura, T., Hirashima, M., et al. (2002). Oligosaccharide specificity of galectins: a search by frontal affinity chromatography. Biochim. Biophys. Acta 1572, 232-254. doi: 10.1016/s0304-4165(02)00311-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Horie, H., and Kadoya, T. (2002). Galektyna-1 odgrywa zasadniczą rolę w tkankach nerwowych dorosłych ssaków. Roles of oxidized galectin-1. Glycoconjugate J. 19, 479-489. doi: 10.1023/b:glyc.0000014077.84016.52
PubMed Abstract | CrossRef Full Text | Google Scholar
Ishibashi, S., Kuroiwa, T., Sakaguchi, M., Sun, L., Kadoya, T., Okano, H., et al. (2007). Galectin-1 reguluje neurogenezę w strefie subventricularnej i promuje funkcjonalną regenerację po udarze mózgu. Exp. Neurol. 207, 302-313. doi: 10.1016/j.expneurol.2007.06.024
PubMed Abstract | CrossRef Full Text | Google Scholar
Jeon, S. B., Yoon, H. J., Chang, C. Y., Koh, H. S., Jeon, S. H., and Park, E. J. (2010). Galectin-3 exerts cytokine-like regulatory actions through the JAK-STAT pathway. J. Immunol. 185, 7037-7046. doi: 10.4049/jimmunol.1000154
PubMed Abstract | CrossRef Full Text | Google Scholar
Kasai, K., and Hirabayashi, J. (1996). Galektyny: rodzina lektyn zwierzęcych, które rozszyfrowują glikokody. J. Biochem. 119, 1-8. doi: 10.1093/oxfordjournals.jbchem.a021192
CrossRef Full Text | Google Scholar
Laaf, P., Elling, L., and Kren, V. (2019). Interakcje galektyna-węglowodany w biomedycynie i biotechnologii. Trends Biotechnol. 37, 402-415.
PubMed Abstract | Google Scholar
Laird, M. D., Sukumari-Ramesh, S., Swift, A. E., Meiler, S. E., Vender, J. R., and Dhandapani, K. M. (2010). Curcumin attenuates cerebral edema following traumatic brain injury in mice: a possible role for aquaporin-4? J. Neurochem. 113, 637-648. doi: 10.1111/j.1471-4159.2010.06630.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lalancette-Hebert, M., Swarup, V., Beaulieu, J. M., Bohacek, I., Abdelhamid, E., Weng, Y. C., et al. (2012). Galectin-3 is required for resident microglia activation and proliferation in response to ischemic injury. J. Neurosci. 32, 10383-10395. doi: 10.1523/jneurosci.1498-12.2012
PubMed Abstract | CrossRef Full Text | Google Scholar
Leffler, H., Carlsson, S., Hedlund, M., Qian, Y., and Poirier, F. (2002). Wprowadzenie do galektyn. Glycoconjugate J. 19, 433-440. doi: 10.1023/b:glyc.0000014072.34840.04
CrossRef Full Text | Google Scholar
Leira, R., Davalos, A., Silva, Y., Gil-Peralta, A., Tejada, J., Garcia, M., et al. (2004). Early neurologic deterioration in intracerebral hemorrhage: predictors and associated factors. Neurology 63, 461-467. doi: 10.1212/01.wnl.0000133204.81153.ac
CrossRef Full Text | Google Scholar
Lekishvili, T., Hesketh, S., Brazier, M. W., and Brown, D. R. (2006). Mouse galectin-1 inhibits the toxicity of glutamate by modifying NR1 NMDA receptor expression. Eur. J. Neurosci. 24, 3017-3025. doi: 10.1111/j.1460-9568.2006.05207.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, Y., Komai-Koma, M., Gilchrist, D. S., Hsu, D. K., Liu, F. T., Springall, T., et al. (2008). Galectin-3 is a negative regulator of lipopolysaccharide-mediated inflammation. J. Immunol. 181, 2781-2789. doi: 10.4049/jimmunol.181.4.2781
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, S., Yin, Q., Zhong, Q., Lv, F. L., Zhou, Y., Li, J. Q., et al. (2012). Heme activates TLR4-mediated inflammatory injury via MyD88/TRIF signaling pathway in intracerebral hemorrhage. J. Neuroinflamm. 9:46.
PubMed Abstract | Google Scholar
Liu, F. T., Patterson, R. J., and Wang, J. L. (2002). Intracellular functions of galectins. Biochim. Biophys. Acta 1572, 263-273. doi: 10.1016/s0304-4165(02)00313-6
CrossRef Full Text | Google Scholar
MacKinnon, A. C., Farnworth, S. L., Hodkinson, P. S., Henderson, N. C., Atkinson, K. M., Leffler, H., et al. (2008). Regulation of alternative macrophage activation by galectin-3. J. Immunol. 180, 2650-2658. doi: 10.4049/jimmunol.180.4.2650
CrossRef Full Text | Google Scholar
Mehul, B., and Hughes, R. C. (1997). Celowanie w błonę plazmatyczną, pęcherzykowe pączkowanie i uwalnianie galektyny 3 z cytoplazmy komórek ssaków podczas sekrecji. J. Cell Sci. 110( Pt 10), 1169-1178.
PubMed Abstract | Google Scholar
Min, H., Choi, B., Jang, Y. H., Cho, I. H., and Lee, S. J. (2017). Heme molecule functions as an endogenous agonist of astrocyte TLR2 to contribute to secondary brain damage after intracerebral hemorrhage. Mol. Brain 10:27.
PubMed Abstract | Google Scholar
Moiseeva, E. P., Spring, E. L., Baron, J. H., and de Bono, D. P. (1999). Galectin 1 modulates attachment, spreading and migration of cultured vascular smooth muscle cells via interactions with cellular receptors and components of extracellular matrix. J. Vasc. Res. 36, 47-58. doi: 10.1159/000025625
PubMed Abstract | CrossRef Full Text | Google Scholar
Nomura, K., Vilalta, A., Allendorf, D. H., Hornik, T. C., and Brown, G. C. (2017). Activated microglia desialylate and phagocytose cells via neuraminidase. Galektyna-3, i kinaza tyrozynowa Mer. J. Immunol. 198, 4792-4801. doi: 10.4049/jimmunol.1502532
PubMed Abstract | CrossRef Full Text | Google Scholar
Parikh, N. U., Aalinkeel, R., Reynolds, J. L., Nair, B. B., Sykes, D. E., Mammen, M. J., et al. (2015). Galectin-1 suppresses methamphetamine induced neuroinflammation in human brain microvascular endothelial cells: neuroprotective role in maintaining blood brain barrier integrity. Brain Res. 1624, 175-187. doi: 10.1016/j.brainres.2015.07.033
PubMed Abstract | CrossRef Full Text | Google Scholar
Pasquini, L. A., Millet, V., Hoyos, H. C., Giannoni, J. P., Croci, D. O., Marder, M., et al. (2011). Galectin-3 drives oligodendrocyte differentiation to control myelin integrity and function. Cell Death. Diff. 18, 1746-1756. doi: 10.1038/cdd.2011.40
PubMed Abstract | CrossRef Full Text | Google Scholar
Perillo, N. L., Marcus, M. E., and Baum, L. G. (1998). Galektyny: wszechstronne modulatory adhezji komórek, proliferacji komórek i śmierci komórek. J. Mol. Med. (Berl.) 76, 402-412. doi: 10.1007/s001090050232
PubMed Abstract | CrossRef Full Text | Google Scholar
Perillo, N. L., Pace, K. E., Seilhamer, J. J., and Baum, L. G. (1995). Apoptosis of T cells mediated by galectin-1. Nature 378, 736-739. doi: 10.1038/378736a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Platt, N., da Silva, R. P., and Gordon, S. (1998). Recognizing death: the phagocytosis of apoptotic cells. Trends Cell Biol. 8, 365-372. doi: 10.1016/s0962-8924(98)01329-4
CrossRef Full Text | Google Scholar
Qu, W. S., Wang, Y. H., Ma, J. F., Tian, D. S., Zhang, Q., Pan, D. J., et al. (2011). Galectin-1 attenuates astrogliosis-associated injuries and improves recovery of rats following focal cerebral ischemia. J. Neurochem. 116, 217-226. doi: 10.1111/j.1471-4159.2010.07095.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Qu, W. S., Wang, Y. H., Wang, J. P., Tang, Y. X., Zhang, Q., Tian, D. S., et al. (2010). Galectin-1 enhances astrocytic BDNF production and improves functional outcome in rats following ischemia. Neurochem. Res. 35, 1716-1724. doi: 10.1007/s11064-010-0234-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Quenum Zangbede, F. O., Chauhan, A., Sharma, J., and Mishra, B. B. (2018). Galektyna-3 w makrofagach M2 odgrywa ochronną rolę w rozwiązywaniu neuropatologii w infekcji pasożytniczej mózgu poprzez regulację obrotu neutrofilów. J. Neurosci. 38, 6737-6750. doi: 10.1523/jneurosci.3575-17.2018
PubMed Abstract | CrossRef Full Text | Google Scholar
Qureshi, A. I., Ling, G. S., Khan, J., Suri, M. F., Miskolczi, L., Guterman, L. R., et al. (2001a). Quantitative analysis of injured, necrotic, and apoptotic cells in a new experimental model of intracerebral hemorrhage. Crit. Care Med. 29, 152-157. doi: 10.1097/00003246-200101000-00030
PubMed Abstract | CrossRef Full Text | Google Scholar
Qureshi, A. I., Tuhrim, S., Broderick, J. P., Batjer, H. H., Hondo, H., and Hanley, D. F. (2001b). Spontaniczny krwotok śródmózgowy. N. Engl. J. Med. 344, 1450-1460.
Google Scholar
Ribo, M., and Grotta, J. C. (2006). Latest advances in intracerebral hemorrhage. Curr. Neurol. Neurosci. Rep. 6, 17-22. doi: 10.1007/s11910-996-0004-0
CrossRef Full Text | Google Scholar
Robinson, S. R., Dang, T. N., Dringen, R., and Bishop, G. M. (2009). Hemin toxicity: a preventable source of brain damage following hemorrhagic stroke. Redox Rep. 14, 228-235. doi: 10.1179/135100009×12525712409931
PubMed Abstract | CrossRef Full Text | Google Scholar
Sasaki, T., Hirabayashi, J., Manya, H., Kasai, K., and Endo, T. (2004). Galectin-1 indukuje różnicowanie astrocytów, co prowadzi do produkcji czynnika neurotroficznego pochodzenia mózgowego. Glycobiology 14, 357-363. doi: 10.1093/glycob/cwh043
PubMed Abstract | CrossRef Full Text | Google Scholar
Shiratori, M., Tozaki-Saitoh, H., Yoshitake, M., Tsuda, M., and Inoue, K. (2010). P2X7 receptor activation induces CXCL2 production in microglia through NFAT and PKC/MAPK pathways. J. Neurochem. 114, 810-819. doi: 10.1111/j.1471-4159.2010.06809.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Starossom, S. C., Mascanfroni, I. D., Imitola, J., Cao, L., Raddassi, K., Hernandez, S. F., et al. (2012). Galectin-1 deactivates classically activated microglia and protects from inflammation-induced neurodegeneration. Immunity 37,249-263. doi: 10.1016/j.immuni.2012.05.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Stillman, B. N., Hsu, D. K., Pang, M., Brewer, C. F., Johnson, P., Liu, F. T., et al. (2006). Galectin-3 and galectin-1 bind distinct cell surface glycoprotein receptors to induce T cell death. J. Immunol. 176, 778-789. doi: 10.4049/jimmunol.176.2.778
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., and Alleyne, C. H. Jr. (2016). Post-injury administration of tert-butylhydroquinone attenuates acute neurological injury after intracerebral hemorrhage in mice. J. Mol. Neurosci. MN 58, 525-531. doi: 10.1007/s12031-016-0722-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., Alleyne, C. H. Jr., and Dhandapani, K. M. (2012a). Astrocyte-specific expression of survivin after intracerebral hemorrhage in mice: a possible role in reactive gliosis? J. Neurotrauma 29, 2798-2804. doi: 10.1089/neu.2011.2243
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., Alleyne, C. H. Jr., and Dhandapani, K. M. (2012b). Astroglioza: cel dla interwencji w krwotoku śródmózgowym? Transl. Stroke Res. 3(Suppl. 1), 80-87. doi: 10.1007/s12975-012-0165-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., Alleyne, C. H. Jr., and Dhandapani, K. M. (2016). The histone deacetylase inhibitor suberoylanilide hydroxamic acid (SAHA) confers acute neuroprotection after intracerebral hemorrhage in mice. Transl. Stroke Res. 7, 141-148. doi: 10.1007/s12975-015-0421-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Tessier, P. A., Naccache, P. H., Clark-Lewis, I., Gladue, R. P., Neote, K. S., and McColl, S. R. (1997). Chemokine networks in vivo: involvement of C-X-C and C-C chemokines in neutrophil extravasation in vivo in response to TNF-alpha. J. Immunol. 159, 3595-3602.
PubMed Abstract | Google Scholar
Thomas, L., and Pasquini, L. A. (2018). Galectin-3-mediated glial crosstalk drives oligodendrocyte differentiation and (Re)myelination. Front. Cell. Neurosci. 12:297. doi: 10.3389/fncel.2018.00297
PubMed Abstract | CrossRef Full Text | Google Scholar
Toscano, M. A., Bianco, G. A., Ilarregui, J. M., Croci, D. O., Correale, J., Hernandez, J. D., et al. (2007). Differential glycosylation of TH1, TH2 and TH-17 effector cells selectively regulates susceptibility to cell death. Nat. Immunol. 8, 825-834. doi: 10.1038/ni1482
PubMed Abstract | CrossRef Full Text | Google Scholar
van Asch, C. J., Luitse, M. J., Rinkel, G. J., van der Tweel, I., Algra, A., and Klijn, C. J. (2010). Incidence, case fatality, and functional outcome of intracerebral haemorrhage over time, according to age, sex, and ethnic origin: a systematic review and meta-analysis. Lancet Neurol. 9, 167-176. doi: 10.1016/s1474-4422(09)70340-0
PubMed Abstract | CrossRef Full Text | Google Scholar
van der Leij, J., van den Berg, A., Blokzijl, T., Harms, G., van Goor, H., Zwiers, P., et al. (2004). Dimeric galectin-1 induces IL-10 production in T-lymphocytes: an important tool in the regulation of the immune response. J. Pathol. 204, 511-518. doi: 10.1002/path.1671
PubMed Abstract | CrossRef Full Text | Google Scholar
Verschuere, T., Toelen, J., Maes, W., Poirier, F., Boon, L., Tousseyn, T., et al. (2014). Glioma-derived galectin-1 regulates innate and adaptive antitumor immunity. Int. J. Cancer 134, 873-884. doi: 10.1002/ijc.28426
PubMed Abstract | CrossRef Full Text | Google Scholar
Vespa, G. N., Lewis, L. A., Kozak, K. R., Moran, M., Nguyen, J. T., Baum, L. G., et al. (1999). Galectin-1 specific modulates TCR signals to enhance TCR apoptosis but inhibit IL-2 production and proliferation. J. Immunol. 162, 799-806.
PubMed Abstract | Google Scholar
Walzel, H., Schulz, U., Neels, P., and Brock, J. (1999). Galectin-1, a natural ligand for the receptor-type protein tyrosine phosphatase CD45. Immunol. Lett. 67, 193-202. doi: 10.1016/s0165-2478(99)00012-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J. (2010). Przedkliniczne i kliniczne badania nad zapaleniem po krwotoku śródmózgowym. Prog. Neurobiol. 92, 463-477. doi: 10.1016/j.pneurobio.2010.08.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J., and Dore, S. (2007). Inflammation after intracerebral hemorrhage. J. Cereb. Blood Flow Metab. 27, 894-908.
Google Scholar
Weng, X., Tan, Y., Chu, X., Wu, X. F., Liu, R., Tian, Y., et al. (2015). N-methyl-D-aspartic acid receptor 1 (NMDAR1) aggravates secondary inflammatory damage induced by hemin-NLRP3 pathway after intracerebral hemorrhage. Chin. J. Traumatol. 18, 254-258. doi: 10.1016/j.cjtee.2015.11.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamaoka, K., Mishima, K., Nagashima, Y., Asai, A., Sanai, Y., and Kirino, T. (2000). Expression of galectin-1 mRNA correlates with the malignant potential of human gliomas and expression of antisense galectin-1 inhibits the growth of 9 glioma cells. J. Neurosci. Res. 59, 722-730. doi: 10.1002/(sici)1097-4547(20000315)59:6<722::aid-jnr4>3.0.co;2-h
PubMed Abstract | CrossRef Full Text | Google Scholar
Yan, X. J., Yu, G. F., Jie, Y. Q., Fan, X. F., Huang, Q., and Dai, W. M. (2016). Role of galectin-3 in plasma as a predictive biomarker of outcome after acute intracerebral hemorrhage. J. Neurol. Sci. 368, 121-127. doi: 10.1016/j.jns.2016.06.071
PubMed Abstract | CrossRef Full Text | Google Scholar
Yan, Y. P., Lang, B. T., Vemuganti, R., and Dempsey, R. J. (2009). Galectin-3 mediates post-ischemic remodeling tkanki. Brain Res. 1288, 116-124. doi: 10.1016/j.brainres.2009.06.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, R. Y., Hsu, D. K., and Liu, F. T. (1996). Ekspresja galektyny-3 moduluje wzrost komórek T i apoptozę. Proc. Natl. Acad. Sci. U.S.A. 93, 6737-6742. doi: 10.1073/pnas.93.13.6737
PubMed Abstract | CrossRef Full Text | Google Scholar
Yip, P. K., Carrillo-Jimenez, A., King, P., Vilalta, A., Nomura, K., Chau, C. C., et al. (2017). Galektyna-3 uwalniana w odpowiedzi na traumatyczne uszkodzenie mózgu działa jako alarmina orkiestrująca odpowiedź immunologiczną mózgu i promująca neurodegenerację. Sci. Rep. 7:41689.
PubMed Abstract | Google Scholar
Zhao, X., Zhang, Y., Strong, R., Zhang, J., Grotta, J. C., and Aronowski, J. (2007). Distinct patterns of intracerebral hemorrhage-induced alterations in NF-kappaB subunit, iNOS, and COX-2 expression. J. Neurochem. 101, 652-663. doi: 10.1111/j.1471-4159.2006.04414.x
PubMed Abstract | CrossRef Full Text | Google Scholar
.