Pojęcie łagodnego przerostu gruczołu krokowego (benign prostatic hyperplasia – BPH) pojawiło się w naszym środowisku niedawno, pomijając inne terminy, takie jak powszechnie stosowany gruczolak prostaty. Nie jest to tylko zmiana nomenklatury, ale raczej koncepcja, która integruje trzy aspekty, z których można postrzegać najczęstszą chorobę prostaty (40% mężczyzn w wieku powyżej 50 lat). Autor zajmuje się diagnostyką i leczeniem BPH, ponieważ są to dwa aspekty, które mogą najbardziej interesować farmaceutę środowiskowego.
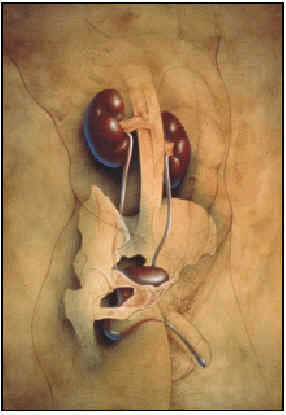
Prostata jest nieparzystym, pozaotrzewnowym narządem zlokalizowanym w przestrzeni miednicy. Jego nazwa wywodzi się z języka greckiego i oznacza „ten umieszczony poniżej”, ponieważ znajduje się on tuż pod szyją pęcherza moczowego, przytulony do cewki moczowej. Nazwę tę nadał jej Herophilus w 300 r. p.n.e. Rozwija się z wiekiem, a dojrzałość osiąga w okresie pokwitania. Jego funkcja jest zasadniczo płciowa, bierze udział w tworzeniu płynu nasiennego i skurczu w czasie wytrysku.
Prawidłowa prostata jest narządem mięśniowo-gruczołowym: 30% stanowi masa mięśniowa, zlokalizowana w części przedniej, a resztę gruczoł, położony w części tylnej i bocznej.
PH jest wynikiem nienowotworowego rozrostu tkanki tworzącej prostatę. Jego przyczyny nie są znane, ale wydaje się, że jest związany ze zmianami hormonalnymi, które występują wraz z wiekiem. W wieku 60 lat połowa populacji mężczyzn ma już mikroskopowe objawy BPH, a w wieku 70 lat ponad 40% ma powiększoną prostatę, którą można wykryć w badaniu. Normalna wielkość gruczołu krokowego jest wielkości kasztana. W wieku 40 lat może być wielkości moreli, a w wieku 60 lat może być wielkości cytryny.
Powiększenie gruczołu krokowego jest związane z koncepcją histologiczną choroby, jednak istnieją bardzo powiększone gruczoły krokowe, które występują bez przeszkód i bez objawów (i odwrotnie). Objawy tej choroby są niespecyficzne i mogą występować w wielu innych schorzeniach urologicznych. Wynika z tego, że mogą być pacjenci z objawami i powiększeniem gruczołu krokowego lub z powiększeniem gruczołu krokowego bez objawów, lub z obydwoma, i w każdym przypadku może być lub nie być przeszkody w przepływie moczu (ryc. 1).

Fig. Model Halda: a) powiększenie i objawy bez niedrożności; b) objawy i niedrożność bez powiększenia; c) powiększenie i niedrożność bez objawów; d) powiększenie, objawy i niedrożność.
BPH jest jedną z najczęstszych chorób u mężczyzn w wieku podeszłym. Zwykle nie wpływa na funkcje seksualne, ale powiększony gruczoł powoduje ucisk na pęcherz moczowy i cewkę moczową, co utrudnia przepływ moczu. Oddawanie moczu rozpoczyna się z trudem, w postaci małych kropelek. Często pojawia się również potrzeba częstszego oddawania moczu i może wystąpić pilne parcie na mocz. Wielu mężczyzn musi wstawać kilka razy w ciągu nocy, aby oddać mocz, inni mają nieprzyjemne uczucie, ponieważ pęcherz nigdy nie opróżnia się całkowicie. Zmuszanie pęcherza do opróżniania się może pogorszyć sytuację: pęcherz kurczy się, ściany pęcherza grubieją i tracą elastyczność, a mięśnie pęcherza stają się mniej sprawne. Nagromadzenie moczu w pęcherzu może predysponować do zakażeń dróg moczowych, a próba wymuszenia strumienia moczu spowoduje jedynie wzrost ciśnienia, co może ostatecznie uszkodzić nerki.
Całkowite zablokowanie cewki moczowej jest medycznym stanem nagłym wymagającym natychmiastowego cewnikowania. Inne możliwe powikłania BPH to kamica pęcherza moczowego i krwawienie.
Diagnostyka
Mimo braku wiedzy na temat historii naturalnej i patogenezy BPH, oczywiste jest, że coraz więcej konsultacji lekarskich dotyczy problemów wynikających z rozrostu guza w gruczole krokowym.
W ostatnich latach pojawiły się nowe metody terapeutyczne, co spowodowało zmianę w standardowym leczeniu objawowego BPH, spychając chirurgię do roli drugorzędnej. Dlatego bardzo ważna jest diagnostyka tej patologii i ustalenie parametrów, które pozwolą na prawidłową ocenę pacjenta w celu późniejszego ustalenia wskazań terapeutycznych dla BPH.
Tradycyjnie symptomatologia BPH została podzielona na dwie klasy, objawy obturacyjne i objawy podrażnieniowe (tabela 1). Pierwsze z nich wynikają z obecności przeszkody podpęcherzowej, a drugie są najczęściej spowodowane niestabilnością detrusora. Prawie trzy czwarte mężczyzn z BPH ma objawy mieszane.

Występowanie symptomatologii w badaniach populacji ogólnej jest związane z wiekiem i wiekiem wystąpienia objawów w momencie pierwszej wizyty, co różni się w poszczególnych badaniach. W przeciwieństwie do tego, znaczenie kliniczne nie wydaje się być związane z rzeczywistą wielkością gruczołu krokowego. Pacjenci z ciężkimi objawami przeszkody podpęcherzowej mogą mieć małe prostaty, a inne osoby bez objawów klinicznych mogą mieć duże prostaty. W związku z tym, że trudno jest określić ilościowo objawy mikcyjne prostatyzmu, konieczne jest zastosowanie kilku systemów punktowych do oceny nasilenia objawów. Istnieją różne kwestionariusze, ale najczęściej akceptowana jest 7-pytaniowa skala oceny objawów, nazwana przez komitet konsensusu w sprawie BPH i sponsorowana przez WHO (Paryż, 1991) jako International Prostatic Symptom Score (IPSS). Do tego kwestionariusza dodano pytanie dotyczące jakości życia (tabela 2).

Jak w każdej patologii, do ustalenia podejrzenia rozpoznania niezbędny jest wywiad. Na podstawie danych uzyskanych z wywiadu można wykluczyć inne patologie o objawach podobnych do BPH (tab. 3). Następnie przeprowadza się ogólne i miejscowe badanie fizykalne w celu oceny gruczołu krokowego i istnienia ewentualnych powikłań. Niezbędne jest badanie palpacyjne jamy brzusznej w celu wykrycia znacznych objętości zalegającego moczu oraz oczywiście badanie per rectum. Badanie rektalne służy do oceny morfologii i konsystencji gruczołu krokowego, a jednocześnie do oceny napięcia zwieracza odbytu, w celu wykrycia zmian neurologicznych, z tego samego powodu konieczna jest obserwacja odruchu pęcherzowo-jelitowego. Jednakże sam dotyk nie pozwala na dokładną ocenę wielkości, masy i stopnia przeszkody spowodowanej przez prostatę. Z tego powodu badanie będzie kontynuowane z serią badań uzupełniających, które obejmują analizę moczu (metodą dipstick lub posiew) w celu wykluczenia ewentualnego zakażenia układu moczowego, oznaczenie PSA, ocenę funkcji nerek oraz badanie ultrasonograficzne (transrektalne i brzuszne). USG renerfuzyjne pomoże wykluczyć ewentualne powikłania (kamica moczowa, uchyłki pęcherza, poszerzenie dróg moczowych, nowotwory nerek lub pęcherza) oraz określić ilość resztek popłuczyn. Ultrasonografia nadłonowa jest prostą, nieobciążoną przeciwwskazaniami i ryzykiem metodą pozwalającą na dość dokładną ocenę objętości i morfologii gruczołu krokowego. Jednak ultrasonografia transrektalna jest znacznie dokładniejsza i dlatego jest zalecana do tego celu.

PSA jest glikoproteiną o masie cząsteczkowej pomiędzy 33 000-34 000 Da wytwarzaną w nabłonku komórek prostaty. Występuje w wysokich stężeniach w osoczu nasienia, gdzie bierze udział w upłynnianiu skrzepu nasiennego powstającego po wytrysku. Normalne stężenie PSA w surowicy u młodego, zdrowego mężczyzny jest bardzo niskie i wzrasta wraz z wiekiem. Tradycyjnie przyjmuje się, że wartości PSA w zakresie od 0 do 4 ng/ml są prawidłowe. Jego obecność w surowicy w wartościach wyższych niż prawidłowe wskazuje na obecność patologii gruczołu krokowego. Jednak PSA nie jest bynajmniej „idealnym” markerem nowotworowym, ponieważ wykrywa się go również (choć w niskich stężeniach) w innych tkankach spoza gruczołu krokowego. Co więcej, nie można go również uznać za specyficzny marker nowotworowy, gdyż jest on również podwyższony w BPH. Stwierdzono, że u tych chorych wartości te są wyższe przy większej objętości gruczołu krokowego lub w obecności powikłań wtórnych do BPH. Zaproponowano wartość progową 10 ng/ml dla odróżnienia BPH od raka prostaty, ale 10% osób z BPH ma wyższe wartości PSA. Z tego powodu przeprowadzono kilka badań mających na celu wykrycie form PSA, które zwiększyłyby swoistość tego testu.
Obecnie American Cancer Society i American Urological Association zalecają coroczne oznaczanie PSA i cyfrowe badanie odbytnicy u mężczyzn powyżej 50. roku życia jako metody przesiewowe w kierunku raka gruczołu krokowego. Niektórzy autorzy uważają, że badania przesiewowe przed 50. rokiem życia są wskazane jedynie u osób, u których ryzyko rozwoju raka gruczołu krokowego jest duże ze względu na występowanie raka w rodzinie. W tym przypadku rozpoczynają badanie od 40 roku życia. Nie uważają również, aby badania przesiewowe były uzasadnione u mężczyzn powyżej 70. roku życia, z wyjątkiem tych, u których przewidywana długość życia wynosi ponad 10 lat.
Posiadając wszystkie dane uzyskane w różnych badaniach (tab. 4), możemy ustalić prawidłowe rozpoznanie i określić najwłaściwsze leczenie dla każdego przypadku.

Terapie
Głównym celem terapeutycznym, jak w każdej terapii, jest ten, który pozwala uzyskać korzystny stosunek korzyści do skutków ubocznych. W tym celu pacjentów z BPH dzieli się na trzy grupy: łagodną, umiarkowaną i ciężką.
Do grupy łagodnej zalicza się tych pacjentów, u których objawy określone ilościowo w kwestionariuszu IPSS wynoszą mniej niż 8, mają niewielki wpływ na jakość życia i nie występują objawy obturacyjne; podgrupa umiarkowanego BPH odpowiada pacjentom z IPSS 8-10, z lub bez pewnego stopnia obturacji, i może mieć wpływ na jakość życia. Grupa ciężkiego BPH to osoby z IPSS większym niż 19 i/lub objawami niedrożności, z dużym wpływem na jakość życia.
Strategia leczenia będzie zatem zależeć od nasilenia objawów i stopnia niedrożności. Tak więc pacjenci z ciężkimi objawami (IPSS > 20) i/lub powikłaniami wynikającymi z przeszkody (niewydolność nerek, zatrzymanie moczu, kamica pęcherza moczowego, nawracające zakażenia dróg moczowych, krwiomocz, zaleganie moczu większe niż 300 ml lub uchyłki pęcherza moczowego) będą wymagali leczenia operacyjnego. Pacjenci z łagodną symptomatologią i niewielkim dyskomfortem mogą być leczeni w sposób wyczekujący, natomiast pacjenci z umiarkowanymi objawami lub źle tolerujący łagodną symptomatologię powinni być leczeni farmakologicznie.
Schemat strategii leczenia BPH przedstawiono na rycinie 2.

Ryc. 2. Strategia leczenia w BPH (Źródło: Bobé F, et al. Treatment of benign prostatic hyperplasia).
Leczenie farmakologiczne
W leczeniu BPH dostępne są obecnie trzy grupy leków: alfa-blokery (doksazosyna, terazosyna, alfuzosyna, tamsulosyna), inhibitory 5-alfa-reduktazy (finasteryd) oraz fitoterapia (tabela 5).

Alfa-blokery
Działają poprzez blokowanie receptorów alfa-1 we włóknach mięśniowych szyi pęcherza moczowego i tkanki gruczołu krokowego z następowym rozluźnieniem, co prowadzi do zmniejszenia oporu dla przepływu moczu bez niekorzystnego wpływu na kurczliwość wypieracza. Ich rola polega więc na zmniejszeniu dynamicznej składowej niedrożności gruczołu krokowego. Alfa-blokery zmniejszają współczulne napięcie mięśni szyi pęcherza i gruczołu krokowego, poprawiają objawy i szczytowy przepływ moczu bez zmiany wielkości gruczołu krokowego.
Selektywne alfa-blokery są w stanie zwiększyć przepływ moczu i poprawić objawy w ciągu 2-3 tygodni, co czyni je lekami pierwszego wyboru. Należą do nich selektywne blokery receptorów alfa-1, które mają mniej działań niepożądanych, ponieważ nie blokują receptorów mięśni gładkich w innych lokalizacjach. Do tej grupy zalicza się prazosynę, alfuzosynę, terazosynę i doksazosynę. Nowszym alfa-blokerem jest tamsulosyna, która ma mniej działań niepożądanych.
Głównymi alfa-blokerami stosowanymi w leczeniu BPH są:
Prazosyna. Początkowo stosowany w leczeniu wysokiego ciśnienia krwi, obecnie nie jest stosowany w leczeniu BPH, ponieważ ma większe działania niepożądane niż inne leki z tej grupy.
Terazosin. Jeden z najszerzej badanych blokerów. Zalecana dawka wynosi 5 mg/dobę i musi być podawana w dawkach stopniowych, począwszy od 1 mg/dobę przez 4 tygodnie, aby zminimalizować ryzyko niedociśnienia ortostatycznego. W odniesieniu do ciśnienia tętniczego krwi wywołuje nieistotne klinicznie zmiany u pacjentów normotensyjnych i działanie hipotensyjne u pacjentów z nadciśnieniem, co czyni ją dobrą opcją terapeutyczną u pacjentów z obiema chorobami.
Doksazosyna. Stosowany również u pacjentów z nadciśnieniem tętniczym. Początkowo leczenie należało rozpoczynać stopniowo, ale obecnie dostępny jest nowy preparat o przedłużonym uwalnianiu w dawce 4 mg, zawierający substancję czynną w tabletce niewchłanialnej przez żołądek. Umożliwia to jednorazowe dawkowanie dobowe 4 mg od pierwszej dawki. Badania z dawkami 8 mg/dobę wykazały istotnie dodatkową poprawę objawową.
173; Tamsulosyna. Jest selektywnym blokerem alfa-1 i dlatego jest pierwszym „uroselektywnym” preparatem w swojej grupie. Niższe powinowactwo do receptorów alfa-1B zlokalizowanych w naczyniach krwionośnych zapewnia mu większe bezpieczeństwo sercowo-naczyniowe. Dawka jest stała, 0,4 mg/dobę, bez konieczności stopniowego zwiększania i wydaje się, że poprawa symptomatologii może być osiągnięta szybciej.
Ale odpowiedź terapeutyczna alfa-blokerów jako grupy jest szybka i zależna od dawki, nie ma badań, które wykazałyby zapobieganie progresji choroby, rozwojowi powikłań lub że zmniejszają one potrzebę ostatecznego leczenia chirurgicznego.
Działaniami niepożądanymi tej grupy farmakologicznej są bóle głowy, osłabienie, senność, nudności, przekrwienie błony śluzowej nosa, uczucie oszołomienia i niedociśnienie ortostatyczne, które jest najgorzej tolerowane, chociaż niepożądane odczucia można zmniejszyć, rozpoczynając podawanie leku w coraz większych dawkach wieczorem.
5-inhibitory alfa-reduktazy
Tak jest w przypadku finasterydu, który wywołuje regresję powiększenia gruczołu krokowego i zwiększa szczytowy przepływ moczu, poprawiając w ten sposób objawy pacjenta. Jako działania niepożądane finasteryd ma długotrwałe reperkusje (minimum 6 miesięcy), powodując zaburzenia funkcji seksualnych (zmniejszenie libido, zaburzenia wytrysku i impotencja oraz inne, takie jak ginekomastia, zwiększona wrażliwość piersi i wysypki skórne) oraz zmniejszenie wartości PSA w surowicy (50%) bez zmiany odsetka wolnego PSA.
Wyniki badań klinicznych wykazują, po 2 latach, poprawę kliniczną z istotnymi różnicami w porównaniu z placebo oraz mniejszą częstość występowania zatrzymania moczu i operacji prostaty w grupie leczonej finasterydem. Wyniki uzyskane w innym badaniu pokazują, że odpowiedź utrzymuje się w czasie. Tak więc po 4 latach obserwuje się nie tylko zmniejszenie wskaźników objawowych i objętości gruczołu krokowego oraz zwiększenie przepływu szczytowego (z różnicami istotnymi statystycznie we wszystkich przypadkach), ale także mniejszy odsetek operacji gruczołu krokowego (10 vs. 5%) i zatrzymania moczu (7 vs. 3%), co oznacza zmniejszenie ryzyka operacji przy zastosowaniu finasterydu odpowiednio o 55 i 57% (badanie PLESS). Ogółem 13% pacjentów otrzymujących placebo i 7% pacjentów leczonych finasterydem będzie wymagało operacji lub cewnikowania pęcherza moczowego z powodu ostrego zatrzymania moczu, przy czym rzeczywista korzyść wystąpiła u 6% pacjentów.
Większe prostaty korzystniej reagują na leczenie mające na celu zmniejszenie ich rozmiarów, co potwierdzają wyniki metaanalizy 6 badań klinicznych. Podstawowa objętość gruczołu krokowego jest zatem czynnikiem predykcyjnym odpowiedzi na leczenie, przy czym finasteryd jest szczególnie skuteczny w przypadku dużych gruczołów krokowych (większych niż 40 ml). I odwrotnie, pacjenci z małym gruczołem krokowym muszą być uważani za słabych początkowych kandydatów do leczenia tym lekiem. Różnice w odpowiedzi na leczenie finasterydem nie mogą być wyjaśnione jedynie wielkością gruczołu krokowego i mogą odzwierciedlać heterogenny charakter choroby. Z drugiej strony, niezależnie od tego, klinicysta zaleca leczenie finasterydem jako leczenie z wyboru u pacjentów z nawracającym krwinkomoczem wtórnym do BPH.
Fitoterapia
Postępowanie fitoterapeutyczne polega na stosowaniu wyciągów roślinnych (Pygeum africanum, Serenoa repens). Ich mechanizm działania nie jest znany, ale niektóre badania postulują, że mają one przewagę nad placebo, a nawet uzyskują poprawę urodynamiczną. S. repens wydaje się działać na metabolizm prostaglandyn w hodowlach komórek prostaty, a także moduluje ludzką 5-alfa-reduktazę, dlatego został oceniony w randomizowanym badaniu przeciwko finasterydowi w 1.098 pacjentów, wykazując podobną skuteczność i brak korelacji między intensywnością objawów a wielkością gruczołu krokowego.
Mają one niewiele działań niepożądanych i stanowią niski koszt ekonomiczny.
Leczenie chirurgiczne
Tranuretralna resekcja gruczołu krokowego jest najczęstszą metodą leczenia chirurgicznego BPH. Jest to skuteczna, ale nie doskonała metoda leczenia. Około 20% pacjentów, którzy poddali się operacji, jest niezadowolonych z długoterminowego wyniku zabiegu. Powikłania obejmują 70% wytrysków wstecznych, impotencję u 5%, pooperacyjne zakażenia dróg moczowych u 5% i różnego stopnia nietrzymanie moczu u 3% chorych, a także utrzymywanie się objawów u zmiennego odsetka chorych w zależności od kryteriów selekcji.
Wskazania do zabiegu operacyjnego powinny być zatem ustalone u tych chorych, u których objawy rzeczywiście ulegną poprawie. Nie należy podejmować przedwczesnych interwencji, ale z drugiej strony nie należy ich odkładać u chorych z ciężką niedrożnością, u których progresja deterioracji detrusora będzie warunkowała utrzymywanie się objawów podrażnieniowych pomimo ustąpienia niedrożności gruczołu krokowego.
Istnieją liczne bezwzględne wskazania chirurgiczne, takie jak nawracające zatrzymanie moczu, nawracające zakażenia układu moczowego, rozwój uropatii obturacyjnej górnych dróg moczowych i ciężki krwiomocz.
Minimalnie inwazyjne metody leczenia (tabela 6) mogą poprawić przepływ moczu do wartości wolnych od przeszkód, choć zawsze poniżej wartości uzyskiwanych w wyniku resekcji przezcewkowej lub otwartej adenotomii. Niemniej jednak stanowią one ważną opcję leczenia u pacjentów z poważnym pogorszeniem stanu ogólnego, u których celem jest zaoferowanie alternatywy dla stałego cewnikowania i u których konwencjonalna operacja wiązałaby się ze znacznym ryzykiem chirurgicznym.

Bibliografia ogólna
Baile A, Asua J, Albisu A. Benign prostatic hyperplasia. Zmienność praktyki i wytyczne oparte na dowodach. Atención Primaria 1999;23(3):142-50.
Berkow R, Fletcher AJ, et al. The Merck manual. Barcelona: Doyma, 1989;1808-9.
Bobé F, et al. Treatment of benign prostatic hyperplasia. FMC 2002;9(4): 290-9.
Giménez Serrano S. Patologie gruczołu krokowego. Farmacia Profesional 2003;17(1):39-43.
Orejas V. Aktualne aspekty w diagnostyce łagodnego przerostu gruczołu krokowego. Jano 2001;60(1375):78-82.
Ribal MJ, Alcaraz A. Codzienna konsultacja. Co byś zrobił z łagodnym przerostem gruczołu krokowego? Medicina Integral 2000;35(07):302-7.
Sebastián L. Gruczolak prostaty. Obecny status. Jano 1999;56(1305):57-63.
Vela R. Benign prostatic hyperplasia, a medical-surgical pathology? Jano 2001;61(1395):38-41.