Dehydrogenaza izocytrynianowa katalizuje reakcje chemiczne:
Izocytrynian + NAD+ ⇌ {displaystyle \\rightleftharpoons }

2-oksoglutaran + CO2 + NADH + H+ izocyjanian + NADP+ ⇌ {displaystyle \\\ www. wikipedia.pl }

2-oksoglutaran + CO2 + NADPH + H+
Całkowita energia swobodna dla tej reakcji wynosi -8,4 kJ/mol.
StepsEdit
W ramach cyklu kwasu cytrynowego, izocyjanian, wytwarzany z izomeryzacji cytrynianu, ulega zarówno utlenianiu, jak i dekarboksylacji. Za pomocą enzymu dehydrogenazy izocyjanianu (IDH), izocyjanian jest utrzymywany w miejscu aktywnym przez otaczające go aminokwasy argininę, tyrozynę, asparaginę, serynę, treoninę i kwas asparaginowy. Pierwsza ramka przedstawia ogólny przebieg reakcji dehydrogenazy izocytrynianowej. Reagenty niezbędne do działania tego mechanizmu enzymatycznego to izocyjanian, NAD+/NADP+ oraz Mn2+ lub Mg2+. Produktami reakcji są alfa-ketoglutaran, dwutlenek węgla oraz NADH + H+/NADPH + H+. Cząsteczki wody są wykorzystywane do pomocy w deprotonowaniu oksygenów (O3) izocyjanianu.
Drugie pole to krok 1, który jest utlenianiem alfa-C (C#2). Utlenianie jest pierwszym krokiem, że izocyjanian przechodzi przez. W tym procesie, grupa alkoholowa poza alfa-węglowym (C#2) jest deprotonowana i elektrony płyną do alfa-C tworząc grupę ketonową i usuwając wodorek poza C#2 używając NAD+/NADP+ jako kofaktora przyjmującego elektrony. Utlenianie alfa-C pozwala na pozycji, gdzie elektrony (w następnym kroku) będzie pochodzić w dół od grupy karboksylowej i popychając elektrony (co podwójne wiązanie tlenu) z powrotem w górę na tlen lub chwytając pobliski proton z pobliskiego aminokwasu lizyny.
Trzecia pole jest krok 2, który jest dekarboksylacji oxalosuccinate. W tym kroku, tlen grupy karboksylowej jest deprotonowane przez pobliskiego aminokwasu tyrozyny i tych elektronów spływają do węgla 2. Dwutlenek węgla opuszcza węgiel beta izocyjanianu jako grupa opuszczająca z elektronami płynącymi do tlenu ketonowego poza alfa-C umieszczając ładunek ujemny na tlenie alfa-C i tworząc nienasycone wiązanie podwójne alfa-beta pomiędzy węglami 2 i 3. Samotna para na tlenie alfa-C odbiera proton z pobliskiego aminokwasu lizyny.
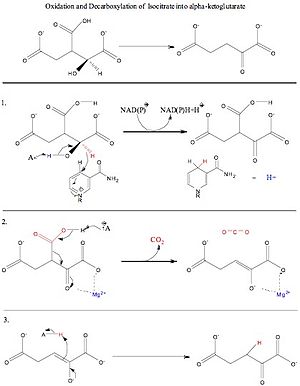
Czwarte pole jest krok 3, który jest nasycenie alfa-beta nienasycone wiązanie podwójne między karbony 2 i 3. W tym kroku reakcji, lizyna deprotonuje tlen z węgla alfa i samotnej pary elektronów na tlenu węgla alfa schodzi reforming wiązania podwójnego ketonu i popychając samotnej pary (tworząc wiązanie podwójne między alfa i beta węgla) off, podnosząc proton z pobliskiego aminokwasu tyrozyny. W wyniku tej reakcji powstaje alfa-ketoglutaran, NADH + H+/NADPH + H+ oraz CO2.
Szczegółowy mechanizmEdit
Dwie reszty aminokwasowe asparaginianu (poniżej po lewej) oddziałują z dwiema sąsiednimi cząsteczkami wody (w6 i w8) w kompleksie Mn2+ izocyjanianu świń IDH, aby zdeprotonować alkohol z atomu węgla alfa. W tym obrazie zachodzi również utlenianie alfa-C, gdzie NAD+ przyjmuje wodorek, w wyniku czego powstaje oksalobursztynian. Wraz ze zmianą stereochemiczną sp3 do sp2 wokół alfa-C, istnieje grupa ketonowa, która jest utworzona z grupy alkoholowej. Tworzenie tego podwójnego wiązania ketonowego pozwala na rezonans do miejsca, jak elektrony schodzące z grupy karboksylan opuszczenia przenieść w kierunku ketonu.
Dekarboksylacja oxalosuccinate (poniżej centrum) jest kluczowym krokiem w tworzeniu alfa-ketoglutarate. W tej reakcji, samotna para na sąsiednim hydroksylu tyrozyny abstrahuje proton z grupy karboksylowej. Ta grupa karboksylowa jest również określana jako podjednostka beta w cząsteczce izocytrynianu. Deprotonacja grupy karboksylowej powoduje, że samotna para elektronów przemieszcza się w dół tworząc dwutlenek węgla i oddzielając się od oksalobursztynianu. Elektrony kontynuują ruch w kierunku węgla alfa popychając elektrony wiązania podwójnego (tworząc keton) w górę, aby wyabstrahować proton z sąsiedniej reszty lizyny. Powstaje nienasycone wiązanie podwójne alfa-beta między węglem 2 i 3. Jak widać na rysunku, zielony jon reprezentuje Mg2+ lub Mn2+, który jest kofaktorem niezbędnym do zajścia tej reakcji. Jon metalu tworzy mały kompleks poprzez interakcje jonowe z atomami tlenu na czwartym i piątym karbonie (znany również jako podjednostka gamma izocyjanianu).
Po tym jak dwutlenek węgla zostanie oddzielony od oksalobursztynianu w etapie dekarboksylacji (poniżej po prawej), enol ulegnie tautomeryzacji do keto z. Tworzenie podwójnego wiązania ketonowego rozpoczyna się od deprotonacji tego tlenu poza węglem alfa (C#2) przez tę samą lizynę, która protonowała tlen w pierwszej kolejności. The samotny para elektronów porusza się w dół kopiąc off the samotny para który robić the podwójny wiązanie. Ta samotna para elektronów abstrahuje proton z tyrozyny, który deprotonował grupę karboksylową w kroku dekarboksylacji. Powodem, dla którego możemy powiedzieć, że reszty Lys i Tyr będą takie same jak w poprzednim etapie, jest fakt, że pomagają one w utrzymaniu cząsteczki izocyjanianu w miejscu aktywnym enzymu. Te dwie reszty będą w stanie tworzyć wiązania wodorowe tam i z powrotem tak długo, jak będą wystarczająco blisko substratu.
 Etap oksydoreduktazy, w którym NAD+ jest używany do przyjęcia wodorku.
|
 Dekarboksylacja oksalobursztynianu.
|
 Wysycanie nienasyconego wiązania podwójnego alfa-beta.
|
Enzym dehydrogenazy izocytrynianowej, jak stwierdzono powyżej, wytwarza alfa-ketoglutaran, dwutlenek węgla i NADH + H+/NADPH + H+. Istnieją trzy zmiany, które wystąpiły w całej reakcji. Utlenianie węgla 2, dekarboksylacja (utrata dwutlenku węgla) z węgla 3, i tworzenie grupy ketonowej ze zmianą stereochemiczną z sp3 na sp2.
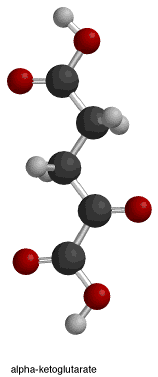 |
 Mitochondrialna dehydrogenaza izocytrynianowa zależna od NADP+ złożona z Mn2+ i izocytrynianu. Widok powierzchni kieszeni miejsca aktywnego, gdzie izocyjanian jest związany przez polarne aminokwasy.
|
 Porcine Mitochondrial NADP+-dependent Isocitrate Dehydrogenase Complexed with Mn2+ and Isocitrate.
|
 Kompleks enzymu u świń; miejsce aktywne izocyjanianu i przylegające A.A.
|
Miejsce aktywneEdit
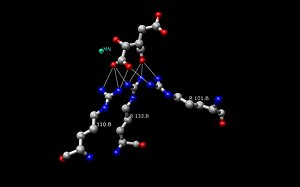
Sztuka enzymu dehydrogenazy izocyjanianowej (IDH) w Escherichia coli była pierwszą strukturą, która została wyjaśniona i zrozumiana. Od tego czasu, struktura IDH Escherichia coli jest używana przez większość badaczy do porównań z innymi enzymami dehydrogenazy izocytrynianowej. Istnieje wiele szczegółowych informacji na temat tego enzymu bakteryjnego i stwierdzono, że większość dehydrogenaz izocyjanianowych jest podobna pod względem struktury, a zatem i funkcji. To podobieństwo struktury i funkcji daje podstawę do przypuszczeń, że struktury są konserwowane, podobnie jak aminokwasy. Dlatego też miejsca aktywne większości prokariotycznych enzymów dehydrogenazy izocyjanianowej powinny być również zachowane, co można zaobserwować w wielu badaniach przeprowadzonych na enzymach prokariotycznych. Z drugiej strony, eukariotyczne enzymy dehydrogenazy izocyjanianowej nie zostały jeszcze w pełni odkryte. Każdy dimer IDH posiada dwa miejsca aktywne. Każde miejsce aktywne wiąże cząsteczkę NAD+/NADP+ oraz jon metalu dwuwartościowego (Mg2+,Mn2+). Ogólnie rzecz biorąc, każde miejsce aktywne ma konserwowaną sekwencję aminokwasów dla każdego specyficznego miejsca wiążącego. W Desulfotalea psychrophila (DpIDH) i u świń (PcIDH) istnieją trzy substraty związane z miejscem aktywnym.
- Izocyjanian wiąże się w obrębie miejsca aktywnego z konserwowaną sekwencją około ośmiu aminokwasów poprzez wiązania wodorowe. Kwasy te obejmują (mogą różnić się pozostałościami, ale mają podobne właściwości) tyrozynę, serynę, asparaginę, argininę, argininę, tyrozynę i lizynę. Ich pozycje na szkielecie różnią się, ale wszystkie są w bliskim zakresie (np. Arg131 DpIDH i Arg133 PcIDH, Tyr138 DpIDH i Tyr140 PcIDH).
- Jon metalu (Mg2+, Mn2+) wiąże się z trzema konserwowanymi aminokwasami poprzez wiązania wodorowe. Te aminokwasy obejmują trzy reszty asparaginianowe.
- NAD+ i NADP+ wiążą się w miejscu aktywnym w czterech regionach o podobnych właściwościach wśród enzymów IDH. Regiony te różnią się, ale są w okolicach , , , i . Ponownie regiony różnią się, ale bliskość regionów są konserwowane.