- Introduction
- Epidemiologia
- The Organism and Pathophysiology of C. difficile Diarrhea
- Manifestacje kliniczne
- Diagnoza
- Practical Guidelines for Diagnosis of C. difficile Diarrheal Syndromes
- Endoskopowa diagnostyka biegunki wywołanej przez C. difficile i zapalenia jelita grubego
- Leczenie
- Zarządzanie nawracającą biegunką wywołaną C. difficile
- Szerokie zapalenie jelita grubego wywołane przez C. difficile
- Podsumowanie
Introduction
Clostridium difficile-associated diarrhea (CDAD) jest coraz częściej uznawana za przyczynę chorób szpitalnych. Częstość występowania CDAD jest bardzo zróżnicowana i zależy od wielu czynników, takich jak ogniska szpitalne, schematy stosowania środków przeciwdrobnoustrojowych oraz indywidualna wrażliwość. Nie ma doniesień o badaniach prospektywnych prowadzonych przez szpitale śledzące dodatni wynik toksyny A lub A/B oraz wyniki CDAD i jego powikłań.
Centers for Disease Control and Prevention (CDC) przeanalizowało trendy sekularne w częstości występowania CDAD i zgłosiło stały wzrost od 1987 do 2001 roku (1). W tym raporcie, 30% z 440 lekarzy chorób zakaźnych, którzy uczestniczyli w ankiecie internetowej, zgłosiło, że obserwują wyższe wskaźniki CDAD, cięższe CDAD i więcej nawracających CDAD niż w przeszłości. Istnieje ogólne wrażenie, że nastąpił wzrost odsetka przypadków z ciężkimi i śmiertelnymi powikłaniami oraz wzrost wskaźnika nawrotów wśród pacjentów dotkniętych chorobą.
Oprócz zachorowalności i śmiertelności, obciążenie ekonomiczne związane z zakażeniem C. difficile w postaci opóźnienia wypisu ze szpitala i innych kosztów szpitalnych jest znaczne.
Epidemiologia
Częstotliwość i zapadalność na CDAD jest różna w różnych szpitalach i w obrębie danej instytucji w czasie. Ryzyko zachorowania wzrasta u pacjentów narażonych na działanie antybiotyków, poddawanych zabiegom chirurgicznym w obrębie przewodu pokarmowego, przebywających coraz dłużej w placówkach opieki zdrowotnej, cierpiących na poważne choroby podstawowe, mających obniżoną odporność i w zaawansowanym wieku.
C. difficile jest rozsiewana z kałem. Każda powierzchnia, urządzenie lub materiał (np. komoda, wanna, elektroniczny termometr doodbytniczy), które uległy zanieczyszczeniu odchodami, mogą stanowić rezerwuar dla przetrwalników C. difficile. Zarodniki przenoszone są na pacjentów głównie przez ręce personelu medycznego, który dotknął skażonej powierzchni lub przedmiotu (2-6).
 click for large version
click for large version
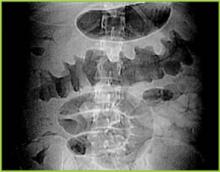
Figure 1 . Cyfrowy radiogram z tomografii komputerowej pokazuje guzkowe zgrubienie w okrężnicy poprzecznej.
The Organism and Pathophysiology of C. difficile Diarrhea
C. difficile jest gram-dodatnią, beztlenową, przetrwalnikującą pałeczką, która jest odpowiedzialna za rozwój biegunki związanej z antybiotykami i zapalenia jelita grubego. C. difficile została po raz pierwszy opisana w 1935 roku jako składnik flory kałowej zdrowych noworodków i początkowo nie była uważana za patogenną (7). Bakteria ta otrzymała nazwę difficile, ponieważ rośnie powoli i jest trudna do wyhodowania. C. difficile jest obecnie odpowiedzialna za prawie wszystkie przyczyny rzekomobłoniastego zapalenia jelita grubego i aż za 20% przypadków biegunki związanej z antybiotykami bez zapalenia jelita grubego. Chociaż występuje w stolcu tylko u 5% populacji ogólnej, aż 21% dorosłych ulega kolonizacji tym drobnoustrojem podczas hospitalizacji (2,6).
Zmiany w prawidłowej mikroflorze jelita grubego, zwykle spowodowane antybiotykoterapią, są głównym czynnikiem predysponującym do zakażenia C. difficile. Prawie wszystkie antybiotyki mają związek z biegunką i zapaleniem jelita grubego wywołanym przez C. difficile. Do najczęściej stosowanych antybiotyków należą klindamycyna, cefalosporyny, ampicylina i amoksycylina (tabela 1) (8).
Oprócz antybiotykoterapii, ważnym czynnikiem ryzyka zakażenia C. difficile jest starszy wiek i ciężkość choroby podstawowej. Inne czynniki ryzyka obejmują obecność zgłębnika nosowo-żołądkowego, zabiegi żołądkowo-jelitowe, przyjmowanie kwaśnych leków antysekrecyjnych, pobyt na oddziale intensywnej terapii i czas trwania hospitalizacji (9).
Biegunka wywołana przez C. difficile jest spowodowana głównie przez toksyny A i B wytwarzane przez bakterie namnażające się w świetle jelita. Toksyny te wiążą się z błoną śluzową jelita grubego i wywierają na nią szkodliwy wpływ. Organizm ten rzadko uszkadza okrężnicę poprzez bezpośrednią inwazję, a biegunka jest spowodowana działaniem toksyn produkowanych w świetle jelita, które przylegają do powierzchni błony śluzowej. Większość izolatów toksynotwórczych wytwarza obie toksyny, a około 5-25% izolatów nie wytwarza ani toksyny A ani B i nie powoduje zapalenia jelita grubego ani biegunki (3-5).
Manifestacje kliniczne
Zakażenie C. difficile może powodować szeroki zakres objawów klinicznych, w tym bezobjawowe nosicielstwo, łagodną lub umiarkowaną biegunkę oraz piorunującą postać choroby z rzekomobłoniastym zapaleniem jelita grubego (10). U pacjentów, u których rozwinie się CDAD, objawy zwykle zaczynają się wkrótce po kolonizacji. Kolonizacja może wystąpić w trakcie leczenia antybiotykami lub do kilku tygodni po zakończeniu kursu antybiotyków. CDAD zazwyczaj wiąże się z częstymi, luźnymi wypróżnieniami, co jest charakterystyczne dla zapalenia odbytnicy. Może pojawić się śluz lub krew utajona, ale rzadko występuje widoczna krew.
Diagnoza
Diagnoza CDAD opiera się na wywiadzie dotyczącym niedawnej lub obecnej antybiotykoterapii, pojawieniu się biegunki lub innych objawów ostrego zapalenia jelita grubego oraz wykazaniu zakażenia toksynotwórczym C. difficile, zwykle poprzez wykrycie toksyny A lub toksyny B w próbce stolca.
 kliknij, aby powiększyć
kliknij, aby powiększyć
Rycina 1 . Cyfrowy radiogram z tomografii komputerowej pokazuje guzkowe zgrubienie w okrężnicy poprzecznej.
Practical Guidelines for Diagnosis of C. difficile Diarrheal Syndromes
- Diagnostykę należy podejrzewać u każdej osoby z biegunką, która otrzymywała antybiotyki w ciągu ostatnich 2 miesięcy i/lub u której biegunka rozpoczęła się 72 godziny lub więcej po hospitalizacji.
- W przypadku podejrzenia diagnozy, pojedyncza próbka stolca powinna zostać wysłana do laboratorium w celu zbadania na obecność C. difficile i/lub jej toksyn.
- Jeśli biegunka utrzymuje się pomimo ujemnego wyniku badania na obecność toksyn w stolcu, jedna lub dwie dodatkowe próbki mogą zostać wysłane do badania przy użyciu tych samych lub innych testów (4). Endoskopia jest zarezerwowana dla sytuacji szczególnych, takich jak: gdy potrzebna jest szybka diagnoza, a wyniki badań są opóźnione lub test nie jest wysoce czuły, gdy pacjent ma niedrożność jelit, a stolec nie jest dostępny, lub gdy inne choroby jelita grubego są również brane pod uwagę.
Jak dotąd nie ma prostego, niedrogiego, szybkiego, czułego i specyficznego testu do diagnozowania biegunki wywołanej C. difficile, ani też wszystkie dostępne testy nie są odpowiednie do zastosowania w każdym laboratorium (Tabela 2) (11).
Endoskopowa diagnostyka biegunki wywołanej przez C. difficile i zapalenia jelita grubego
Sigmoidoskopia i kolonoskopia nie są wskazane u większości pacjentów z CDAD (10,12). Endoskopia jest jednak pomocna w szczególnych sytuacjach, np. gdy rozpoznanie jest wątpliwe lub sytuacja kliniczna wymaga szybkiej diagnostyki. Wyniki badań endoskopowych mogą być prawidłowe u pacjentów z łagodną biegunką lub mogą wykazywać niespecyficzne zapalenie jelita grubego w umiarkowanych przypadkach. Stwierdzenie pseudomembran w okrężnicy u pacjenta z biegunką związaną z antybiotykami jest praktycznie patognomoniczne dla zapalenia jelita grubego wywołanego przez C. difficile. U kilku pacjentów bez żadnych cech diagnostycznych w odbytnicy występują pseudobłoniaste błony w bardziej proksymalnych częściach okrężnicy (13). Inne wyniki badań endoskopowych obejmują rumień, obrzęk, kruchość i niespecyficzne zapalenie jelita grubego z małymi owrzodzeniami lub nadżerkami.
Leczenie
Pierwszym krokiem w leczeniu biegunki i zapalenia jelita grubego wywołanych przez C. difficile jest odstawienie antybiotyków, jeśli to możliwe (10,12). Biegunka ustępuje u około 15-25% pacjentów bez stosowania specyficznej terapii przeciwko C. difficile (14,15). Samo postępowanie zachowawcze może jednak nie być wskazane u pacjentów z chorobami ogólnoustrojowymi lub z licznymi problemami medycznymi, ponieważ trudno jest przewidzieć, u których pacjentów nastąpi samoistna poprawa. Jeśli nie jest możliwe odstawienie antybiotyku wywołującego chorobę ze względu na inne aktywne zakażenia, należy w miarę możliwości zmienić schemat antybiotykoterapii pacjenta, aby zastosować środki, które rzadziej wywołują CDAD (np, aminoglikozydy, trimetoprim, ryfampina lub chinolony).
Należy unikać stosowania środków antyperystaltycznych, takich jak difenoksylat plus atropina (Lomotil) lub loperamid (Imodium) oraz narkotycznych leków przeciwbólowych, ponieważ mogą one opóźniać usuwanie toksyn z jelita grubego, a tym samym nasilać uszkodzenie jelita grubego wywołane przez toksyny lub przyspieszać wystąpienie niedrożności jelit i toksycznego rozszerzenia (12,16). U pacjentów z początkowo ciężkimi objawami oraz u pacjentów, u których objawy utrzymują się pomimo przerwania leczenia antybiotykami, należy zastosować specyficzną terapię w celu eradykacji C. difficile. Chociaż rozpoznanie zapalenia jelita grubego wywołanego przez C. difficile powinno być ustalone przed wdrożeniem terapii przeciwdrobnoustrojowej, aktualne wytyczne ACG zalecają rozpoczęcie terapii empirycznej w wysoce sugerujących przypadkach u ciężko chorych pacjentów (Tabela 3 na stronie 54) (12).
Obecnie, doustna wankomycyna lub metronidazol, stosowane przez 7 do 10 dni, są uważane za terapię pierwszego rzutu przez większość autorów i aktualne wytyczne. Metronidazol w dawce 250 mg 4 razy dziennie jest zalecany przez większość autorów i wytycznych ACG jako lek z wyboru w początkowym leczeniu zapalenia jelita grubego wywołanego przez C. difficile (12). Zalecenia te opierają się w dużej mierze na skuteczności, niższych kosztach i obawach związanych z rozwojem szczepów opornych na wankomycynę. Główne wady metronidazolu obejmują mniej pożądany profil farmakologiczny oraz przeciwwskazania do stosowania u dzieci i kobiet w ciąży.
Wankomycyna, z drugiej strony, w dawce 125 mg 4 razy dziennie, jest bezpieczna i dobrze tolerowana oraz osiąga w stolcu stężenie 20 razy większe niż wymagane minimalne stężenie hamujące w leczeniu C. difficile. Wadami stosowania wankomycyny są koszty i potencjalny rozwój szczepów opornych na wankomycynę. Według aktualnych wytycznych ACG wankomycyna jest lekiem z wyboru u ciężko chorych pacjentów oraz w przypadkach, w których stosowanie metronidazolu jest wykluczone.
Brakuje kontrolowanych badań klinicznych dotyczących pacjentów z piorunującym zapaleniem jelita grubego, którzy nie tolerują leczenia doustnego. Podawanie metronidazolu dożylnie lub podawanie wankomycyny przez zgłębnik nosowo-żołądkowy lub lewatywę doodbytniczą zostało opisane w małych seriach przypadków (17-20). Nie zaleca się dożylnego podawania wankomycyny, ponieważ lek ten nie jest wydalany w jelicie grubym (17).
Zarządzanie nawracającą biegunką wywołaną C. difficile
Mimo skutecznego początkowego leczenia CDAD, u 15-20% pacjentów dochodzi do nawrotu biegunki w związku z dodatnim wynikiem badania kału na obecność toksyny C. difficile. Nawrót objawów jest rzadko spowodowany niepowodzeniem leczenia lub opornością na metronidazol lub wankomycynę. Metody postępowania obejmują leczenie zachowawcze (jednak wielu pacjentów jest w podeszłym wieku, niedołężnych i nie toleruje biegunki), leczenie specyficznymi antybiotykami przeciw C. difficile, stosowanie żywic wiążących aniony, leczenie mikroorganizmami (probiotyki) oraz leczenie immunoglobulinami.
Najczęstszą metodą leczenia nawracającej biegunki wywołanej przez C. difficile jest drugi kurs tego samego antybiotyku, który był stosowany w leczeniu pierwszego epizodu choroby (12). W dużym badaniu obserwacyjnym przeprowadzonym w Stanach Zjednoczonych, 92% pacjentów z nawracającą CDAD odpowiedziało pozytywnie na pojedynczy, powtórzony kurs leczenia, zwykle z użyciem metronidazolu lub wankomycyny (14). Istnieją dowody wskazujące na to, że u pacjentów z nawrotami w wywiadzie istnieje wysokie ryzyko wystąpienia kolejnych epizodów CDAD po przerwaniu antybiotykoterapii. Nie ma danych wskazujących na to, że kolejne epizody stają się stopniowo coraz cięższe lub bardziej skomplikowane (21). Zaproponowano różne schematy leczenia pacjentów z licznymi nawrotami biegunki wywołanej przez C. difficile. Jednym z nich jest podawanie przedłużonego kursu wankomycyny (lub metronidazolu) w schemacie malejących dawek, a następnie terapia pulsacyjna (tabela 4).
Cholestyramina, żywica anionowymienna podawana w dawce 4 gramów 3 lub 4 razy dziennie przez okres od 1 do 2 tygodni, wiąże toksyny C. difficile i może być stosowana w połączeniu z antybiotykami w leczeniu powtarzających się nawrotów. Ponieważ cholestyramina może wiązać wankomycynę, jak również toksyny, powinna być podawana w odstępie co najmniej 2-3 godzin od wankomycyny.
Szerokie zapalenie jelita grubego wywołane przez C. difficile
Zgłaszana częstość występowania piorunującego zapalenia jelita grubego wywołanego przez C. difficile wynosi 1,6-3,2% (22). Chociaż brak jest dokładnych danych z innych ośrodków, uważa się, że jest to coraz częstsza przyczyna powikłań i zgonów. Zespół kliniczny piorunującego zapalenia jelita grubego wywołanego przez C. difficile można rozpoznać dzięki odpowiedniej znajomości spektrum objawów choroby.
A. Biegunka: Chociaż biegunka jest cechą charakterystyczną zapalenia jelita grubego wywołanego przez C. difficile, nie jest ona niezmiennie obecna, a jej brak może prowadzić do pomyłek diagnostycznych. Jeżeli biegunka nie występuje, wydaje się, że jest ona wtórna do poważnych zaburzeń motoryki okrężnicy. Nawet jeśli jest obecna, biegunka może być postrzegana jako pomniejszy element nieswoistego obrazu septycznego.
 Przedrukowano za zgodą z BUMC Proceedings 1999; 12:249-250
Przedrukowano za zgodą z BUMC Proceedings 1999; 12:249-250
Rycina 1 . Cyfrowy radiogram z tomografii komputerowej pokazuje guzkowe zgrubienie haustalne w okrężnicy poprzecznej.
 Przedrukowano za zgodą BUMC Proceedings 1999; 12:249-250
Przedrukowano za zgodą BUMC Proceedings 1999; 12:249-250
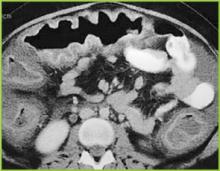
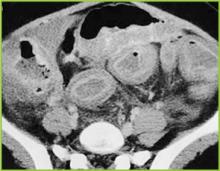
Ryc. 2 . Obraz TK górnej części brzucha potwierdza wyraźne zgrubienie haustralne w okrężnicy poprzecznej.
 Reprinted with permission from BUMC Proceedings 1999; 12:249-250
Reprinted with permission from BUMC Proceedings 1999; 12:249-250
Figure 3 . Obraz TK śródbrzusza wykazuje wyraźne pogrubienie całej okrężnicy. Łagodne zmiany zapalne są obecne w tłuszczu okołonerkowym.
B. Ciężka choroba: Pełnoobjawowe zapalenie jelita grubego jest nietypową postacią zakażenia C. difficile, występującą jedynie u 3% pacjentów, ale będącą przyczyną praktycznie wszystkich poważnych powikłań. Pacjenci z cięższymi postaciami choroby mogą występować z biegunką lub bez niej. Jeżeli u pacjentów rozwinie się zapalenie jelita grubego zlokalizowane w kątnicy i prawej części okrężnicy, biegunka może być minimalna lub może w ogóle nie wystąpić. W przypadku braku biegunki, jedyną wskazówką do postawienia diagnozy mogą być ogólnoustrojowe objawy toksyczności (gorączka, tachykardia, leukocytoza i/lub zmniejszenie objętości ciała).
Podwyższona liczba białych krwinek może być ważnym wskaźnikiem zbliżającego się piorunującego zapalenia jelita grubego wywołanego przez C. difficile. Szybki wzrost liczby białych krwinek na obwodzie (zwykle do 30 000 – 50 000) ze znacznym nadmiarem pasm i czasami bardziej niedojrzałych form często poprzedza niestabilność hemodynamiczną i rozwój dysfunkcji narządów. Nawet u pacjentów, którzy przez dłuższy czas mają łagodne objawy, może dojść do nagłej i niespodziewanej progresji do wstrząsu. Trudno jest przewidzieć, którzy pacjenci mogą nie reagować na leczenie. Dlatego też wczesne objawy ostrzegawcze, takie jak reakcja leukemiczna, mogą być nieocenione.
Nadciśnienie tętnicze jest późnym objawem i może być oporne na leczenie wazopresorami. Objawy ze strony jamy brzusznej wahają się od zniekształcenia do uogólnionej tkliwości z czujnością. Perforacji jelita grubego zwykle towarzyszy sztywność brzucha, mimowolne stróżowanie, tkliwość z odbicia i brak odgłosów jelitowych. Na radiogramach jamy brzusznej może być widoczne wolne powietrze. Każde podejrzenie perforacji w tym przypadku powinno skłonić do natychmiastowej konsultacji chirurgicznej. Śmierć na ogół następuje przed pojawieniem się wolnego powietrza i perforacji. W jednym badaniu, w przeciwieństwie do większości pozostałej literatury, perforację stwierdzono rzadko (22).
Radiografia jamy brzusznej może ujawnić poszerzoną okrężnicę (>7 cm największej średnicy), zgodną z toksycznym megacolon. Pacjenci z megacolon mogą mieć powiązany niedrożność jelita cienkiego z poszerzonym jelitem cienkim na zwykłym zdjęciu radiologicznym jamy brzusznej, z poziomem powietrza i płynu imitującym niedrożność lub niedokrwienie jelita cienkiego. Tomografia komputerowa bez kontrastu i endoskopia mogą szybko zdiagnozować lub przynajmniej silnie zasugerować piorunujące zapalenie jelita grubego wywołane przez C.difficile. Wyniki tomografii komputerowej wskazują na obecność wodobrzusza, pogrubienie ściany okrężnicy i/lub jej poszerzenie. Wyniki te mogą być pomocne w określeniu stopnia ciężkości zapalenia jelita grubego.
Bardziej agresywna interwencja u pacjentów nieodpowiadających na leczenie, w tym szybka identyfikacja pacjentów nieodpowiadających na leczenie, jest kluczowa dla uzyskania pozytywnego wyniku, a w tej grupie pacjentów należy przeprowadzić wczesną interwencję chirurgiczną (ryc. 1-3).
Ważne jest, aby wszystkie osoby zaangażowane w opiekę nad pacjentami w szpitalach, domach opieki i zakładach opiekuńczych posiadały wiedzę na temat organizmu i jego epidemiologii, racjonalnego podejścia do leczenia i opieki nad pacjentami z biegunką wywołaną przez C. difficile. difficile, znaczenia mycia rąk przy każdym kontakcie z pacjentem, używania rękawiczek podczas opieki nad pacjentem z biegunką wywołaną przez C. difficile oraz unikania niepotrzebnego stosowania środków przeciwdrobnoustrojowych.
Podsumowanie
W ostatnich latach pojawiły się obawy związane z rosnącą częstością występowania i liczbą poważnych powikłań CDAD w szpitalach Ameryki Północnej (22,23). Czasopismo Canadian Medical Association opublikowało w 2004 roku raport opisujący epidemię CDAD obejmującą kilka szpitali w Montrealu. Jako możliwą przyczynę wybuchu epidemii podaje się wprowadzenie nowych, hiperwirulentnych i wysoce zakaźnych szczepów C. difficile (24). Uznano, że pogarszająca się infrastruktura, nieodpowiednie praktyki kontroli zakażeń, rosnąca liczba osłabionych pacjentów, starzejąca się populacja i hiperwirulentne szczepy mogą przyczynić się do wybuchu ostatnich epidemii w Kanadzie (25).
Dwa dochodzenia epidemiologiczne w Stanach Zjednoczonych i Kanadzie (24,26) niezależnie zbadały próbki C. difficile i stwierdziły, że zmutowana wersja „dzikiego” szczepu jest odpowiedzialna za wybuchy epidemii w Quebecu i zwiększoną liczbę przypadków CDAD w szpitalach w Stanach Zjednoczonych w ostatnim czasie (22,23). Epidemiolodzy kliniczni z CDC zbadali izolaty C. difficile ze szpitali w Stanach Zjednoczonych, w których ostatnio (tj. w latach 2001-2004) wystąpiły ogniska CDAD (22,23). Raport wskazuje na pojawienie się nowego szczepu epidemicznego, „BI” (różniącego się od szczepu „J” z lat 1989-1992), który może być odpowiedzialny za niedawny wzrost częstości występowania i widocznej ciężkości CDAD (26).
CDAD i zapalenie jelita grubego w większości przypadków można leczyć podając metronidazol lub wankomycynę. U niektórych pacjentów, mimo odpowiedniego i odpowiednio wczesnego leczenia, dochodzi do rozwoju ciężkiej, zagrażającej życiu toksyczności i konieczna jest interwencja chirurgiczna. Według doniesień, ogólnoustrojowe objawy zakażenia C. difficile nie są wynikiem bakteriemii, perforacji okrężnicy lub niedokrwienia, ale wywołanych przez toksyny mediatorów zapalnych uwalnianych z okrężnicy (27-29). W opornych na leczenie przypadkach ciężkiej choroby należy zastosować wczesną interwencję chirurgiczną. Interwencja chirurgiczna jest jednak daleka od ideału, niesie ze sobą bardzo wysoki odsetek powikłań i znaczne ryzyko śmiertelności (22). Przyszłe podejście kliniczne do leczenia szpitalnego zapalenia jelita grubego wywołanego przez C. difficile może ostatecznie obejmować specyficzne hiperimmunoglobuliny antytoksynowe i inhibitory kaskady zapalnej (28,30,31).
- Archibald LK, Banerjee SN, Jarvis WR. Secular trend in hospital-acquired Clostridium difficile disease in the United States; 1987-2001. J Infect Dis. 2004;189:1585-9.
- Fekety R. Antibiotic-associated colitis. In: Mandell G, Bennet JE, Dolin R, eds. Principles and Practice of Infectious Diseases. 4th ed. New York: Churchill Livingston; 1996:978-806.
- Mitty RD, LaMont T. Clostridium difficile diarrhea: Pathogenesis, epidemiology, and treatment. Gastroenterologist. 1994;2:61-9.
- Bartlett JG. Clostridium difficile: Historia jego roli jako patogenu jelitowego i obecny stan wiedzy na temat tego organizmu. Clin Infect Dis. 1994;18(Suppl 4):265-72.
- Johnson S, Gerding D. Clostridium difficile. In: Mayhall CG, ed. Hospital Epidemiology and Infection Control. Baltimore, Md: Williams & Wilkins; 1996:99-408.
- Mcfarland LV, Mulligan ME, Kwok RY, Stamm WE. Nosocomial acquisition of Clostridium difficile. N Engl J Med. 1989;320:204-10.
- Hall IC, O Toole E. Intestinal Flora in new-born infants: With a description of a new pathogenic anaerobe, Bacillus difficile. Am J Dis Child. 1935;49:390-402.
- Kelly CP, LaMont JT. Treatment of Clostridium difficile diarrhea and colitis. In: Wolfe MM, ed. Gastrointestinal Pharmacotherapy. Philadelphia, Pa.: WB Saunders; 1993:199-212.
- Bignardi GE. Risk factors for Clostridium difficile infection. J Hosp Infect. 1998;40:1-15.
- Kelly CP, Pothoulakas C, LaMont JT. Clostridium difficile colitis. N Engl J Med. 1994;330:257-62.
- Linevsky JK, Kelly CP. Clostridium difficile colitis. In: Lamont JT, ed. Gastrointestinal Infections: Diagnosis and Management. New York: Marcel Dekker; 1997:293-325.
- Fekety R. Guidelines for the diagnosis and management of Clostridium difficile associated diarrhea and colitis. American College of Gastroenetrology, Practice Parameters Committee. Am J Gastroenterol. 1997;92:739-50.
- Tedesco FJ, Corless JK, Brownstein RE. Rectal sparing in antibiotic-associated pseudomembranous colitis: A prospective study. Gastroenterology. 1982;83:1259-60.
- Olson MM, Shanholtzer CJ, Lee JT Jr, Gerding DN. Ten years of prospective Clostridium difficile-associated disease surveillance and treatment at the Minneapolis VA Medical Center, 1982-1991. Infect Control Hosp Epidemiol. 1994;15: 371-81.
- Teasley DG, Gerding DN, Olson MM, et al. Prospektywne randomizowane badanie metronidazolu w porównaniu z wankomycyną w przypadku biegunki i zapalenia jelita grubego związanego z Clostridium-difficile. Lancet. 1983;2:1043-6.
- Walley T, Milson D. Loperamide-related toxic megacolon in Clostridium difficile colitis. Postgrad Med J. 1990;66:582.
- Malnick SD, Zimhony O. Treatment of Clostridium difficile associated diarrhea. Ann Pharmacother. 2002;36:1767-75.
- Sehgal M, Kyne L. Clostridium difficile disease. Curr Treatment Options Infect Dis. 2002;4:201-10.
- Apisarnthanarak A, Razavi B, Mundy LM. Adjunctive intracolonic vancomycin for severe Clostridium difficile colitis: case series and review of the literature. Clin Infect Dis. 2002;35:690-6.
- Friendenberg F, Fernandez A, Kaul V, Niami P, Levine GM. Intravenous metronidazole for the treatment of Clostridium difficile colitis. Dis Colon Rectum. 2001;44:1176-80.
- Fekety R, McFarland LV, Surawicz CMGreenberg, RN, Elmer GW, Mulligan ME. Recurrent Clostridium difficile diarrhea: characteristics of and risk factors for patients enrolled in a prospective, randomized, double-blind trial. Clin Infect Dis. 1997;24:324-33.
- Dallal RM, Harbrecht BG, Boujoukas AJ, et al. Fulminant Clostridium difficile: an underappreciated and increasing cause of death and complications. Ann Surg. 2002;235:363-72.
- Morris AM, Jobe BA, Sontey, M, Sheppard BC, Deveney CW, Deveney KE. Clostridium difficile colitis: coraz bardziej agresywna choroba jatrogenna? Arch Surg. 2002;137:1096-100.
- Eggerston L, Sibbald B. Hospitals battling outbreaks of C. difficile. CMAJ. 2004;171:19-21.
- Valiquette L, Low DE, Pepin J, McGeer A. Clostridium difficile infection in hospitals: a brewing storm. CMAJ. 2004;171:27-9.
- McDonald LC, Killgore GE, Thompson A, et al. Emergence of an epidemic strain of Clostridium difficile in the United States, 2001-4: Potential role for virulence factors and antimicrobial resistance traits. Infectious Diseases Society of America 42th Annual Meeting. Boston, MA, 30 września – 3 października 2004. Abstrakt # LB-2.
- Flegel W, Muller F, Daubener W, Fischer HG, Hadding U, Northoff H. Cytokine response by human monocytes to Clostridium difficile toxin A and toxin B. Infect Immun. 1991;59:3659-66.
- Castagliuolo I, Keates A, Qiu B, et al. Increased substance P responses in dorsal root ganglia, intestinal macrophages during Clostridium difficile toxin A enteritis in rats. Proc Natl Acad Sci U S A. 1997;94:4788-93.
- Castagliuolo I, Keates A, Wang C, et al. Clostridium difficile toxin A stimulates macrophage-inflammatory protein-2 production in rat intestinal epithelial cells. J Immunol. 1998;160:6039-45.
- Kelly C, Chetham S, Keates S, et al. Survival of anti-Clostridium difficile bovine immunoglobulin concentrate in the human gastrointestinal tract. Antimicrob Agents Chemother. 1997;41:236-41.
- Salcedo J, Keates S, Pothoulakis C, et. al. Intravenous immunoglobulin therapy for severe Clostridium difficile colitis. Gut. 1997;41:366-70.