Stereochemia triacylogliceroli/fosfolipidów
Glicerol jest achiralną cząsteczką, ponieważ C2 ma dwa identyczne podstawniki, -CH2OH. Glicerol w organizmie może być chemicznie przekształcany do triacylogliceroli i fosfolipidów (PL), które są chiralne i które występują w jednej enancjomerycznej formie. Jak to możliwe, skoro dwie grupy CH2OH na glicerolu są identyczne? Okazuje się, że mimo iż grupy te są stereochemicznie równoważne, możemy je rozróżnić w następujący sposób. Ustawiamy glicerol tak, aby OH na C2 była skierowana w lewo. Następnie zastąp OH na C1 przez OD, gdzie D jest deuterem. Teraz dwa podstawniki alkoholowe na C1 i C3 nie są identyczne i otrzymana cząsteczka jest chiralna. Obracając cząsteczkę tak, aby H na C2 było skierowane do tyłu i przypisując priorytety pozostałym podstawnikom na C2 w następujący sposób: OH =1, DOCH2 =2, i CH2OH = 3, można zauważyć, że powstała cząsteczka jest w konfiguracji S. Stąd mówimy, że C1 jest węglem proS. Podobnie, jeśli zastąpimy OH na C3 przez OD, utworzymy enancjomer R. Stąd mówimy, że C3 jest węglem proR. Stąd C3 jest węglem proR. To pokazuje, że w rzeczywistości możemy rozróżnić dwa identyczne podstawniki CH2OH. Mówimy, że glicerol nie jest chiralny, ale prochiralny. (Pomyśl o tym, że glicerol ma potencjał, aby stać się chiralny poprzez modyfikację jednego z dwóch identycznych podstawników.)
Rysunek: Glycerol – A prochiral molecule
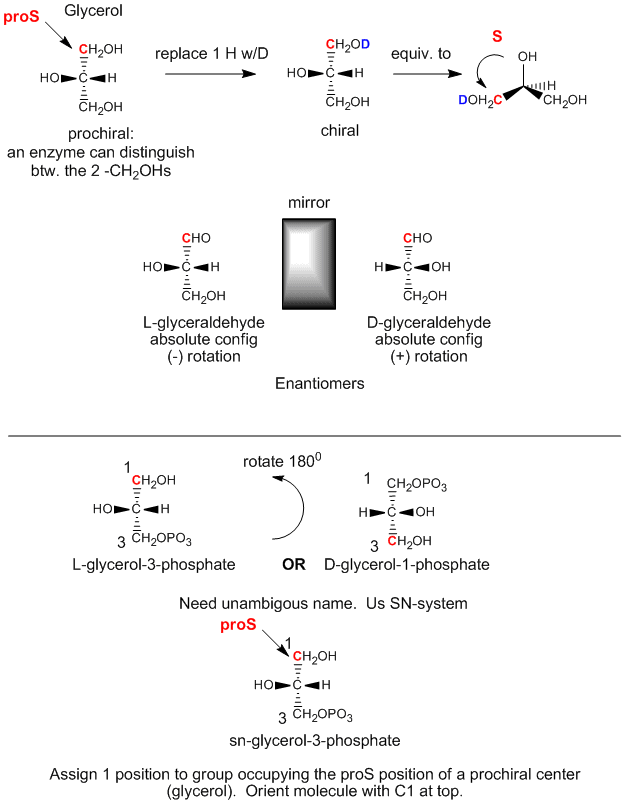
Możemy odnieść konfigurację glicerolu powyżej, (gdy OH na C2 jest skierowany w lewo) do konfiguracji absolutnej L-gliceraldehydu, cukru prostego (polihydroksyaldehydu lub ketonu), innej pochodnej 3C glicerolu. Cząsteczka ta jest chiralna z OH na C2 (jedyny chiralny węgiel) skierowanym w lewo. Łatwo zapamiętać, że każdy cukier L ma OH na ostatnim chiralnym węglu skierowany w lewo. Enancjomer (izomer lustrzanego odbicia) L-gliceraldehydu to D-gliceraldehyd, w którym OH na C2 wskazuje w prawo. Biochemicy używają L i D dla stereochemii lipidów, cukrów i aminokwasów, zamiast nomenklatury R,S używanej w chemii organicznej. Stereochemiczne oznaczenie wszystkich cukrów, aminokwasów i glicerolipidów można określić na podstawie konfiguracji bezwzględnej L- i D-gliceraldehydu.
Pierwszy krok w syntezie in vivo (w organizmie) chiralnych pochodnych z achiralnego glicerolu obejmuje fosforylację OH na C3 przez ATP (bezwodnik fosforowy podobny w strukturze do bezwodnika octowego, doskonały środek acetylujący) w celu wytworzenia chiralnej cząsteczki fosforanu glicerolu. Opierając się na konfiguracji absolutnej L-gliceraldehydu i wykorzystując to do narysowania glicerolu (z OH na C2 skierowanym w lewo), widzimy, że fosforylowana cząsteczka może być nazwana L-glicerolo-3-fosforanem. Natomiast obracając tę cząsteczkę o 180 stopni, bez zmiany stereochemii cząsteczki, wcale nie zmieniamy cząsteczki, ale stosując powyższą nomenklaturę D/L, nazwalibyśmy obróconą cząsteczkę jako D-glicerol-1-fosforan. Nie możemy nadać tej samej cząsteczce dwóch różnych nazw. Dlatego biochemicy opracowali system numeracji stereospecyficznej (sn), który przypisuje pozycję 1 w cząsteczce prochiralnej grupie zajmującej pozycję proS. Stosując tę nomenklaturę widzimy, że opisana powyżej chiralna cząsteczka, fosforan glicerolu, może być jednoznacznie nazwana sn-glicerol-3-fosforan. Podstawnik hydroksylowy na węglu proR został ufosforylowany.
Rysunek: Biologiczna synteza triacylogliceroli i kwasu fosfatydowego z prochiralnego glicerolu
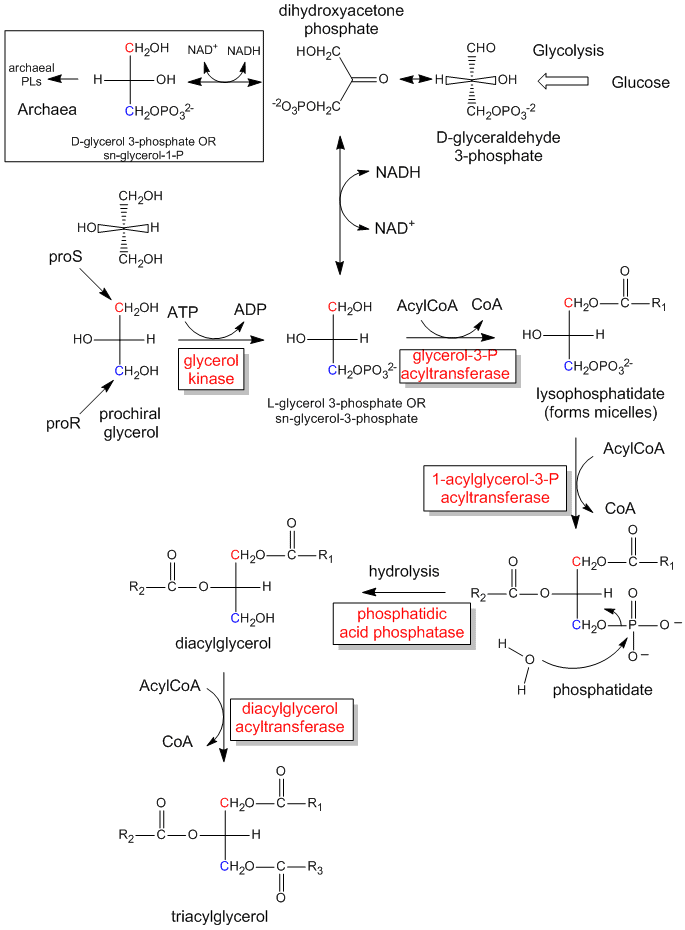
Fosforylacja enzymatyczna prochiralnego glicerolu na OH węgla proR w celu utworzenia sn-glicerol-3-fosforanu jest zilustrowana w poniższym linku. Jak byliśmy w stanie rozróżnić 2 identyczne podstawniki CH2OH jako zawierające albo proS lub proR węgli, więc może enzym. Enzym może rozróżnić identyczne podstawniki na cząsteczce prochiralnej, jeśli cząsteczka prochiralna oddziałuje z enzymem w trzech punktach. Innym przykładem prochiralnego układu reagent/enzym jest utlenianie prochiralnej cząsteczki etanolu przez enzym dehydrogenazę alkoholową, w którym tylko proR H z 2 H na C2 jest usuwany. (Omówimy to później.)
Rysunek: W jaki sposób enzym (kinaza glicerolowa) przenosi PO4 z ATP na proR CH2OH glicerolu przy tworzeniu chiralnych triacylogliceroli i kwasu fosfatydowego.
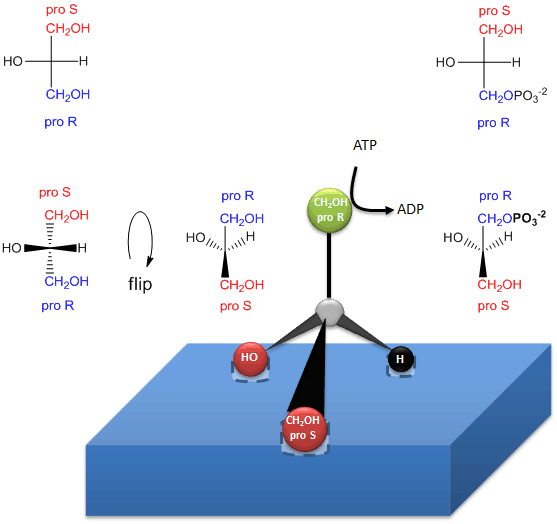
.