Ścieżka apoptozy perforyna/granzym jest podstawową ścieżką sygnalizacyjną używaną przez limfocyty cytotoksyczne do eliminacji komórek zainfekowanych wirusem i/lub transformowanych. Badania na myszach z uszkodzonym genem wskazują, że perforina, w połączeniu z granzymem, może indukować apoptozę. Jest ona niezbędna dla cytotoksycznej funkcji efektorowej i ma niezbędną, ale nieokreśloną rolę w apoptozie wywołanej przez granzym.
Perforyna i granzym
Perforyna jest białkiem tworzącym pory, znanym również jako toksyny ziarnistości cytoplazmatycznych. Granzym jest rodziną strukturalnie powiązanych proteaz serynowych przechowywanych w ziarnistościach cytotoksycznych limfocytów cytotoksycznych (CLs). Perforyna i granzym indukują apoptozę komórek docelowych we współpracy (Rycina 1). Granzym jest niezbędny do wywołania apoptozy komórek docelowych, ale zależy to od odpowiedniego dostarczenia go przez perforynę. Zarówno perforina, jak i granzym wiążą się z powierzchnią komórki docelowej jako część pojedynczego kompleksu wielkocząsteczkowego związanego z serglicyną, co dodatkowo zmniejsza prawdopodobieństwo biernej dyfuzji granzymów.
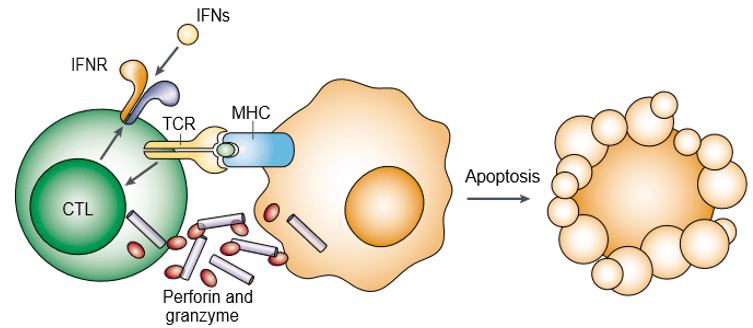
Rysunek 1. Perforin and granzyme induce target-cell apoptosis cooperatively.
In humans, there are granzyme A, B, H, K, and M, while in mice there are granzyme A, B, C, D, E, F, G, K, L, M, and N. Granzyme A (GrA) and granzyme B (GrB) are the most abundant granzymes and have been the most studied. Funkcje granzymów A i B w indukowaniu apoptozy komórek docelowych zostały dokładnie zbadane in vitro i są lepiej poznane niż rola perforyny na poziomie molekularnym.
Process and Regulation of Perforin/Granzyme Apoptosis Pathway
Po wydzieleniu przez limfocyty cytotoksyczne, granzymy dostają się do komórek docelowych, co jest istotnym krokiem w śmierci komórki. Głównymi białkami litycznymi pakowanymi w granulki są różne granzymy oraz białko tworzące pory – perforyna, która ułatwia internalizację granzymów przez komórki.
Granzym B głównie wyzwala aktywację kaspaz w sposób pośredni, a nie poprzez bezpośrednie przetwarzanie kaspaz. Osiąga to poprzez bezpośrednią aktywację pro-apoptotycznych „BH3-only” członków rodziny BCL-2, takich jak agonista śmierci domeny BH3-interacting (Bid). Bid wraz z pro-apoptotycznymi białkami BCL-2 z rodziny Bax i/lub Bak powoduje wyciek pro-apoptotycznych mediatorów mitochondrialnych, takich jak cytochrom c, do cytozolu. Uwolnienie cytochromu c aktywuje kaspazę pro-9, a poprzez wiązanie się z czynnikiem aktywującym proteazę apoptotyczną 1(Apaf-1), kaspaza pro-9 przekształca się w dojrzałą kaspazę-9, która dalej tworzy apoptosom i aktywuje kaspazę-3. Aktywowana kaspaza-3 jest zdolna do rozszczepiania specyficznych substratów, takich jak ICAD (inhibitor DNazy aktywowanej przez kaspazę, CAD), co pozwala na translokację CAD do jądra komórkowego w celu fragmentacji DNA. Oprócz Bid, granzym B może inaktywować Mcl-1, który jest członkiem anty-apoptotycznej rodziny Bcl-2, aby uwolnić pro-anty-apoptotyczne białko rodziny Bcl-2 Bim na zewnętrznej błonie mitochondrialnej. I granzym B może również pośredniczyć efektor kaspazy-3 i inicjator kaspazy-8 do regulacji ścieżki apoptozy.
Kontrast do granzymu B, granzym M nie zależy od mitochondriów do regulacji, ale granzym M może aktywować granzym B przez rozszczepienie inhibitora proteazy 9 (PI-9), który jest inhibitorem granzymu B. Granzym M może również bezpośrednio rozszczepić ICAD, aby uwolnić CAD jak granzym B.
Granzym A indukuje utratę potencjału wewnętrznej błony mitochondrialnej i uwolnienie reaktywnych form tlenu (ROS). Generuje jednoniciowe nici DNA, a nie oligonukleosomalne fragmenty DNA. W odpowiedzi na ROS, związany z ER kompleks SET, obejmujący SET, Ape1, pp32, HMG2, NM23-H1 i TREX1, ulega translokacji do jądra, gdzie granzym A rozszczepia trzech członków kompleksu SET, którzy biorą udział w naprawie DNA: HMG2, Ape1 i SET.
Perforin/Granzyme Apoptosis Pathway in Disease
Badania na myszach z uszkodzonym genem wskazują jednoznacznie, że szlak perforinowy jest zaangażowany w obronę przed patogenami wirusowymi i transformowanymi komórkami. W badaniach in vivo wykazano również niepodejrzewaną rolę perforiny jako kluczowego mediatora nadzoru immunologicznego spontanicznie przekształconych komórek oraz w regulacji homeostazy limfocytów B i pamięci limfocytów T. Paradoksalnie, perforina odgrywa kluczową rolę w obronie przed patogenami wirusowymi i komórkami transformowanymi. Paradoksalnie, perforyna odgrywa zasadniczą rolę w patogenezie niektórych modeli chorób autoimmunologicznych, takich jak cukrzyca insulinozależna u myszy z cukrzycą nieotyłą (NOD), ale może tłumić inne choroby autoimmunologiczne, w tym eksperymentalne autoimmunologiczne zapalenie mózgu i rdzenia kręgowego (EAE).
Ścieżki apoptozy perforyny/granzymu, które regulują polaryzację granulek i egzocytozę są określane, a te ścieżki mogą być zakłócone przez interakcję komórek nowotworowych z niektórymi limfocytami cytotoksycznymi. Ostatnie odkrycia, że wnikanie granzymów do komórek docelowych wiąże się z wiązaniem się ze specyficznymi receptorami błonowymi i że niektóre guzy syntetyzują inhibitory proteazy serynowej, które mogą neutralizować granzymy, wskazały potencjalne nowe sposoby, w których guzy mogą uniknąć ataku immunologicznego.
.