- Inhoud
- Functie
- Mechanisme voor strand-transfer inhibition actio
- HIV en AIDS
- Impact of Structure
- PFV Intasome Crystallization
- Kristallisatietechniek
- Kristallografische en verfijningsstatistieken
- Algemene architectuur & Componenten
- Structuur
- Integrase en DNA interacties
- Actieve plaats
- Integrase-remmers
Inhoud
- 1 Functie
- 2 Mechanisme voor strand-transfer inhibition actio
- 3 HIV en AIDS
- 4 Impact van structuur
- 5 PFV Intasome Crystallization
- 5.1 Kristallisatietechniek
- 5.2 Kristallografische en verfijningsstatistieken
- 6 Algemene architectuur & Componenten
- 6.1 Structuur
- 6.2 Integrase en DNA interacties
- 6.3 Actieve Site
- 7 Integrase remmers
- 7.1 Additionele bronnen
- 8 3D-structuren van retroviraal integrase
Functie
Retroviraal integrase is een essentieel retroviraal enzym dat zich bindt aan viraal DNA en dit in een gastheercelchromosoom invoert. Het omgekeerd getranscribeerde cDNA van humaan immunodeficiëntievirus type 1 (HIV-1) wordt in het genoom van de gastheercel ingevoegd om de fitness en virulentie van de ziekteverwekker te verhogen. Integrase wordt geproduceerd door een klasse van retrovirussen (zoals HIV) en wordt door het virus gebruikt om zijn genetisch materiaal in het DNA van de gastheercel op te nemen. De cellulaire machinerie van de gastheer produceert vervolgens mRNA en vervolgens eiwitten uit het opgenomen genetisch materiaal, waardoor het virus wordt gerepliceerd. Hoewel verschillende integraseremmende geneesmiddelen zijn onderzocht, moet het mechanisme dat verantwoordelijk is voor de strand-transfer remmende werking nog worden opgehelderd. Hare el al (2010) hebben echter de structurele bestanddelen van retrovirale integratie bepaald. Verdere opheldering van de volledige structuur van het retroviraal integrase, en de toepassing ervan om de functionele en enzymatische activiteiten te reguleren, zou onderzoekers mogelijk in staat kunnen stellen de progressie van retrovirale ziekten te vertragen. Bovendien zou de studie van HIV-1 integratie kunnen leiden tot een veelbelovend nieuw doelwit, en bijdragen tot de generatie van farmacofore modellen voor antivirale therapie.
HIV-integratieremmers: Raltegravir, dat als Isentress op de markt wordt gebracht, is momenteel goedgekeurd als een therapeutische remmer van HIV-integratase. Het werd goedgekeurd op 12 oktober 2007.Voor faagintease zie Faagintease.
Mechanisme voor strand-transfer inhibition actio
Caption
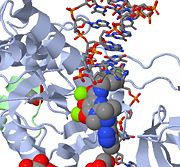
Hierboven ziet u een JMOL-afbeelding van MK-0518 die het 3′-uiteinde van het virale DNA blokkeert zodat het niet kan binden aan de actieve zone. Let op de metaalchelaterende zuurstofatomen in MK-0518 die interageren met de magnesiumkationen in de actieve zone.
HIV integrase type 1 is een relatief nieuw doelwit voor remmers. In 2007 werd de eerste integraseremmer voor hiv-1, Raltegravir, door de FDA goedgekeurd voor gebruik bij hiv-1 als combinatietherapie. Integraseremmers werken door de gecoördineerde integratie van het virale DNA in het gastheerchromosoom te verhinderen. Na binnenkomst van het virus in de gastheercel zet reverse transcriptase het virale ssRNA om in dsDNA. Op dit punt vormt het integrase een complex met het viraal DNA, waardoor het pre-integratiecomplex (intasoom) ontstaat. Het pre-integratiecomplex wordt vervolgens gekaperonneerd naar de kern, waar twee nucleotiden worden afgesneden van het 3′-uiteinde. Vervolgens wordt het DNA covalent geïntegreerd in het gastheer-DNA. De strand-transfer remmers onderbreken dit proces en verhinderen de integratie van het virale DNA in het gastheerchromosoom. Streng-overdracht remmers werken door het aangaan van de metaalionen cofactoren gevonden in de retrovirale integrase actieve site. De metaalchelaterende zuurstofatomen in de remmers hebben een directe interactie met de metaalcofactoren, terwijl de halobenzylgroep in de zak past die door het verplaatste 3′-virale DNA in de actieve site wordt gecreëerd.
HIV en AIDS

In 2010 zijn er meer dan 25 miljoen mensen aan aids overleden, en naar schatting leven ongeveer 33 miljoen mensen met hiv.
Tot op heden zijn er meer dan 25 miljoen mensen aan aids overleden, en naar schatting leven momenteel ongeveer 33 miljoen mensen met hiv. Voor retrovirale integraseremmers, zie Raltegravir en Retroviral Integrase Inhibitor Pharmacokinetics.
Impact of Structure
Driedimensionale structuren voor bepaalde gastheereiwitten die van cruciaal belang zijn om het mechanisme van HIV-infectie en virulentie te begrijpen, zijn naar voren gekomen uit röntgenkristallografische analyses. De HIV protease en integrase structuren behoren tot de hoogst gerangschikte structuren die hebben bijgedragen tot het redden van vele levens en hebben bijgedragen tot de levenskwaliteit van vele HIV-geïnfecteerde personen. Het wordt toegepast in structuurgebaseerd geneesmiddelenontwerp om proteaseremmers en integraseremmers te ontwikkelen, en wordt gebruikt als een belangrijk onderdeel van zeer actieve anti-retrovirale therapie (HAART).
Weliswaar verbeteren de bestaande antiretrovirale middelen de kwaliteit van leven en verlengen zij het leven van veel patiënten, maar zij slagen er niet in de ziekte uit te roeien. Onderzoek naar integraseremmers toont aan dat combinatie met andere antiretrovirale middelen de virusaanpassingen vermindert, en mogelijk kan worden gebruikt voor salvage therapie voor patiënten die resistentie tegen andere middelen hebben verworven. Voor meer informatie, zie
- AIDS Before Protease Inhibitors & HIV Protease Inhibitors: A Breakthrough
- Treatments:Retroviral Integrase Inhibitor Pharmacokinetics References.
PFV Intasome Crystallization
Om de virale DNA-einden van HIV-1 na te bootsen, maakten Hare et al (2010) gebruik van oplosbare en volledig functionele prototype schuimvirus (PFV) intasoom preparaten, verkregen met behulp van recombinant PFV integrase en dubbelstrengs oligonucleotiden.
De opmerkelijke stabiliteit van de integrase-DNA complexen werd bepaald door het observeren van de in vitro strengoverdracht reacties, die werden ingedeeld in drie modi van deproteinatie migratie: (1) enkelvoudige gecoördineerde gebeurtenissen: gelineariseerd doelplasmide; (2) meervoudige gecoördineerde gebeurtenissen: uitstrijkjes; (3) half-site gebeurtenissen: open circulair DNA. Verdere karakterisering van het PFV intasoom toonde ook structurele substantie aan die sterke eiwit-eiwit en eiwit-DNA interacties impliceerde ondanks langdurige incubatie onder hoge ionische sterkte condities. Uitgebreide kristallisatieproeven leverden een levensvatbare kristalconfiguratie op die röntgenstraling met een resolutie van 2,9 Angstroms diffundeerde. Uiteindelijk werd een drie-dimensionale structuur bepaald. De asymmetrische eenheid bevatte een enkel integrase dimeer met een stabiel gebonden viraal DNA molecuul, en een paar integrase dimeren geconjugeerd met symmetrie, die een langwerpig tetramer vormden. Het dimeer-interface wordt gestabiliseerd door intermoleculaire amino-terminal en katalytische kerndomeinen (binnenste subunit-buitenste subunit) interacties. De algemene vorm van het langwerpige tetramer is uniek, hoewel het semantische overeenkomsten vertoont met eerder gerapporteerde HIV-1 integrase complexen.
Kristallisatietechniek
De eiwit-DNA complexen werden gevormd met behulp van het full-length, wild-type PFV IN en synthetisch dsDNA dat het virale uiteinde modelleerde.
Het intasoom werd gekristalliseerd met behulp van de vapor-drop hanging diffusion techniek. De reservoiroplossing bestond uit 1,35 M ammoniumsulfaat, 25% (v/v) glycerol, 4,8% (v/v) 1,6-hexaandiol, en 50 mM 2-(N-morfolino) ethanesulfonzuur (MES) bij pH 6,5. De eiwit-DNA-kristallen werden ook geweekt in aanwezigheid van MK0518, GS9137, Mg(II), en/of Mn(II). De kristalstructuur werd opgelost met behulp van moleculaire vervanging.
Kristallografische en verfijningsstatistieken
Hare et al. (2010) hebben gegevens gepubliceerd over zeven kristalstructuren. Deze gegevens omvatten het PFV IN-complex (apovorm) en zes extra structuren, waaronder het complex gebonden aan Mg, Mn, Mg/MK0518, Mn/MK0518, Mg/GS9137, en Mn/GS9137. Alle zeven structuren behoren tot de P41212-ruimtegroep. Ze zijn verfijnd tot een resolutie tussen 2.85 en 3.25 Å.
Algemene architectuur & Componenten
Structuur
De algemene structuur van het geassembleerde PFV intasoom is een tetrameer model gebaseerd op twee domeinstructuren met een dimeer-dimeer interface. Eerdere intasoommodellen geven een vergelijkbare maar meer flexibele structuur weer, terwijl is aangetoond dat het PFV-intasoom zeer geconstraheerd is. Met behulp van homologiemodellen stellen Hare et al. (2010) dat kortere interdomein linkers een factor kunnen zijn in de flexibiliteit, specifiek in HIV-1 integrase. De binnenste subeenheden van het tetrameer zijn betrokken bij de algehele tetramerisatie en de virale DNA-binding. De katalytische kerndomeinen van de buitenste subeenheden kunnen fungeren als dragers, maar aangezien de amino- en carboxy-terminale domeinen onopgelost zijn in elektronendichtheidskaarten, blijft hun functie onduidelijk. Het katalytische kerndomein en de carboxy-terminale linker hebben een verlengde conformatie over het grootste deel van hun lengte, en liggen parallel aan het amino-terminale domein en de katalytische kerndomein linker van de binnenste subeenheid. De interdomein-linkers De interdomein-linkers (CCD-CTD-linker en NTD-CCD-linker) binden beide helften van het intasoom aan elkaar, en de structuur wordt verder gestabiliseerd door een paar carboxy-terminale domeinen die interageren met beide binnenste katalytische kerndomeinen.
Integrase en DNA interacties
Sterke eiwit-DNA interacties bevinden zich binnen de laatste zes nucleotiden. Elk carboxy-terminal domein interageert met de fosfodiester ruggengraat van beide virale DNA moleculen. Bovendien hebben het amino-terminale domein-extensiedomein en het amino-terminale domein interactie met het virale DNA op de actieve plaats van het tegenoverliggende katalytische kerndomein.
Actieve plaats
De carboxylaten van de actieve plaats zijn zijketens van Asp 128, Asp 185, Glu 221.
Elk zinkatoom bevindt zich in de buurt van de actieve plaatsen.
- .
- .
Integrase-remmers
| Naam | Merk | Bedrijf | Patent | Opmerkingen |
| Raltegravir | Isentress | Merck & Co. | – | ook bekend als MK-0518. De isopropyl- en methyl-oxadiazool van MK-0518 zijn betrokken bij hydrofobe en stapelinginteracties met zijketens van Pro 214 en Tyr 212 om dit geneesmiddel te stabiliseren binnen de actieve site van PFV intasoom. Deze manier van interactie tussen het geneesmiddel en het intasoom veroorzaakt de verplaatsing van het reactieve 3′ virale DNA uiteinde uit de actieve site van het PFV intasoom. Na binding van MK-0518 aan de actieve zone verwijdert de reactieve 3′-hydroxylgroep zich meer dan 6 Angstroms van de actieve zone van het PFV-intasoom. Raltegravir werd op 12 oktober 2007 door de FDA goedgekeurd voor gebruik met andere anti-HIV middelen bij de behandeling van HIV-infectie bij volwassenen. Het is de eerste integraseremmer die door de FDA is goedgekeurd. |
| Elvitegravir | – | Gilead Science | – | GS-9137 heeft een wisselwerking met Pro 214 van PFV-intasoom via zijn quinolonbasis en isopropylgroep. In experimentele stadia; heeft de kernstructuur van chinolon antibiotica gemeen. Fase II-onderzoeken van elvitegravir bij mensen met behandelingservaring zijn voltooid. Fase III-studies bij patiënten met behandelingservaring zijn aan de gang. Een fase II-studie van elvitegravir bij mensen die nog nooit een antiretrovirale therapie hebben gehad, is aan de gang. Deze studie zal ook een boosting agent evalueren in plaats van Norvir, momenteel GS9350 genaamd. Elvitegravir is veelbelovend voor HIV-positieve patiënten die in het verleden andere anti-HIV geneesmiddelen hebben genomen. |
| MK-2048 | – | Merck & Co. | – | Een integraseremmer van de tweede generatie, bedoeld om te worden gebruikt tegen HIV-infectie. Het is superieur aan de eerste beschikbare integraseremmer, raltegravir, in die zin dat het het HIV-enzym integrase vier keer zo lang remt. Het wordt onderzocht voor gebruik als onderdeel van pre-exposure prophylaxis (PrEP). |
Zie ook Retroviral Integrase Inhibitor Pharmacokinetics.