De perforine/granzym-apoptoseweg is de voornaamste signaalweg die door cytotoxische lymfocyten wordt gebruikt om virusgeïnfecteerde en/of getransformeerde cellen te elimineren. Studies in muizen met een gendisruptie wijzen uit dat perforine, in combinatie met granzym, apoptose kan induceren. Het is van vitaal belang voor de cytotoxische effectorfunctie en heeft een onmisbare, maar niet gedefinieerde rol in granzyme-gemedieerde apoptose.
Perforine en Granzyme
Perforine is een porievormend eiwit en ook bekend als cytoplasmatische granulustoxinen. Granzyme is een familie van structureel verwante serine proteasen die zijn opgeslagen in de cytotoxische granules van cytotoxische lymfocyten (CL’s). Perforine en granzym induceren gezamenlijk apoptose van de doelwitcel (figuur 1). Granzym is noodzakelijk om apoptose van de doelcellen op gang te brengen, maar het is afhankelijk van de juiste toediening van perforine. Zowel perforine als granzyme binden zich aan het oppervlak van de doelcel als onderdeel van één macromoleculair complex, geassocieerd met serglycine, waardoor de waarschijnlijkheid van passieve diffusie van granzymes verder afneemt.
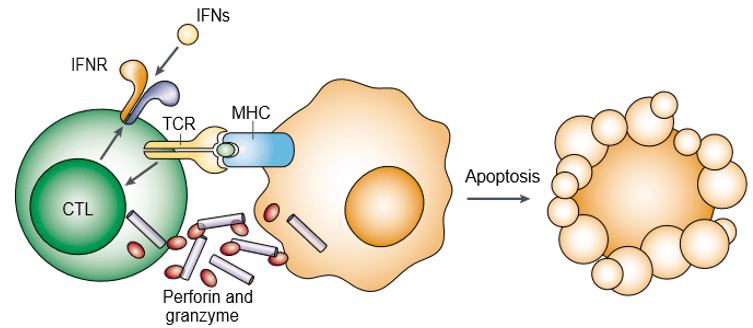
Figuur 1.
Perforine en granzym induceren gezamenlijk apoptose van de doelcel.
Bij de mens zijn er de granzymen A, B, H, K, en M, terwijl er bij de muis granzym A, B, C, D, E, F, G, K, L, M, en N zijn. Granzym A (GrA) en granzym B (GrB) zijn de meest voorkomende granzymes en zijn het meest bestudeerd. De functies van de granzymes A en B bij het induceren van doelcelapoptose zijn uitgebreid in vitro onderzocht, en zij worden op moleculair niveau beter begrepen dan de rol van perforine.
Proces en regulatie van de perforine/Granzyme Apoptose Pathway
Nadat ze door cytotoxische lymfocyten zijn uitgescheiden, dringen de granzymes de doelcellen binnen, wat een vitale stap in de celdood is. De belangrijkste lytische eiwitten die in de granules zijn verpakt, zijn verschillende granzymes en het porievormende eiwit perforine, dat de internalisatie van granzymes door cellen vergemakkelijkt.
Granzym B triggert caspase-activering hoofdzakelijk indirect, in plaats van door directe caspaseverwerking. Het bereikt dit door directe activering van pro-apoptotische ‘BH3-only’ leden van de BCL-2 familie, zoals BH3-interacting domain death agonist (Bid). Bid leidt samen met de pro-apoptotische BCL-2 familie Bax en/of Bak eiwitten tot het lekken van pro-apoptotische mitochondriale mediatoren, zoals cytochroom c, naar het cytosol. Het vrijkomen van cytochroom c activeert pro-caspase-9, en door binding aan apoptotic protease activating factor 1 (Apaf-1) wordt pro-caspase-9 tot rijpe caspase-9, die het apoptosoom blijft vormen en stroomafwaarts caspase-3 activeert. Geactiveerd caspase-3 is in staat specifieke substraten zoals ICAD (inhibitor of the caspase-activated DNase, CAD) te klieven, waardoor het CAD naar de kern kan transloceren om DNA te fragmenteren. Naast Bid kan granzym B ook Mcl-1 inactiveren, dat lid is van de anti-apoptotische Bcl-2-familie, zodat het pro-anti-apoptotische Bcl-2-familie-eiwit Bim vrijkomt op de buitenste mitochondriale membraan. En granzym B kan ook de effector caspase-3 en de initiator caspase-8 bemiddelen om de apoptose pathway te reguleren.
In tegenstelling tot granzym B, is granzym M niet afhankelijk van mitochondriale om te reguleren, maar granzym M kan granzym B activeren door de splitsing van proteinase inhibitor 9 (PI-9) dat de remmer is van granzym B. Granzym M kan ook direct granzym B klieven. Granzym M kan ook direct de ICAD splijten om net als granzym B CAD te ontketenen.
Granzym A induceert verlies van mitochondriaal binnenmembraanpotentiaal en het vrijkomen van reactieve zuurstofspecies (ROS). Het genereert enkelstrengs DNA-nicks, in plaats van oligonucleosomale DNA-fragmenten. In reactie op ROS verplaatst het ER-geassocieerde SET-complex, dat SET, Ape1, pp32, HMG2, NM23-H1 en TREX1 omvat, zich naar de kern, waar granzym A drie leden van het SET-complex klieft die betrokken zijn bij DNA-reparatie: HMG2, Ape1, en SET.
Perforin/Granzyme Apoptosis Pathway in Disease
Studies in gen-gestoorde muizen tonen duidelijk aan dat de perforine pathway nauw betrokken is bij de verdediging tegen virale pathogenen en getransformeerde cellen. Maar onvermoede rollen voor perforine als cruciale mediatoren van de immuunbewaking van spontaan getransformeerde cellen en in het reguleren van B-cel homeostase en T-cel geheugen zijn ook in vivo aangetoond. Paradoxaal genoeg speelt perforine een rol bij de pathogenese van bepaalde auto-immuunziektemodellen, zoals insuline-afhankelijke diabetes in niet-obese diabetische (NOD) muizen, maar zou het andere auto-immuunziekten kunnen onderdrukken, waaronder experimentele auto-immuun encefalomyelitis (EAE).
De perforine/granzym apoptose pathways die granule polarisatie en exocytose reguleren worden bepaald, en deze pathways zouden verstoord kunnen worden door de interactie van kankercellen met sommige cytotoxische lymfocyten. De recente bevindingen dat het binnendringen van granzymen in doelcellen gepaard gaat met binding aan specifieke membraanreceptoren en dat sommige tumoren serine proteaseremmers synthetiseren die granzymes kunnen neutraliseren, hebben gewezen op mogelijke nieuwe manieren waarop tumoren aan immuunaanvallen kunnen ontsnappen.