Patiënt met subepitheliale laesie van de maag
Martín Gómez Zuleta, MD (1)
(1) Gastro-enterologie-eenheid, afdeling Interne geneeskunde, Nationale universiteit van Colombia. Ziekenhuis Tunal. Bogotá, Colombia..
Ontvangen: 05-10-10 Geaccepteerd: 25-11-10
Abstract
Hoewel subepitheliale laesies zelden worden gevonden in het bovenste deel van het maagdarmkanaal, kunnen ze onzekerheid veroorzaken in diagnostische aanpak en management. Endosonografische bevindingen worden beschreven en huidige aanbevelingen worden herzien in het licht van één geval om een rationele benadering van deze laesies mogelijk te maken.
Keywords
Submucosale tumoren, endoscopische echografie, GIST.
Clinische casus
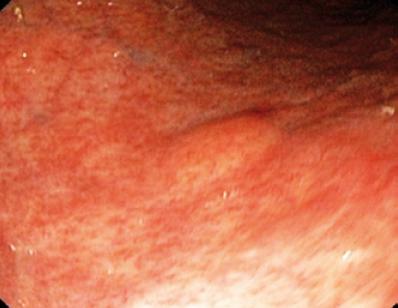
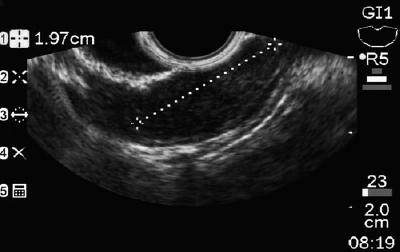
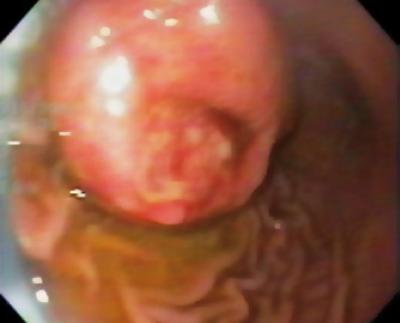
Een 50-jarige man met dyspepsie werd doorgestuurd voor een bovenste endoscopie waarbij een 9 mm subepitheliale laesie in de maagcorpus werd gevonden (figuur 1). Biopsie van het bovenliggende slijmvlies was normaal. De patiënt had geen eerdere medische voorgeschiedenis, en zijn lichamelijk onderzoek was normaal.
Figuur 1. Maag subepitheliale laesie.
Initiële benadering: Wat kunnen we dan doen?
Een massa of uitstulping in het lumen van een orgaan dat door normaal epitheel wordt bedekt, wordt een subepitheliale laesie genoemd. Het zijn weinig voorkomende laesies die naar verwachting bij 1 op de 300 endoscopieën voorkomen (1, 2). Oorzaken kunnen zijn intrinsieke goedaardige of kwaadaardige laesies van de wand van het maagdarmkanaal of extrinsieke compressie veroorzaakt door normale of pathologische aangrenzende structuren (3).
Deze laesies worden meestal incidenteel gevonden en hebben vaak geen relatie met symptomen, zoals het geval was bij onze patiënte. Dit kan de arts doen twijfelen of zij of hij vervolgonderzoek moet doen en aanvullend onderzoek moet verrichten (4). Naar onze mening moeten al deze laesies worden geëvalueerd om hun oorsprong op te helderen. We moeten altijd een biopsie nemen van de bovenliggende mucosa (tenzij we een vasculaire of cysteuze oorsprong vermoeden), omdat veel van deze laesies een oorsprong kunnen hebben in de lamina propria of muscularis mucosa. In deze gevallen kunnen zij met een tang worden bereikt en kan een nauwkeurige diagnose worden gesteld. Indien de biopsies normaal zijn, moeten we hier bepalen of we het onderzoek moeten stoppen of voortzetten.
Wanneer de endoscopie is uitgevoerd en een subepitheliale laesie is ontdekt, kunnen we onmiddellijk overgaan tot de evaluatie ervan. In eerste instantie moeten we de grootte, vorm, kleur en beweeglijkheid ervan beschrijven, en of het pulseert of niet. Tenslotte kunnen we de consistentie beoordelen met een gesloten biopsietang, waardoor we kunnen detecteren of het een cyste is, vast of zacht, drukbaar en kussenachtig (een laesie die langzaam herstelt). Kussenvormige letsels met gele halo’s zijn zeer suggestief voor lipomen. Als de laesie een lichte onregelmatigheid van het slijmvlies is, en een centrale depressie heeft, is het suggestief voor een ectopische pancreas. Gewoonlijk hebben cysten of varices een gladde, symmetrische mucosa. GIST’s (gastro-intestinale stromale tumoren) kunnen licht gezweerd zijn, maar zij zijn stevig en beweeglijk (9). Het is ook nuttig om de positie van de patiënt te veranderen om de mogelijkheid van een extrinsieke laesie uit te sluiten, waarvan het endoscopische uiterlijk zal veranderen als de patiënt zijn of haar positie verandert, inademt, of als de maag van de patiënt gevuld is met lucht (10-12).
Wat is de Differentiële Diagnose?
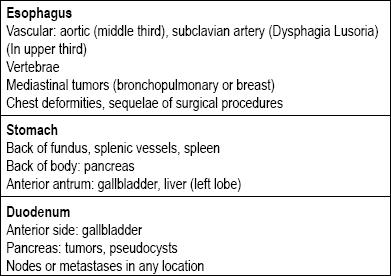
Er zijn vele soorten laesies in het maag-darmkanaal die kunnen worden gecategoriseerd als subepitheliaal. De oorzaak hangt meestal af van de vraag of de laesie zich in de slokdarm, maag, twaalfvingerige darm of het rectum bevindt. Het volgende punt om te overwegen is of het echt een laesie van de wand is, of dat het een extrinsieke compressie is, aangezien er structuren rondom het gehele maagdarmkanaal zijn die tot compressie kunnen leiden (tabel 1) (5-8).
Tabel 1. Primaire oorzaken van extraluminale compressies in het bovenste deel van het spijsverteringskanaal.
Moeten alle laesies worden geëvalueerd met endoscopische echografie (EUS)?
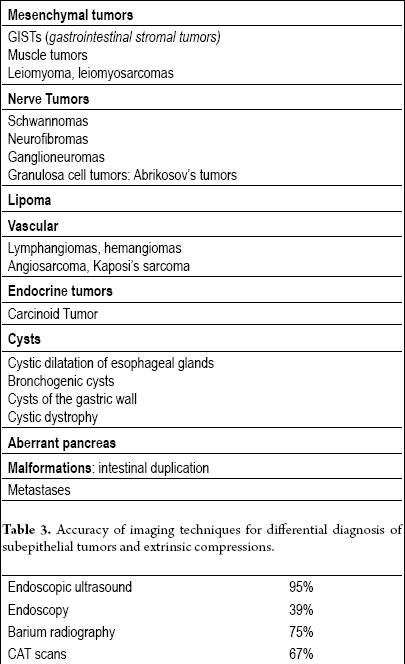
In feite moeten alle subepitheliale laesies (tabel 2) worden geëvalueerd met aanvullende beeldvormingstechnieken, maar als de laesie minder dan een centimeter groot is (vooral als deze geel is), is een evaluatie niet nodig omdat er een grote waarschijnlijkheid is dat het om een lipoom gaat.
Tabel 2. Subepitheliale tumoren van het maagdarmkanaal.
De endoluminale of endoscopische echografie (EUS) is de techniek van keuze (13, 14). De nauwkeurigheid van EUS voor de differentiatie van extraluminale compressie van een subepitheliale tumor is meer dan 95%. Dit is veel beter dan andere beeldvormende technieken zoals conventionele echografie of CAT-scans (15-17) (tabel 3).
Tabel 3. Nauwkeurigheid van beeldvormingstechnieken voor differentiële diagnose van subepitheliale tumoren en extrinsieke compressies.
Als we eenmaal hebben vastgesteld dat de laesie intrinsiek is aan de wand, en geen extrinsieke compressie is, moeten we evalueren met welke wandlaag deze overeenkomt. Normaal is de maagwand verdeeld in de mucosa, submucosa, muscularis propria en serosa. De slijmlaag is verdeeld in het epitheel, het basaal membraan, de lamina propria en de musculaire mucosa. Met EUS en met de radioapparatuur kan de wand in 5 lagen worden verdeeld (18):
De eerste hyperechoïsche laag komt overeen met het meest oppervlakkige deel van de maagslijmvlies.
De tweede hyperechoïsche laag komt overeen met het diepste deel van de mucosa dat kan worden gecorreleerd met de musculaire mucosa.
De derde hyperechoïsche laag komt overeen met de submucosale laag.
De vierde hypoechoïsche laag komt overeen met de spier zelf.
De vijfde hyperechoïsche laag komt overeen met de serosa of adventitia.
Normaal gezien zijn er geen laesies in de lagen één en vijf (19), zodat ze beperkt zijn tot drie lagen. Ze zijn meestal hypoechoïsch, anechoïsch of hyperechoïsch.
Diagnose met endoscopische echografie
We zullen elke presentatie beschrijven aan de hand van de laag.
Echolaag twee
Komt overeen met het diepste deel van de mucosa of met de lamina propria en met de muscularis mucosa. De laesies die in deze laag ontstaan zijn zeldzaam en zijn meestal hypoechoïsch.
Hypoechoïsche laesies: De meeste tumoren die in deze laag ontstaan zijn gespierd, meestal leiomyomen. Zij kunnen verkalkingen vertonen en grote kunnen heterogeen zijn en knobbels vertonen in tegenstelling tot kleine laesies die homogeen zijn. (20).
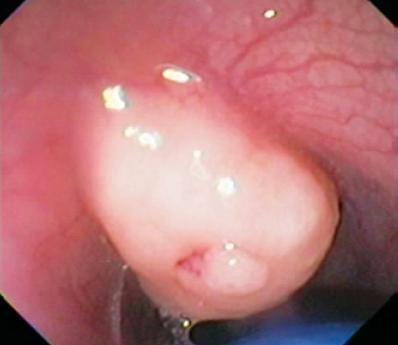
In deze laag vinden we ook Abrikosovs tumoren of korrelige cellen. Zij zijn meestal klein en, in tegenstelling tot leiomyomen, vervormen zij de bal van de endoscoop door hun hardheid (figuren 2 en 3). Carcinoïden kunnen ook in deze laag ontstaan, meestal in de fundus of het rectum (figuur 4).
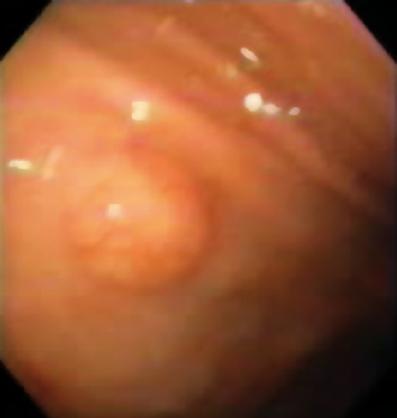
Figuur 2. Geel gekleurde subepitheliale laesie in de distale slokdarm.
Figuur 3. De EUS toont een isoechoïsche laesie in de derde echolaag die de bal vervormt, wat duidt op een granulaire celtumor van 2 cm
Figuur 4. Subepitheliale laesie met een reticulair patroon in het centrum dat een neuro-endocriene tumor suggereert.
Anechoïsche laesies: Gewoonlijk zien we dat inclusie- of retentiecysten in deze laag kunnen ontstaan.
Echolaag drie
Is een band van weefsel die er hyperechoïsch uitziet in de EUS. Talrijke tumoren kunnen in deze laag ontstaan.
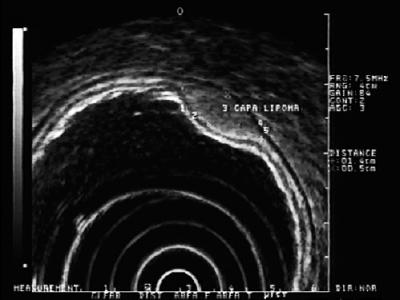
Hyperechoische laesies: De meest frequent gevonden laesies in deze laag zijn lipomen. Zij worden gekenmerkt als homogene hyperechoische laesies. Gewoonlijk zijn ze kussenachtig wanneer ze met een endoscopische tang worden ingedrukt (figuur 5) (9).
Figuur 5. EUS: hyperechoïsche laesie in submucosale laag 3 compatibel met lipoom.
Neurofibromen hebben de neiging hyperechoïsch te zijn. Zij vinden hun oorsprong in de submucosa of muscularis propria.
Hypoechoïsche laesies in deze laag kunnen overeenkomen met ectopische of afwijkende pancreata. Deze laesies zijn gewoonlijk heterogeen en soms kunnen in het centrum anechoïsche ductale structuren worden gezien die met ducten kunnen overeenkomen. In een endoscopie wordt een laesie met een depressief centrum gezien (21).
Hypoechoïsche laesies kunnen ook overeenkomen met carcinoïde tumoren. Hoewel het geen subepitheliale tumoren zijn omdat ze eerder neuro-endocrien dan mesenchymaal zijn, kunnen ze zich in de spijsverteringswand bevinden en aanleiding geven tot hetzelfde soort knobbels. Gewoonlijk zijn zij klein (minder dan één cm), hypoechoïsch (maar meer echogeen dan musculair) en nestelen zij zich in de mucosa. Histologisch onderzoek is meestal mogelijk uit een biopsie (22, 23).
Gastrische lymfomen kunnen ook aanwezig zijn als hypoechoische of hyperechoische laesies van de submucosa (24).
Anechoische laesies die in deze laag worden waargenomen zijn waarschijnlijk vasculaire structuren of cysten (25).
Echolaag vier
Korrespondeert met de musculaire laag. Vandaar dat de meerderheid van de tumoren in deze laag van gespierde oorsprong zijn.
Hyperechoïsche laesies zijn zeer zeldzaam, maar kunnen verband houden met lymfomen, neurogene tumoren of metastasen (26).
Hyperechoïsche laesies: De meeste tumoren van deze laag zijn hypoechoïsch, meestal stromale tumoren (GIST) wanneer zij zich in de maag bevinden. Als ze zich echter in de slokdarm bevinden, worden ze meestal leiomyomen genoemd. Andere laesies die dit uiterlijk kunnen hebben zijn uitzaaiingen uit de longen of de borsten en glomustumor (27). Lymfomen kunnen deze laag ook aantasten, maar gaan meestal gepaard met betrokkenheid van de bovenste lagen.
GIST (gastro-intestinale stromale tumor) is de naam van een laesie waarover onze kennis de laatste jaren sterk is verbeterd (28-30). Deze tumoren blijken hun oorsprong te vinden in totipotentiele cellen, die tevens de oorsprongsgebieden zijn van de zogenaamde interstitiële cellen van Cajal. Zij kunnen worden onderscheiden in groepen: overwegend musculair, overwegend neuraal, of een combinatie van beide. De diagnose wordt gesteld door de immunohistochemische identificatie van CD-117 eiwit (ook bekend als c-kit eiwit) dat een membraanreceptor is met tyrosine kinase activiteit (31).
Het belang van deze laesies is dat 30% kwaadaardig gedrag kan vertonen en aanleiding kan geven tot metastasen. Alleen al in de Verenigde Staten worden jaarlijks 5.000 tot 6.000 gevallen gemeld (32). Hun verdeling in het maagdarmkanaal is: maag (40-70%), dunne darm (20-40%), colon en rectum (5-15%) en slokdarm (<5%) (33). Dit betekent dat een hypoechoïsche laesie van de vierde laag in de slokdarm waarschijnlijk een leiomyoom is, maar in de maag meestal een GIST (figuur 6, 7 y 8). De meeste patiënten zijn in het vijfde of zesde decennium van hun leven. Meestal hebben zij een laesie gelokaliseerd in de vierde laag of muscularis propria, hoewel het ook gelokaliseerd kan zijn in de muscularis mucosa (34). De meeste patiënten zijn asymptomatisch totdat de tumor groot genoeg wordt om te ulcereren, te bloeden of te metastaseren.
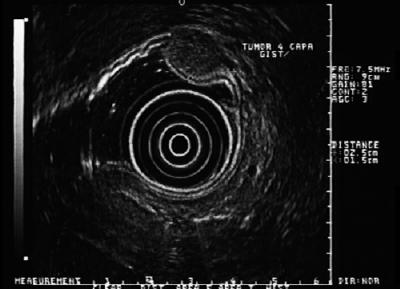
Figuur 6. EUS toont hypoechoïsche laesie van de vierde laag die compatibel is met GIST.
Figuur 7. Gezwollen laesie die wijst op GIST.
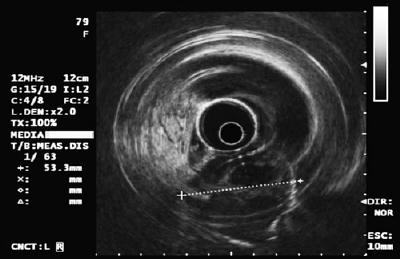
Figuur 8. EUS van figuur 7 toont hypoechoïsche laesie van de vierde echolaag die sterk wijst op een GIST van meer dan 5 cm.
Als we daarom een GIST van meer dan 3 cm vaststellen, is dat een indicatie voor chirurgie, zelfs als die asymptomatisch is (andere auteurs stellen een grens van 4 cm voor). (35). Letsels van minder dan 3 cm vormen echter een uitdaging voor het beheer omdat de meerderheid goedaardig is. Niettemin moet worden verduidelijkt dat alle GISTs potentieel kwaadaardig zijn, en kleine GISTs die zijn gemetastaseerd zijn gerapporteerd, vooral in het lagere maagdarmkanaal. Momenteel is het niet mogelijk om met endoscopische echografie het kwaadaardig potentieel van een GIST te voorspellen. Niettemin weten we dat laesies die groter zijn dan 4 cm, onregelmatige randen en/of cysteuze ruimten binnenin hebben, of echogene foci hebben, een hoge waarschijnlijkheid hebben om kwaadaardig te zijn (36).
Aan de andere kant kan endoscopische echogeleide fijne-naaldaspiratie (EUS-FNA) niet alleen de diagnose GIST stellen door CD-117 te identificeren, maar ook de aanwezigheid van het Ki-67 eiwit, dat proliferatie aangeeft en kwaadaardig gedrag suggereert (37). Het is zeer belangrijk te benadrukken dat GIST-laesies zeer gevaarlijk zijn. Wij moeten ze voortdurend volgen en de grootte van de tumor en de proliferatiegraad beoordelen volgens de vastgestelde risico’s. Zelfs na volledige resectie kunnen deze laesies recidiveren, vooral op de plaats van oorsprong, maar ook in het buikvlies of de lever. 40% tot 90% van de laesies recidiveren ondanks volledige resectie. 50% van de recidieven betreft de lever. GIST’s hebben 4 maal meer kans op recidief wanneer de primaire plaats de darm is dan wanneer deze zich in de maag bevindt (38).
Wat is de nauwkeurigheid van endoscopische echografie?
Meerdere studies hebben aangetoond dat EUS zeer nauwkeurig is om te bepalen of een laesie zich al dan niet op de wand bevindt, en om vast te stellen uit welke wandlaag de laesie afkomstig is. Dit stelt ons in staat de beste diagnostische benadering te kiezen. In één studie werd bij 48 van 50 patiënten (96%) de bronlaag vastgesteld met chirurgische bevestiging (39). De interobserver overeenkomst is zeer goed, vooral bij het identificeren van laesies zoals leiomyomen en vasculaire laesies. Het is belangrijk op te merken dat de sonografische verschijning van laesies ons niet in staat stelt hun oorzaken met 100% zekerheid vast te stellen. Een studie van Karaca et al. (40) van 22 patiënten die EUS ondergingen gevolgd door mucosectomie toonde aan dat de nauwkeurigheid van EUS slechts 45% was. De laesies waren echter meestal kleiner dan 20 mm, en de nauwkeurigheid van EUS steeg tot 66% voor het onderscheiden van maligne van benigne tumoren. Aangezien de sonografische criteria onnauwkeurig kunnen zijn, lijkt het redelijk dat wij, indien mogelijk, moeten trachten een specifieke diagnose te verkrijgen. Dit kan worden bereikt met EUS-FNA of mucosale resectie van de laesie, zoals in dit werk is aangetoond. Mekky et al. bestudeerden 141 patiënten bij wie EUS-FNA chirurgisch werd gecontroleerd. Zij vonden een nauwkeurigheid van 95,6% voor hun eindresultaten (41).
Monitoren, punctiebiopsie of resectie?
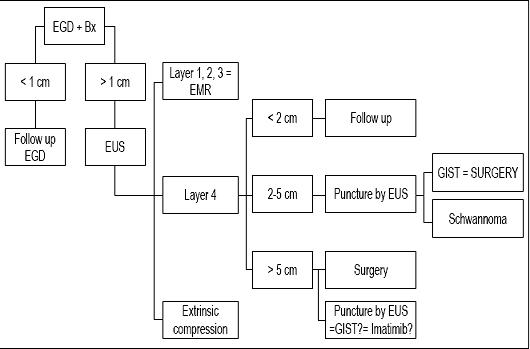
De beslissing om te monitoren, te gebruiken of een resectie uit te voeren hangt af van verschillende factoren, waaronder de grootte van de laesie, het endoscopische uiterlijk, de laag van oorsprong en de echogene kenmerken. Indien we geconfronteerd worden met een subepitheliale laesie van minder dan 1 cm, zijn meer onderzoeken niet gerechtvaardigd, maar moet een follow-up-endoscopie worden uitgevoerd. Als de laesie groter is dan 1 cm, is EUS verplicht. Als de laesie klein is en zich in de eerste, tweede of derde echolaag bevindt, kan een diagnostische slijmvliesresectie, die ook therapeutisch is, worden uitgevoerd. Als de laesie echter in de vierde laag zit en minder dan 2 cm groot is, wordt controle met alleen endoscopie aanbevolen. Als de laesie tussen 2 cm en 5 cm meet, is EUS-FNA ideaal. Als wordt vastgesteld dat het om een goedaardige laesie gaat, kan na 6 maanden een vervolgonderzoek worden uitgevoerd. Als de laesie niet is gegroeid, is geen verdere controle nodig. Als het kwaadaardig is, kwaadaardig potentieel heeft, of groter is dan 5 cm, wordt behandeling aanbevolen (42).
In conclusie, aangezien onze patiënt een laesie had kleiner dan 1 cm, zijn wij van mening dat zijn laesie alleen follow-up endoscopie verdiende (zie algoritme, figuur 9). Een nieuw vervolgonderzoek werd voorgesteld na een jaar. Als de laesie niet is gegroeid, worden om de 2 of 3 jaar extra vervolgonderzoeken gepland, maar als de laesie groeit, stellen we EUS-FNA en een immunohistochemische studie voor.
Figuur 9. Behandelingsalgoritme bij subepitheliale laesies. EGD: bovenste endoscopie. Bx: Biopsie. EUS: endoscopische echografie. EMR: endoscopische mucosale resectie.
1. Polkowski M, Butruk E. Submucosale laesies. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Endoscopische benadering van gastro-intestinale stromale tumoren. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Chak A. EUS in submucosale tumoren. Gastrointest Endosc 2002; 56(4 Suppl.): S43-8.
4. Polkowski M. Endoscopic ultrasound and endoscopic ultrasound-guided fine needle aspiration for the diagnosis of malignant submucosal tumors. Endoscopy 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. American gastroenterological association institute technical review on the management of gastric subepithelial masses. Gastroenterology 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Accuracy of endoscopic ultrasonography in upper gastrointestinal submucosal lesions: a prospective multicenter study. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, et al. Endosonografische kenmerken van gastrische ectopische pancreasen die te onderscheiden zijn van mesenchymale tumoren. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. Endosonographic features of esophageal granular cell tumors. Endoscopie 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Role of endoscopic ultrasound in the management of submucosal tumours in the esophagus and stomach. Acta Endoscop 1996; 26: 307-12.
10. Ponder TB. Collins BT. Fine needle aspiration biopsy of gastric duplication cysts with endoscopic ultrasound guidance. Acta cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Endoscopic mucosal resection for gastric neoplasms. Techniques in Gastrointestinal Endoscopy 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Endoscopic mucosal resection. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Endoscopische ultrasonografie bij gastro-intestinale stromale tumoren (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografia digestiva. Barcelona: Ed. Masson 1998. p. 21-27.
15. Yamada Y, Kida M, Sakaguchi. Een studie naar myogene tumoren van het bovenste deel van het maagdarmkanaal door endoscopische ultrasonografie met speciale verwijzing naar de differentiële diagnose van benigne en maligne laesies. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr. MV, Rosch T, et al. Evaluation of submucosal upper gastrointestinal tract lesions by endoscopic ultrasound. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Interobserver agreement for EUS in the evaluation and diagnosis of submucosal masses. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Endoscopische ultrasonografie bij de diagnose van maag submucosale tumor. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Haggitt RC, et al. Histologic correlates of gastrointestinal ultrasound images. Gastroenterology 1989; 96: 433-41.
20. Chak A, Isenberg G, Kobayashi K, et al. Prospective evaluation of an over-the-wire catheter US probe. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Endoscopic ultrasonography for the evaluation of smooth muscle tumors in the upper gastrointestinal tract: an experience with 42 cases. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Endoscopische ultrasonografie. Endoscopy 2003; 35: 127-35
23. Byrne MF, Jowell PS. Gastro-intestinale beeldvorming: endoscopische echografie. Gastroenterology 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Faigel DO. Yield of tissue sampling for submucosal lesions evaluated by EUS. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Endoscopic ultrasonography for the initial staging and follow-up in patients with low-grade gastric lymphoma of mucosa-associated lymphoid tissue treated medical. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, DiMagno EP. Diagnosis of foregut duplication cysts by endoscopic ultrasonography. Gastroenterology 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. Endosonographic differentiation of benign and malignant stromal cell tumors. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Endosonografische kenmerken voorspellend voor benigne en maligne gastro-intestinale stromale celtumoren. Gut 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. Pathology and diagnostic criteria of gastrointestinalstromal tumors (GISTs): A review. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, et al. Doeltreffendheid en veiligheid van imatinib mesylaat bij gevorderde gastro-intestinale stromale tumoren. N Engl J Med 2002; 347: 472-480.
31. Greenson JK. Gastrointestinal stromal tumors and other mesenchymal lesions of the gut. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Gastro-intestinale stromale tumoren: From a chirurgic to a molecular approach. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. Management of malignant gastrointestinal stromal tumors. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. GI stromale tumoren. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Meting van laesies door endoscopie: een overzicht. Endoscopie 1995; 27: 694-697.
36. Roberts PJ, Eisenberg B. Clinical presentation of gastrointestinal stromal tumors and treatment of operable disease. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. A study on myogenic tumors of the upper gastrointestinal tract by endoscopic ultrasonography with special reference to the differential diagnosis of benign and malignant lesions. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, et al. Prognostic assessment of gastrointestinal stromal tumor. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Gastric stromal tumors. A clinicopathologic study of 77 cases with correlation of features with nonagressive and aggressive clinical behaviors. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. submucosal tumors and thick gastric fols. ASGE- 2002. p. 77-81.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. Accuracy of EUS in the evaluation of small gastric subepithelial Lesions. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. Diagnostic utility of EUS-guided FNA in patients with gastric submucosal tumors. Gastrointest Endosc 2010; 71: 913-9.
1. Polkowski M, Butruk E. Submucosale laesies. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Endoscopische benadering van gastro-intestinale stromale tumoren. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Chak A. EUS bij submucosale tumoren. Gastrointest Endosc 2002; 56(4 Suppl.): S43-8.
4. Polkowski M. Endoscopic ultrasound and endoscopic ultrasound-guided fine needle aspiration for the diagnosis of malignant submucosal tumors. Endoscopy 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. American gastroenterological association institute technical review on the management of gastric subepithelial masses. Gastroenterology 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Accuracy of endoscopic ultrasonography in upper gastrointestinal submucosal lesions: a prospective multicenter study. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, et al. Endosonografische kenmerken van gastrische ectopische pancreasen die te onderscheiden zijn van mesenchymale tumoren. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. Endosonographic features of esophageal granular cell tumors. Endoscopie 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Role of endoscopic ultrasound in the management of submucosal tumours in the esophagus and stomach. Acta Endoscop 1996; 26: 307-12.
10. Ponder TB. Collins BT. Fine needle aspiration biopsy of gastric duplication cysts with endoscopic ultrasound guidance. Acta cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Endoscopic mucosal resection for gastric neoplasms. Techniques in Gastrointestinal Endoscopy 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Endoscopic mucosal resection. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Endoscopische ultrasonografie bij gastro-intestinale stromale tumoren (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografia digestiva. Barcelona: Ed. Masson 1998. p. 21-27.
15. Yamada Y, Kida M, Sakaguchi. A study on myogenic tumors of the upper gastrointestinal tract by endoscopic ultrasonography with special reference to the differential diagnosis of benign and malignant lesions. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr. MV, Rosch T, et al. Evaluation of submucosal upper gastrointestinal tract lesions by endoscopic ultrasound. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Interobserver agreement for EUS in the evaluation and diagnosis of submucosal masses. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Endoscopische ultrasonografie bij de diagnose van maag submucosale tumor. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Haggitt RC, et al. Histologic correlates of gastrointestinal ultrasound images. Gastroenterology 1989; 96: 433-41.
20. Chak A, Isenberg G, Kobayashi K, et al. Prospective evaluation of an over-the-wire catheter US probe. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Endoscopic ultrasonography for the evaluation of smooth muscle tumors in the upper gastrointestinal tract: an experience with 42 cases. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Endoscopische ultrasonografie. Endoscopy 2003; 35: 127-35
23. Byrne MF, Jowell PS. Gastro-intestinale beeldvorming: endoscopische echografie. Gastroenterology 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Faigel DO. Yield of tissue sampling for submucosal lesions evaluated by EUS. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Endoscopic ultrasonography for the initial staging and follow-up in patients with low-grade gastric lymphoma of mucosa-associated lymphoid tissue treated medically. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, DiMagno EP. Diagnosis of foregut duplication cysts by endoscopic ultrasonography. Gastroenterology 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. Endosonographic differentiation of benign and malignant stromal cell tumors. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Endosonografische kenmerken voorspellend voor benigne en maligne gastro-intestinale stromale celtumoren. Gut 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. Pathology and diagnostic criteria of gastrointestinalstromal tumors (GISTs): A review. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, et al. Doeltreffendheid en veiligheid van imatinib mesylaat bij gevorderde gastro-intestinale stromale tumoren. N Engl J Med 2002; 347: 472-480.
31, Greenson JK. Gastrointestinal stromal tumors and other mesenchymal lesions of the gut. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Gastro-intestinale stromale tumoren: From a chirurgic to a molecular approach. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. Management of malignant gastrointestinal stromal tumors. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. GI stromal tumors. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Meten van laesies door endoscopie: een overzicht. Endoscopy 1995; 27: 694-697.
36. Roberts PJ, Eisenberg B. Clinical presentation of gastrointestinal stromal tumors and treatment of operable disease. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. A study on myogenic tumors of the upper gastrointestinal tract by endoscopic ultrasonography with special reference to the differential diagnosis of benign and malignant lesions. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, et al. Prognostic assessment of gastrointestinal stromal tumor. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Gastric stromal tumors. A clinicopathologic study of 77 cases with correlation of features with nonagressive and aggressive clinical behaviors. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. submucosal tumors and thick gastric fols. ASGE- 2002. p. 77-81.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. Accuracy of EUS in the evaluation of small gastric subepithelial Lesions. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. Diagnostic utility of EUS-guided FNA in patients with gastric submucosal tumors. Gastrointest Endosc 2010; 71: 913-9.