Abstract
Laagwaardig ilmeniet kan worden uitgeloogd met geconcentreerd HCl bij atmosferische druk en 80oC. Na filtratie om onoplosbaar materiaal af te scheiden wordt de oplossing die TiO2+ en Fe2+ bevat verhit om titaanhydroxide neer te slaan en HCl terug te winnen. Het titaanhydroxide wordt vervolgens gecalcineerd tot synthetisch rutiel dat 95+% TiO2 bevat, terwijl FeCl2 wordt onderworpen aan oxyhydrolyse of fluïdisatie om HCl en Fe2O3 terug te winnen. Het proces kan natuurlijk worden toegepast op hoogwaardig ilmeniet. Het omzeilt het elektro-ovenprocédé dat slechts op hoogwaardig ilmeniet van toepassing is en is superieur aan het zwavelzuurprocédé dat zeer verontreinigend is. Het product van dit proces kan worden gebruikt om zowel het witte pigment als titaniummetaal te bereiden.
Keywords
HCl uitloging, Magpei proces, Synthetisch rutiel, Oxyhydrolyse, Elektrische oven, Chlorering, Zwavelzuur proces
Introductie
De belangrijkste titanium mineralen zijn rutiel, TiO2 en ilmeniet, FeTiO3 (Figuur 1 en 2). Rutiel is gemakkelijk te verwerken tot titaniummetaal of TiO2-pigment door de chlorinatiemethode, terwijl ilmeniet gecompliceerder is vanwege het hoge ijzergehalte. Aangezien de wereldreserves aan titaan voor 90% in de vorm van ilmeniet zijn en slechts voor 10% in de vorm van rutiel, is de behandeling van ilmeniet duidelijk een belangrijke kwestie in de metallurgie.

Figuur 1: Museummonster van rutiel, ~ 90 % TiO2

Figuur 2: Museummonster van ilmeniet, FeTiO3 (59.4 % TiO2)
Ilmenietafzettingen kunnen massief zijn zoals in de provincie Quebec (figuur 3) of als zwart zand (figuur 4) geassocieerd met magnetiet, monaziet en andere waardevolle mineralen die met fysische methoden worden gescheiden (figuur 5). Bij de eerste magnetische scheiding wordt een zwakke magneet gebruikt om magnetiet af te scheiden, terwijl bij de tweede magnetische scheiding een magneet met hoge intensiteit wordt gebruikt om ilmeniet af te scheiden.

Figuur 3: Een monster van massief ilmeniet van Quebec

Figuur 4: Zwart strandzand zoals in India
Eeuwenoude methoden voor de productie van pigment
Zwavelzuurmethode
In 1916 begonnen de Titanium Pigment Corporation van Niagara Falls, New York en de Titan Company van Noorwegen gelijktijdig met de commerciële productie van dit nieuwe witte pigment. De belangrijkste witte pigmenten die toen in verf werden gebruikt, waren loodwit, zinkwit en lithopoon. Bij deze methode werd ilmeniet behandeld met geconcentreerde H2SO4 bij 110-120°C om ijzer- en titanylsulfaten te vormen:
FeTiO3 + 4H+ → Fe2+ + TiO2+ + 2H2O
De reactie vindt plaats in grote betonnen tanks bekleed met zuurbestendige baksteen (figuur 6), verwarmd door rechtstreekse injectie van stoom onder hoge druk of in een pug mill (figuur 7) . De aan het einde van de reactie in de reactor geproduceerde gestolde massa wordt vervolgens uit de reactor verwijderd door deze op te lossen in water of verdund zuur. Na verwijdering van het onoplosbare residu door filtratie werd de oplossing die 120-130 g/L TiO2 en 250-300 g/L FeSO4 bevatte onder vacuüm bij 10°C geconcentreerd om FeSO4-7H2O te kristalliseren, dat vervolgens werd gecentrifugeerd. Titaanoxide wordt vervolgens uit de oplossing neergeslagen door verdunning en bezinking, wat resulteert in de vorming van verdund H2SO4 voor verwijdering (figuren 8 en 9). De grootste producent van pigment in Salvador, Brazilië, maakt echter nog steeds gebruik van deze technologie omdat hij de afvalproducten in de oceaan dumpt en deze door het getij worden verwijderd.

Figuur 5: Verwerking van zwart zand om de waardevolle bestanddelen ervan terug te winnen

Figuur 6: Grote betonnen tanks bekleed met zuurbestendige baksteen
Figuur 7: Verwarmde pug mill

Figuur 8: Productie van TiO2 pigment door het zwavelzuurproces

Figuur 9: Titaanwit, ~ 100% TiO2
Chloreringsmethode
DuPont in de VS produceert het pigment sinds 1950 door directe chlorering van ilmenieterts, scheiding van de producten door gefractioneerde destillatie en vervolgens oxidatie van TiCl4 (figuur 10):

Figuur 10: Vereenvoudigd procédé van Du Pont voor de productie van pigment uit ilmeniet
2FeTiO3 + 7Cl2 + 3C → 2TiCl4 + 2FeCl3 + 3CO2
TiCl4 + O2 → TiO2 + 2Cl2
Het probleem van dit procédé is de terugwinning van chloor uit ijzerchloride of de afzet van de grote hoeveelheden van dit nevenproduct.
Scheiding van ijzer
Omwille van de verontreinigingsproblemen in verband met de verwijdering van verdund zwavelzuur en FeSO4 wordt ijzer in het erts in een vroeg stadium afgescheiden. Dit gebeurt op twee manieren: met een elektrische oven en met hydrometallurgische procédés.
Elektrisch ovenprocédé
De elektrische ovenmethode werd in de jaren 1950 ontwikkeld. Het erts werd gemengd met een bepaalde hoeveelheid antraciet die net voldoende was om de ijzeroxidecomponent van het erts te reduceren, en vervolgens in een elektrische oven bij 1 650°C geladen waar ijzeroxide wordt gereduceerd tot metaal terwijl titaan wordt afgescheiden als een slak (figuur 11). Tijdens de reductie vinden de volgende reacties plaats:

Figuur 11: Elektrisch ovenproces voor ijzerscheiding
FeTiO3 + C → Fe + CO + TiO2(slak)
Fe2O3 + 3C → 2Fe + 3CO
Deze methode wordt gebruikt door het Rio Tinto QIT in zijn fabriek in Sorel bij Montreal en in Richards Bay in Zuid-Afrika. Zij wordt ook gebruikt in de Sovjet-Unie in Zaporozhye (Oekraïne) en in Japan.
Titaniumslak bestaat hoofdzakelijk uit ijzermagnesiumtitanaat, (Fe,Mg)Ti4O10, en een kleine hoeveelheid silicaten; typische analyses zijn 72-85% totaal TiO2. Een kleine hoeveelheid TiO2 wordt gereduceerd tot Ti2O3. De reductie van de ijzeroxiden wordt niet voltooid, zodat er nog wat ijzeroxide in de slak overblijft om het smeltpunt te verlagen. Smeltpunt van TiO2 1840°C en van ilmeniet 1435°C.
De slak is hoog in titaan en laag in ijzer (figuur 12) en verdient daarom de voorkeur boven ilmeniet bij de produktie van TiO2-pigment of titaniummetaal. De in Quebec geproduceerde slak is echter niet geschikt voor chlorering vanwege het hoge gehalte aan onzuiverheden – ongeveer 16,6% in vergelijking met ongeveer 6% in andere slakken . Deze onzuiverheden verbruiken niet alleen onnodige hoeveelheden chloor, maar leveren ook een verwijderingsprobleem op. Bovendien zullen sommige van deze onzuiverheden, bv, calcium en magnesium interfereren met het chloreringsproces zelf, dat bij 800°C wordt uitgevoerd door een gesmolten fase te vormen (CaCl2 m.p. 770°C, MgCl2 m.p. 708°C).

Figuur 12: Gemalen titaniumslak, FeTi4O10 (70-80 % TiO2)
Om deze redenen werd titaniumslak alleen gebruikt voor het maken van pigment door middel van het zwavelzuurprocédé. De slak werd op dezelfde wijze behandeld als ilmeniet, met dien verstande dat geen afscheiding van ijzersulfaat nodig was omdat het grootste deel van het ijzer reeds door reductie in de vorige stap was afgescheiden (figuur 13). Het zwavelzuurbehandelingsproces van de slakken had echter nog steeds te kampen met het probleem van de verwijdering van het afvalzuur en werd daarom in de jaren tachtig opgegeven en vervangen door een nieuwe technologie die gebaseerd was op het opwaarderen van de slakken tot 94,5% TiO2 door de meeste onzuiverheden weg te logen met HCl onder druk om ze geschikt te maken voor chlorering.

Figuur 13: Uitlogen van titaniumslak voor de productie van TiO2-pigment, nu verouderd
Hydrometallurgische route
De hydrometallurgische route werd in de jaren 1960 ontwikkeld en omvatte het uitlogen van ijzer uit ilmeniet en het verkrijgen van een residu dat rijk was aan titaan (90-95% TiO2), bekend als “synthetisch rutiel”. In één geval, het Altair-proces, werd een TiO2 van pigmentkwaliteit verkregen. Al deze processen maken gebruik van een oxyhydrolyseproces voor de behandeling van ijzer(III)chloride om HCl voor recycling te verkrijgen en Fe2O3 als bijproduct.
Hogedrukmethode
In deze methode wordt hoogwaardig ilmeniet ontleed in autoclaven met 20% HCl bij 120°C en 200 kPa; ijzer wordt opgelost in de vorm van ijzerchloride, waardoor een vaste stof overblijft die ongeveer 95% TiO2 bevat, dat de chemische analyse heeft van rutiel, vandaar dat het synthetisch rutiel wordt genoemd (figuur 14):

Figuur 14: Synthetisch rutiel
FeTiO3 + 2H+ → TiO2 + Fe2+ + H2O
Laagwaardig ilmeniet kan met deze methode niet worden behandeld omdat alle silicaten en onoplosbare stoffen het product zullen verontreinigen. Het synthetische rutiel wordt vervolgens behandeld met chloor om TiCl4 te bereiden waaruit TiO2 of titaniummetaal wordt verkregen zonder verontreinigingsproblemen. Het proces wordt gebruikt in de VS, Engeland, Japan, Taiwan en Australië. Oxyhydrolyse zou op verschillende manieren kunnen worden uitgevoerd, zoals hieronder beschreven.
Atmosferisch proces
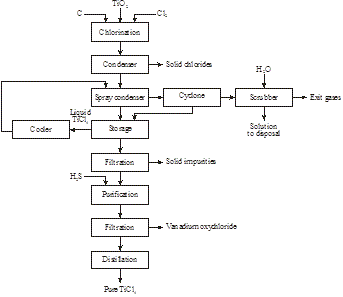
In 2014 werd door Magpie Incorporation in Canada ontdekt dat laagwaardig ilmeniet bij 80°C kan worden opgelost met geconcentreerd HCl bij atmosferische druk. Na filtratie om onoplosbaar materiaal te verwijderen, wordt de oplossing gedestilleerd om HCl terug te winnen en titanyl-ion te hydrolyseren tot TiO2. Na filtratie wordt het residu gecalcineerd om synthetisch rutiel te produceren (figuur 16):

Figuur 15: Productie van synthetisch rutiel uit ilmeniet

Figuur 16: Productie van 98+% TiO2 uit een laagwaardig ilmeniet
FeTiO3 + 4HCl → TiO2+ + Fe2+ + 4Cl- + 2H2O
TiO2+ + 2Cl- + H2O → TiO2 + 2HCl
Het is duidelijk dat de nieuwe uitlogingstechnologie bij omgevingsdruk superieur is aan de oude opwaardering met elektrische oven-smelterij-autoclaaf.
Oxyhydrolyse
De ijzerchloride-oplossing wordt geregenereerd tot HCl en Fe2O3 door oxyhydrolyse:
2FeCl2 + 2H2O + 1/2O2 → Fe2O3 + HCl
Het is dezelfde technologie die wordt gebruikt voor de behandeling van pekeloplossing. Er worden twee methoden gebruikt
Fluïdized-bed oxyhydrolyse
In een fluidized-bed reactor wordt de ijzerchloride-oplossing ingebracht in een groot bed van heet ijzeroxide waar de verwarming wordt verzorgd door de hete fluïdiserende verbrandingsgassen (figuur 17). Aangezien het verbrandingsgas door het goed geagiteerde oxidebed stroomt, bereikt het snel een thermisch evenwicht met het bed. De oplossing wordt bovenop het bed van oxiden gevoed. De vloeibare voeding maakt de buitenste laag van de hete oxidedeeltjes nat en wordt snel verdampt om een ui-achtige laag van nieuw vast oxide bovenop het bestaande oxide te vormen, waardoor dichte homogene deeltjes worden geproduceerd.

Figuur 17: Fluidized-bed reactor voor oxyhydrolyse van ijzerchloride
Spray roaster oxyhydrolyse
In dit type oxyhydrolyse roaster wordt de ijzerchloride-oplossing in een leeg cilindrisch vat gespoten, terwijl de vereiste energie wordt geleverd door de opwaartse stroom van hete gassen die in de onderste branders worden gegenereerd (figuur 18). Spuitroosters hebben grote diameters om de gassnelheden laag te houden. Als de gassnelheid hoog is, worden te veel deeltjes geëlueerd met het rookgas, waardoor de productkwaliteit en de efficiëntie van de brander afnemen. Het afgas en de oxiden verlaten de brander tegen elkaar in bij ongeveer 400°C tot 500°C. De verblijftijd van de verstoven deeltjes in de reactiezone bij hoge temperatuur is zeer kort; daarom moeten zeer kleine vloeistofdruppeltjes, die snel verhit kunnen worden, door verstuiving ontstaan. De snelle verhitting leidt tot de vorming van een vaste oxidekorst op het oppervlak van elke druppel. Naarmate de bulk van de druppel verhit, verdampt de waterinhoud en breekt door de oxidehuid. Daarom is de nevel geroosterd oxyde samengesteld uit zeer fijne “pluizige,” holle bolletjes.

Figuur 18: Regeneratie van HCl uit ijzerchloride-oplossing door oxyhydrolyse in spray roaster
Productie van titaan
Metallisch titaan wordt geproduceerd door chlorering van rutiel, synthetisch rutiel, of titaniumslak en vervolgens reductie in een metallothermische reactor van TiCl4 door magnesium tot titaan (figuren 19 en 20) :
TiO2 + C + 2Cl2 → TiCl4 + CO2
Figuur 19: Productie van TiCl4 uit rutiel, synthetisch rutiel of titaniumslak

Figuur 20: Productie van titaan uit TiCl4
TiCl4 + Mg → Ti + MgCl2
Magnesiumchloride wordt vervolgens geëlektrolyseerd om het magnesium en chloor terug te krijgen voor hergebruik. Figuur 21 toont de metallothermische reactor die na de reductie uit de oven wordt verwijderd en waaruit de titaniumspons wordt teruggewonnen (figuur 22).

Figuur 21: Metallothermische reactor wordt uit de oven verwijderd

Figuur 22: Titaniumspons (boven) en MgCl2 (onder) uit de reactor verwijderd
- Barksdale J (1966) Titanium, Its Occurrence, Chemistry and Technology, Ronald Press, New York.
- Sibum H (1997) “Titanium”, blz. 1129-1179 in Handbook of Extractive Metallurgy onder redactie van F. Habashi, gepubliceerd door WILEY-VCH, Weinheim, Duitsland.
- Habashi F (1993) A Textbook of Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Québec City, Canada.
- DuPont (2007) Brochure™ Ti-Pure® titaniumdioxide.
- Habashi F (2002) Textbook of Pyrometallurgy, Métallurgie Extractive Québec, Québec City, Canada.
- Toromanoff I, Habashi F (1985) Transformation of a Low-Grade Titanium Slag into Synthetic Rutile Intern. J. Mineral Processing 15: 65-81
- Habashi F (1996) Pollution Problems in the Mineral and Metallurgical Industries, Metallurgy Extractive Quebec, Quebec City.
- Habashi F (1993) Pressure Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Québec City, Canada.
- Habashi F, Kamaleddine F, Bourricaudy E (2015) A New Process to Upgrade Ilmenite to Synthet-ic Rutile Proceedings Conference of Metallurgists, Canadian Institute of Mining, Metallurgy, and Petroleum, Montreal. Reprinted in Metall 69: 27-30
- Habashi F (1993) Two Hundred Years Titanium. De verwerking van titaniumertsen voor de productie van pigmenten en metalen. Arab Min J 11: 74-84