- Wat maakt een molecuul polair?
- Kijk eens naar de structuurformule van koolstofdioxide:
- Waarom is water polair?
Water is een polair molecuul omdat het zuurstof sterk elektronegatief is en als zodanig het elektronenpaar naar zich toe trekt (weg van de twee waterstofatomen), waardoor het een licht negatieve lading krijgt.
De polariteit van een molecuul hangt niet alleen af van de atomen waaruit het bestaat, maar ook van de manier waarop ze rond het centrale atoom zijn gerangschikt, d.w.z. de ruimtelijke rangschikking van die atomen. Om dit beter te begrijpen, zullen we het onderwerp nader bespreken.
Wat maakt een molecuul polair?
De polariteit van een molecuul houdt verband met de verschuiving van elektronen in een bepaalde richting. Dit hangt weer af van de polariteit van de bindingen die in het molecuul aanwezig zijn, omdat deze bindingen ook elektronen bevatten.
In een molecuul is het atoom met de grotere kracht om elektronen naar zich toe te trekken (d.w.z, het is elektronegatiever dan het andere atoom) een lichte negatieve lading op zich krijgen, en de binding tussen de twee atomen wordt polair.
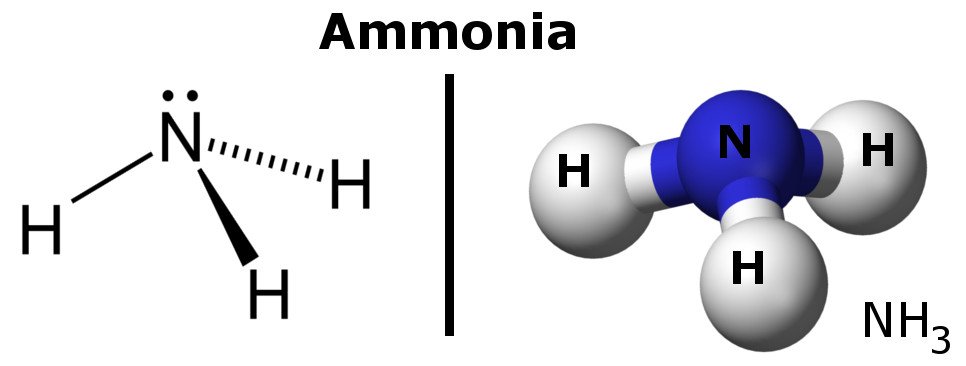
Ammonium is een polair molecuul omdat het gebieden heeft met lichte negatieve en positieve ladingen.
Al met al zou je kunnen zeggen dat de elektronendichtheid van een polaire binding zich ophoopt naar één uiteinde van de binding, waardoor dat uiteinde een lichte negatieve lading heeft, terwijl het andere uiteinde een lichte positieve lading heeft. Dit maakt een molecuul polair.
Ook als een molecuul geen gebieden met positieve en negatieve lading heeft, wordt het als niet-polair beschouwd.
Het is echter interessant op te merken dat hoe groter het verschil in elektronegativiteit is, hoe polairder de binding in een molecuul zal zijn. Carbonylverbindingen zijn polair omdat de carbonylkoolstof licht positief is. Dus zou kooldioxide, dat een positieve koolstof en twee gedeeltelijk negatieve oxygenen bevat, niet polair moeten zijn?
Welnu, kooldioxide bestaat uit twee zuurstofatomen die aan een koolstofatoom zijn gebonden. Zuurstofatomen zijn veel elektronegatiever dan koolstofatomen, en als zodanig zouden zij een gedeeltelijk negatieve lading moeten hebben, terwijl het koolstofatoom licht positief geladen zou moeten zijn. Maar interessant genoeg gebeurt dat niet.
Kijk eens naar de structuurformule van koolstofdioxide:
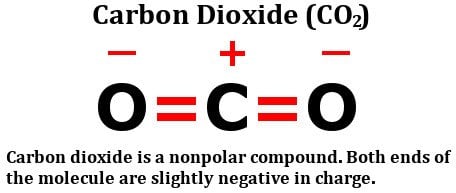
Het bestaat uit twee even elektronegatieve zuurstofatomen, ja, maar kijk eens hoe deze atomen rond het koolstofatoom zijn gerangschikt. Ze staan beide in een perfecte hoek van 180 graden ten opzichte van koolstof. Bijgevolg trekken ze de elektronendichtheid van koolstof met gelijke kracht in tegengestelde richtingen. Het netto resultaat is dat de elektronendichtheid op het koolstofatoom onaangetast blijft, waardoor het kooldioxidemolecuul niet polair is.
Kooldioxide is een goed voorbeeld van hoe de geometrie van een molecuul een cruciale rol speelt bij het bepalen of het polair of niet-polair is. Laten we nu eens kijken naar een molecuul water:
Waarom is water polair?
De chemische formule van water is H20, wat betekent dat het twee waterstofatomen en een zuurstofatoom bevat. De waterstofatomen hebben slechts één elektron in hun schil, terwijl het zuurstofatoom 6 valentie-elektronen heeft.
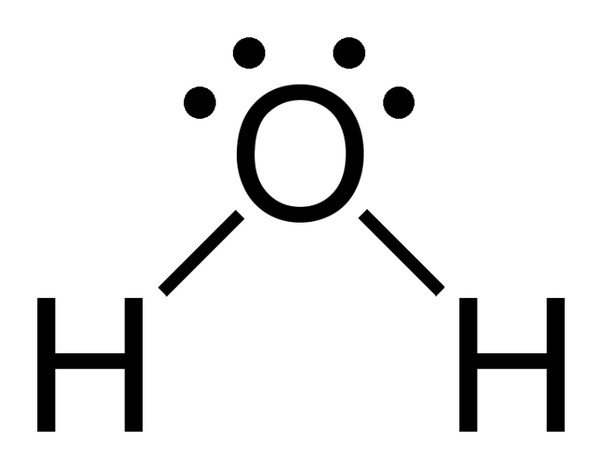
Let op de 2 eenzame elektronenparen op het zuurstofatoom in water.
Omdat zuurstof 6 elektronen in zijn valentieschil heeft, deelt het een elektron met elk waterstofatoom. Op deze manier houdt het 4 ongebonden elektronen over in zijn 2 banen. Deze gebonden en ongebonden elektronenparen rangschikken zich in een tetrahedral vorm rond zuurstof, dat is waarom de twee bindingen een gebogen vorm lijken te hebben.
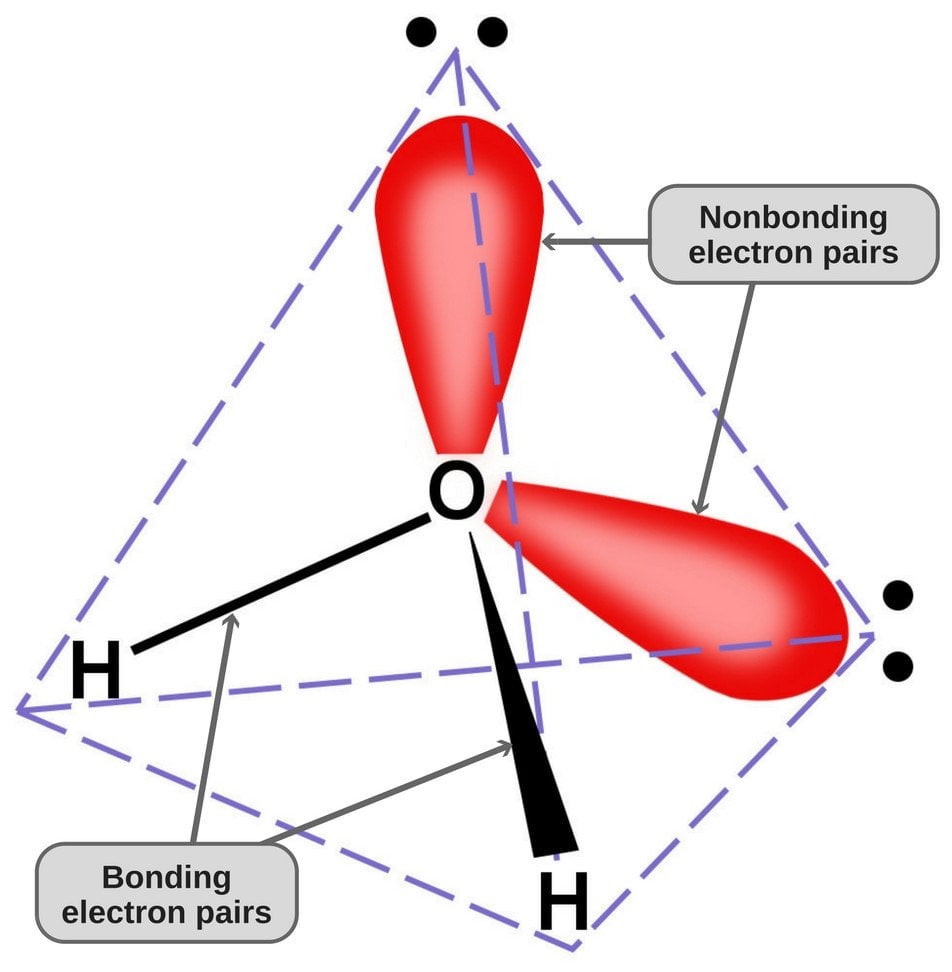
De tetrahedrale geometrie van het watermolecuul.
Nou, zowel zuurstof- als waterstofatomen hebben verschillende elektronegativiteiten (de elektronegativiteitswaarde van waterstof is 2,1, terwijl de elektronegativiteit van zuurstof 3,5 is); daarom zijn beide bindingen polair. Aangezien zuurstof elektronegatiever is dan waterstof, verschuift de elektronendichtheid in beide bindingen naar zuurstof, waardoor het gebied rond de zuurstof negatiever wordt dan het gebied rond de twee waterstofatomen.
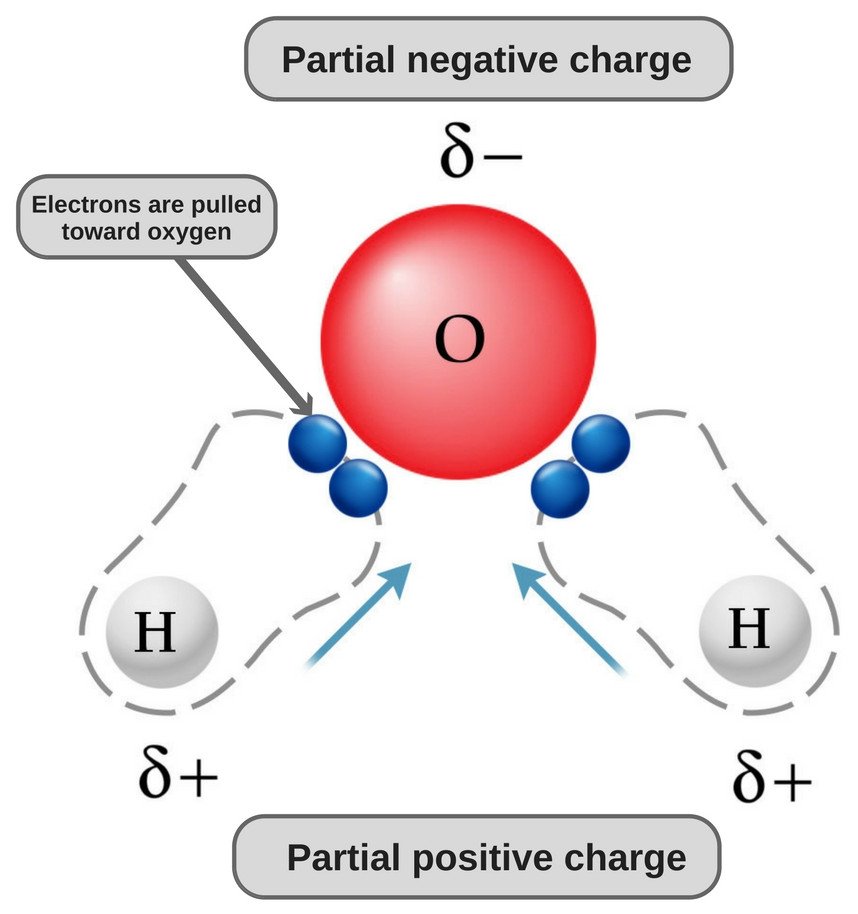
Daarom wordt de watermolecule polair!