Interleukine 12 (IL-12) is een pro-inflammatoire cytokine met een molecuulgewicht van 70 kDa, bestaande uit twee subeenheden, IL-12p35 (35 kDa) en IL-12p40 (40 kDa). De unieke heterodimere structuur wordt gedeeld met drie familieleden, namelijk IL-23 (p19/p40), IL-27 (p28/Ebi3) en IL-35 (p35/Ebi3).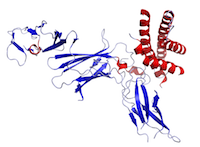
IL-12, ook wel IL-12p70 genoemd, werd onafhankelijk ontdekt in 1989 door Kobayashi M. et al. (natural killer cell stimulatory factor genoemd) en in 1990 door Stern A.S. et al. (aangeduid als cytotoxische lymfocyten maturatiefactor).
Figuur Dit is een structuur van IL-12, gemaakt met behulp van de gegevens van de Protein Data Bank (PDB: 1F45) en weergegeven met PyMOL.
IL-12 induceert de differentiatie van naïeve CD4+ T-cellen in Th1-cellen en activeert NK-cellen. Bij activatie produceren NK cellen IFN-γ en IL-2 maar ook IL-12 wat wijst op een positief terugkoppelingsmechanisme. IL-12 beschermt CD4+ Th1 cellen tegen antigeen-geïnduceerde apoptotische dood en bleek synergetische effecten te hebben met IL-18 in de ontwikkeling van Th1 cellen. Bovendien speelt IL-12 een rol in T cel trafficking en migratie door het induceren van functionele adhesie moleculen zoals P- en E-selectine ligand expressie op Th1 cellen maar niet op Th2 cellen. Daarom worden Th1 cellen selectief gerekruteerd naar plaatsen die een Th1 immuunrespons bevorderen. Functioneel helpen deze cellen bij het opruimen van intracellulaire pathogenen; in tegenstelling tot Th2 cellen die verantwoordelijk zijn voor humorale immuniteit ter bescherming tegen extracellulaire indringers. Het evenwicht tussen IL-12, dat de Th1-respons bevordert, en IL-4, dat de Th2-respons bevordert, bepaalt de vroege voorkeur die in de immuunrespons tot uitdrukking komt.
IL-12p35 delen een aanzienlijke sequentiehomologie met het cytokine IL-6, terwijl de p40-keten structureel homoloog is met het extracellulaire domein van de IL-6-receptor (IL-6R) α-keten. Dit suggereert dat de structuur van IL-12 is geëvolueerd uit een primordiaal cytokine van de IL-6 familie en een van zijn receptoren. Hoewel IL-12p35-transcripten in vele celtypes worden aangetroffen, wordt vrij IL-12p35 niet gesecreteerd zonder de IL-12p40-subeenheid. Deze laatste subeenheid wordt voornamelijk geproduceerd door geactiveerde monocyten, macrofagen, neutrofielen en dendritische cellen. De biologische activiteiten van IL-12p70 worden gemedieerd via binding aan een membraanreceptorcomplex (IL-12R) dat bestaat uit twee subeenheden: IL-12R-β1 en IL-12R-β2. Terwijl de IL-12Rβ1 subeenheid constitutief tot expressie komt, wordt de expressie van IL-12R-β2 op Th1 cellen geprikkeld door IFN-γ en gecorreleerd met de respons op IL-12. Na binding van IL-12 wordt de JAK-STAT signaalroute geactiveerd, waarbij STAT4 de belangrijkste mediator van de T-celrespons is.