Het is belangrijk om de Lewisstructuur van een molecuul te kennen om de fysische eigenschappen, hybridisatie en vorm van het molecuul te begrijpen. Vandaag gaan we de Lewis-structuur van I3- of ook wel Triodide-ion genoemd omdat het negatief geladen is. Er zijn drie jodiummoleculen in dit molecuul en vandaar dat de verbinding Triodide wordt genoemd. Om de Lewis-structuur van het molecuul te begrijpen, moeten we de valentie-elektronen van het joodmolecuul kennen.
Lewis-structuur
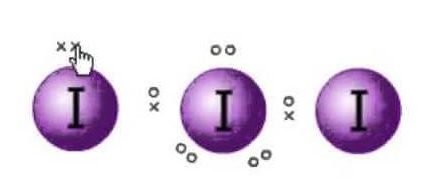
Lewis-structuur is de weergave van de elektronen van de moleculen. Er zijn eenzame paren en valentie-elektronen die helpen bij het bepalen van de hybridisatie en de vorm van het molecuul. Aangezien er joodmoleculen zijn, zal één joodmolecuul in het centrum liggen. Bovendien zit jood in de zevende groep van het periodiek systeem en heeft het zeven valentie-elektronen in zijn buitenste baan.

We hebben hier drie joodmoleculen die samen met een extra elektron een negatieve lading hebben. Dus het totaal aantal valentie-elektronen zijn : 7×3 + 1= 22.
Er zijn in totaal 22 valentie-elektronen in dit molecuul. Nu is er een octet-regel die elk atoom volgt. Volgens deze regel moet elk atoom acht elektronen in zijn buitenste baan hebben. Als er 8 elektronen in de buitenste schil van het centrale atoom zitten, zijn er nog twee andere atomen die hun octet moeten voltooien. Aangezien alle atomen acht elektronen in hun buitenste schil nodig hebben om het octet te vervolledigen, zal één elektron van het centrale jodiumatoom worden ingenomen door de beide naburige jodiumatomen. Dat betekent 8-1-1=6.
Zoals de elektronen zullen worden ingenomen door beide atomen.
Dus nu zullen de valentie-elektronen op het centrale jodiumatoom zes zijn. Deze zes elektronen zullen de eenzame elektronenparen vormen die zich niet binden. Aangezien het nu elektronenparen vormt, zullen er drie eenzame paren zijn, en twee bindingsparen van de elektronen aangezien elk jodiumatoom een binding heeft met het centrale atoom dat elk een elektron deelt in totaal zijn er 3 eenzame paren en 2 bindingsparen op het centrale atoom.
Hybridisatie
Om de hybridisatie van een molecule te kennen, is er een eenvoudige formule die kan worden gebruikt. Deze formule wordt gebruikt om het hybridisatiegetal te bepalen, dat helpt om de hybridisatie van het molecuul te kennen.
De hybridisatiegetallen en de hybridisatie die ermee wordt bepaald, worden als volgt verklaard:
- 2: sp-hybridisatie
- 3: sp2-hybridisatie
- 4: sp3-hybridisatie
- 5: hybridisatie
De formule voor het vinden van het getal is,
Hybridisatiegetal: Aantal valentie-elektronen + monovalent + (negatieve lading) – (positieve lading)/2
De valentie-elektronen van de jodiumatomen zijn 7, omdat er zeven elektronen in de buitenste schil zitten. Het aantal monovalente atomen is twee, omdat twee van de drie joodatomen monovalent zijn. Als we nu bij de lading van het I3-ion komen, heeft het een negatieve lading, dus de waarde van deze negatieve lading zal 1 zijn.
Plaats nu alle waarden volgens de formule,
7+1+2/2
=10/2
=5
Het hybridisatiegetal is dus 5, wat betekent dat de hybridisatie sp3d is.
Een andere manier om de hybridisatie van een bepaald molecuul te bepalen is met behulp van de lone paren en valentie-elektronen. Het aantal eenparen in dit molecuul is 3, en het aantal atomen dat valentie-elektronen deelt is 2.
Hieruit volgt dat 3+2=5, hetgeen ook de sp3d hybridisatie bepaalt.
De vorm van I3-ion

De vorm van het molecuul I3- is lineair. Er zijn drie jodiumatomen, waarvan er één een extra negatieve lading heeft. Door dit ene extra elektron zijn er 3 eenzame elektronenparen en 2 bindingsparen waardoor het sterische getal 5 is. Omdat er drie eenzame paren op het centrale jodide-atoom zitten, proberen deze paren elkaar zo veel mogelijk af te stoten. Dus om op een grotere afstand te zijn, nemen de paren de equatoriale posities in, en de andere twee jodiumatomen staan 180 graden van elkaar. De algemene vorm van het I3-ion is dus lineair.
Polariteit
Hier is dus het lastige gedeelte over dit ion, ten eerste omdat het een lading heeft kunnen we het een polyatomisch ion noemen in plaats van een molecuul. Ionen zijn de ladingen die we zien op de moleculen. Aangezien I3- één elektron heeft, heeft dit ion een negatieve lading. Moleculen hebben polariteit omdat het zowel de ladingen heeft van een gedeeltelijk positief geladen uiteinde als van een gedeeltelijk negatief geladen uiteinde. Er is een dipoolmoment op de moleculen afhankelijk van de scheiding van de ladingen op het molecuul. Als de afstand tussen de beide ladingen groter is, zal het dipoolmoment ook groter zijn.
Maar als we het over het I3-ion hebben, is het een negatief geladen ion. Zelfs als we de Lewis-structuur tekenen, zien we er geen dipoolmoment of polaire bindingen in, omdat de totale lading van het ion zelf negatief is. Het is dus noch polair, noch niet-polair. Als je het ion echter moet beschrijven, kun je de uitdrukking “als een polair molecuul” gebruiken, omdat I3- oplosbaar is in water.
In afsluitende opmerkingen, om dit hele artikel samen te vatten, I3- is een polyatomair ion dat 22 valentie-elektronen heeft, 3 eenzame paren, 2 bindingsparen, en sp3d hybridisatie. Het is lineair van vorm en heeft geen polariteit.