Inhoud
- 1 Inleiding
- 2 Structurele hoofdpunten
- 3 Functie
- 4 Relevantie voor de menselijke gezondheid & Ziekte
- 5 Externe links
Inleiding
Menselijk maaglipase (HGL, E.C. 3.1.1.3) (PBD ID: 1hlg) is het lipase dat verantwoordelijk is voor het op gang brengen van de vertering van voedingsvetten in de maag. Dit zuurstabiele enzym wordt afgescheiden door de hoofdcellen van de menselijke maag en katalyseert 10-20% van alle lipolytische processen (d.w.z. die waarbij vet wordt afgebroken) bij gezonde volwassenen. HGL katalyseert specifiek de hydrolyse van triacylglycerol om diacylglycerol en een carboxylaatbijproduct te produceren, een proces dat de daaropvolgende vetafbraak door pancreaslipase vergemakkelijkt. Wat de gevolgen voor de ziekte betreft, zijn er aanwijzingen dat de secretie van HGL verandert bij personen met gastritis (de meest voorkomende maagaandoening, waarbij het maagslijmvlies ontstoken is). Bovendien moeten personen met een verminderde pancreasfunctie (en daardoor verminderde niveaus van pancreaslipase) sterk afhankelijk zijn van HGL om vetten uit de voeding te verteren.
Structurele bijzonderheden
HGL, een hydrolase-enzym dat bestaat uit twee 379 aminozuurresidu-lange subeenheden, bezit een die de residuen Ser-153, His-353, en Asp-324 bevat. Deze structuur is essentieel voor de afbraak van lipiden, gecoördineerd met een op Leu-67 en Gln-154 , die dient om de overgangstoestand te stabiliseren. Structureel vertoont het humane maaglipase een complex (beta sheets in geel, alpha helices in oranje, coiled coils in groen, en opgeloste koolhydraten in paars). Het van HGL op residuen 215-244 maakt plaats voor de (hydrofobe gebieden die in rood zijn aangegeven) zowel rond de actieve site als interfacing het deksel. Aangenomen wordt dat deze gebieden lipiden aantrekken en docking bevorderen.
Functie
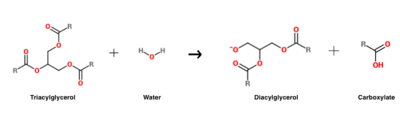
De hydrolysereactie van triacylglycerol die door HGL wordt gekatalyseerd.
HGL werkt bij een optimale pH van ongeveer vijf, en katalyseert hoofdzakelijk de hydrolyse van triacylglycerolen met een korte keten.
Als een esterase met een katalytisch actief serine, vertoont HGL een mechanisme dat lijkt op het bekende mechanisme van serine-esterase. Het actieve serine, dat zich in het actieve gebied bevindt, wordt eerst gefaciliteerd door de naburige vorming van een zoutbrug tussen Asp-136 en His-152, die de toe-eigening van een proton van Ser-153 induceert. Het nu zeer nucleofiele Ser-153 zal de carbonylkoolstof van de acetaatgroep in een triacylglycerolmolecuul aanvallen. De tetrahedral species wordt gestabiliseerd door het oxyanion gat. Zodra de groep echter uiteenvalt in het covalent gebonden acetaat en lipase, ondergaat het serine deacylering waarbij water als nucleofiel fungeert. Deze laatste stap herstelt Ser-153 in zijn geprotoneerde toestand.
Relevantie voor de menselijke gezondheid & Ziekte
De hydrolytische werking van HGL is enigszins bijkomstig bij gezonde volwassenen, bij wie HGL hooguit 10-20% van de vetafbraak via de voeding moduleert. De aanwezigheid van HGL is echter van cruciaal belang bij premature kinderen, die vaak een slechte pancreasfunctie hebben, en bij volwassenen met pathologische pancreasinsufficiëntie (bijv. chronische pancreatitis). Deze personen zijn niet in staat om voldoende hoeveelheden pancreaslipase te produceren en moeten daarom voor de vertering van vetten uit de voeding voornamelijk op HGL vertrouwen. Bij deze personen is HGL verantwoordelijk voor de hydrolyse van 30-60% van de triglyceriden in de voeding.
Tomasik et al. (2013) onderzochten de hormonale regulatie van HGL-secretie bij kinderen en adolescenten met gastritis. HGL activiteit werd vergeleken in drie groepen: een experimentele groep bestaande uit adolescenten gediagnosticeerd met Helicobacter pylori gastritis (n = 10), een andere experimentele groep bestaande uit adolescenten met een niet-H. pylori geïnduceerde vorm van gastritis (n = 10), en een controlegroep van gezonde adolescenten (n = 14). HGL activiteit, naast plasma concentraties van glucagon-like peptide-1, cholecystokinine, en glucose-afhankelijk insulinotroop peptide, werden waargenomen door analyse van maagsap monsters die waren verzameld via endoscopische metingen van elke patiënt.
Patiënten bij wie oppervlakkige gastritis werd geïnduceerd door andere pathogenen dan H. pylori vertoonden lagere niveaus van HGL-activiteit in vergelijking met zowel gezonde adolescenten (p < .005) als degenen die werden gediagnosticeerd met H. pylori-gastritis (p < .005). De gemiddelde plasmaconcentraties van glucose-afhankelijk insulinotropisch peptide waren lager bij gezonde patiënten (p < 0,005) dan bij degenen met niet-H. pylori-gastritis (p < .003) en degenen met H. pylori-gastritis (p < 0,01). De regulatie van HGL secretie door glucagon-like peptide-1 (GLP-1) en cholecystokinine (CCK) bleek daarom veranderd te zijn bij adolescenten met gastritis; ter ondersteuning van deze bevinding is in de bestaande literatuur gesuggereerd dat GLP-1 en CCK de HGL secretie remmen. Bovendien bleek glucose-afhankelijk insulinotroop peptide een krachtige activator te zijn van menselijke maaglipase activiteit in alle experimentele en controlegroepen .
PDB – 1HLG: http://www.rcsb.org/pdb/explore.do?structureId=1HLG