- Introduction
- Materialen en Methoden
- Deelnemers
- Magnetic Resonance Imaging
- Data Acquisition and Processing
- Atlas extractie
- Statistische analyse
- Results
- Patients With SCA3 Revealed Significant Lesions in Typical Infratentorial Lesions Regions
- Patiënten met SCA3 vertoonden cerebrale gelateraliseerde supratentoriale laesies
- Discussie
- Conclusies
- Data Availability Statement
- Ethics Statement
- Author Contributions
- Funding
- Conflict of Interest
- Acknowledgments
- Supplementary Material
Introduction
Spinocerebellaire ataxie type 3 (SCA3) is een erfelijke neurodegeneratieve aandoening veroorzaakt door CAG-expansie in de coderende regio van chromosoom 14q32.1 (1, 2). Klinisch vertonen patiënten met SCA3 het cerebellaire syndroom, parkinsonisme, ataxisch lopen, dysartrie, dysmetrie, nystagmus, perifere neuropathie, pyramidale en extrapyramidale manifestaties (3-5). Patiënten met SCA3 leden ook aan emotionele stoornissen, zoals depressie en angst (6, 7). Deze hogere-orde disfuncties van SCA3 suggereren de verdere betrokkenheid van extracerebellaire structuren in plaats van het conventionele “olivopontocerebellaire” patroon van neurodegeneratie (8-12). Bovendien is de SCA3 stoornis beschreven als cerebellair cognitief affectief syndroom (CCAS) (6, 8).
Studies hebben positron emissie tomografie (PET) en single-photon emissie computertomografie gebruikt om subklinische afwijkingen in de cerebrale cortex te identificeren (13, 14). Echter, deze studies rapporteerden dat de verstoring van de cerebrocerebellaire pathway de cognitieve en affectieve stoornissen bij patiënten met SCA3 niet volledig kan verklaren. Bijvoorbeeld, visuospatiale stoornissen bij patiënten met SCA3 zijn duidelijk geassocieerd met de pariëtale kwab en zijn minder verbonden met het cerebellum. Weinig studies hebben zich gericht op de rol van supratentoriale gebieden bij SCA3. De kwantificering van de degeneratie in supratentoriale gebieden kan van cruciaal belang zijn voor de evaluatie van dysfunctie bij patiënten met SCA3. In neuroimaging studies is het meten van regionale corticale atrofie cruciaal voor het evalueren van het verband met cognitieve stoornissen en emotionele disfunctie.
Diffusie tensor imaging (DTI) kan de visualisatie en karakterisering van witte stof (WM) vergemakkelijken, en DTI is ook een efficiënte methode voor het bestuderen van SCA3 (15). SCA3 is geverifieerd als een WM dominante atrofie neurodegeneratieve ziekte (16). Eerdere studies toonden aan dat patiënten met SCA3 verminderingen in fractionele anisotropie (FA) vertonen in de gebieden van het cerebellum en de hersenstam, maar toenames in radiale diffusiviteit (RD) in het cerebellum, de hersenstam, de thalamus, en de frontale en temporale kwabben (17). In een ander DTI-onderzoek werd een wijdverspreide FA-verlaging vastgesteld in de bilaterale cerebrale-frontale, -pariëtale, -temporale en -occipitale hersengebieden; de cerebellaire hersengebieden, de thalamus en de hersenstam bij patiënten met SCA3 (16). Bovendien werden gemiddelde diffusiviteit (MD) toenames gedetecteerd in een vergelijkbaar, wijd overlappend patroon in bilaterale cerebraal-frontale, -pariëtale, -temporale, en -occipitale WM; cerebellaire WM; de thalamus; en de hersenstam (16).
In deze studie beoordeelden we atrofie in relatief focale regio’s en verklaarden we supratentoriale betrokkenheid in SCA3. Deze studie gebruikte de fractale dimensie (FD) methode, die het voordeel heeft resultaten te produceren met minimale variatie (18), om corticale morfologische veranderingen te kwantificeren en de regionale corticale atrofie van supratentoriale regio’s te meten. In de huidige studie hebben we de 3D-FD waarden gemeten van de 97 segmenten van de grijze stof van de gehele hersenen voor elke deelnemer. Wij vergelijken verder deze grijze stof laesies resultaten met DTI analyse van witte stof laesies in SCA3 van onze recente studie. We verwachtten dat de beoordeelde gebieden met GM-laesies in deze studie gerelateerd zijn aan gebieden met WM-laesies uit DTI-studie, en het resultaat kan de associatie verifiëren tussen motorische stoornissen en supratentoriale atrofie bij patiënten met SCA3.
Materialen en Methoden
Deelnemers
Er namen in totaal 48 patiënten met SCA3 en 50 geslachts- en leeftijdsgematchte gezonde personen, als controlegroep, deel aan deze studie. Deze studie werd uitgevoerd in overeenstemming met de Verklaring van Helsinki en werd goedgekeurd door de Institutional Review Board van het Taipei Veterans General Hospital. Alle deelnemers gaven schriftelijke toestemming voor deelname aan deze studie. Alle deelnemers werden gerekruteerd bij de afdeling Radiologie van het Taipei Veterans General Hospital. De SARA (schaal voor de beoordeling en waardering van ataxie) werd toegepast voor de klinische beoordeling van ataxie van patiënten met SCA3 (19). De symptomen van het voortschrijden van de ziekte van Parkinson bij SCA3 werden gemeten door gebruik te maken van gemodificeerde Hoehn en Yahr stadiëring (20). De SARA-score, een cijfer voor de ernst van de ataxiesymptomen, variërend van 0 tot 40, werd gebruikt als referentie om de progressie van de klinische ernst aan te geven in vergelijking met de cerebellaire degeneratie. Een zelfgerapporteerde leeftijd van begin, de leeftijd waarop de patiënten de eerste tekenen van een ataxiesymptoom vertoonden, werd van elke patiënt verkregen (21). De CAG herhalingslengte van elke SCA3 patiënt werd bepaald door polymerase kettingreactie, zoals eerder beschreven (22). Tabel 1 toont de demografische, klinische en MR beeldvormingsgegevens van beide groepen. Patiënten met SCA3 voldeden aan de inclusiecriteria indien zij progressieve en anderszins onverklaarde ataxie hadden en positief testten voor het SCA3 genotype. De ziekteduur bij patiënten met SCA3 was 8,89 ± 6,432 jaar. De patiënten in de controlegroep hadden geen ziekte van het centrale zenuwstelsel en vertoonden geen neurologische afwijkingen tijdens de studieperiode. Een ervaren neuroradioloog onderzocht de T1- en T2-gewogen beelden van de controlegroep om er zeker van te zijn dat er geen tekenen van een andere neurologische ziekte of onverwachte afwijkingen waren.
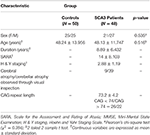
Tabel 1. Demografische, klinische en MR-beeldgegevens van de controlegroep en de patiëntengroep.
Magnetic Resonance Imaging
Data Acquisition and Processing
Axiale MR-beelden van de menselijke hersenen die de gehele kleine hersenen en kleine hersenen bestreken, werden verkregen met een 1,5-T Vision-scanner van Siemens (Erlangen, Duitsland). Deelnemers werden gescand met een circulair gepolariseerde hoofdspoel om T1-gewogen beelden te verkrijgen (TR = 14,4 ms; TE = 5,5 ms; matrixgrootte: 256 × 256; 1,5 mm axiale plakjes; FOV = 256 × 256 mm2; voxelgrootte, 1,0 × 1,0 × 1,5 mm3, aantal plakjes = 128). De verkregen T1-gewogen beelden van elke deelnemer werden opnieuw geformatteerd in een axiale afbeelding en geconverteerd naar een analyse formaat door MRIcro software (Chris Rorden, Universiteit van Nottingham, UK; www.sph.sc.edu/comd/rorden/mricro.html). Figuur 1 illustreert de gegevensverwerking en statistische analyse stroomschema. Om de nauwkeurigheid van hersenweefsel extractie te verbeteren, werd een geautomatiseerde skull-stripping functie toegepast op beeldvolumes met behulp van de hersenen extractie tool in MRIcro software (figuur 1B). De daaropvolgende processen werden uitgevoerd met behulp van DiffeoMap (Li, X.; Jiang, H.; en Mori, S.; Johns Hopkins University, www.MriStudio.org). In deze procedure werd een 12-parameter affiene transformatie (23) gebruikt om elk T1-gewogen beeld te normaliseren ten opzichte van de JHU_MNI_SS_T_ss T1 template.
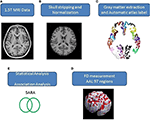
Figuur 1. (A-E) Procedure van het beeld proces en statistische analyse.
Atlas extractie
De beeldgegevens processen werden uitgevoerd met behulp van de SPM8 toolbox (Wellcome Department of Cognitive Neurology, Institute of Neurology, University College London, Londen, UK, http://www.fil.ion.ucl.ac.uk/spm/) en de IBASPM toolbox (Individuele Brain Atlassen met behulp van Statistische Parametrische Mapping, http://www.thomaskoenig.ch/Lester/ibaspm.htm), beide uitgevoerd met behulp van MATLAB 2010 software (Mathworks, Natick, MA, USA).
De procedure omvat drie stappen na normalisatie: (1) segmentatie van het genormaliseerde beeld in grijze stof, witte stof, en cerebrale spinale vloeistof in de eigen ruimte, (2) verkaveling van grijze stof in 116 regio’s op basis van de anatomische etikettering van de Montreal Neurological Institute (MNI) anatomische atlas (24), en (3) transformatie van grijze stof beelden in de MNI-ruimte en de anatomische uitlijning van elke voxel van grijze stof om de 116 automatische anatomische label structuren met behulp van IBASPM (24), linker cerebrum: 45 regio’s, rechter cerebrum: 45 regio’s, cerebellum: 26 regio’s; (figuur 1C). De 26 regio’s van het cerebellum werden samengevoegd tot zeven regio’s op basis van hun anatomische structuren, en de volumes van de 97 gelabelde (45 voor elke hersenhelft en zeven voor het cerebellum, aanvullende tabel 1) hersenstructuren werden geëxtraheerd voor elke persoon (figuur 1C).
De FD-methode werd oorspronkelijk voorgesteld door Mandelbrot voor de kwantificering van de vormgerelateerde complexiteit van objecten in een enkele numerieke waarde (25). De FD-methode wordt gebruikt voor de topologische meting van complexiteit; een hogere FD-waarde staat voor een grotere topologische complexiteit van het bestudeerde weefsel (18, 26). Veel neurologen hebben aangetoond dat de FD waarde kan dienen als een kwantitatieve maat voor een nauwkeurige beschrijving van de morfologische complexiteit van de cerebrale vouwen (18, 26, 27). Omdat FD analyse is gebaseerd op een logaritmische schaal, kan zelfs een kleine toename van de FD waarde overeenkomen met een aanzienlijke toename van de complexiteit (18). Deze studie heeft de 3D box-counting methode om de 3D-FD waarden van de 97 segmenten van grijze stof te meten van de gehele hersenen voor elke deelnemer (figuur 1D). Een verwante studie details van het algoritme voor de box-counting methode (18).
Statistische analyse
De geslachts- en leeftijdsgerelateerde verschillen tussen de groepen werden gemeten met behulp van Pearson’s chi-kwadraat test (χ2 = 0,384, p = 0,535) en de 2-tailed 2-sample t-test (p = 0,516), afzonderlijk. Lineaire regressie werd toegepast om de effecten van leeftijd en geslacht te elimineren. Er werd een 2-tailed t-test gebruikt om te bepalen of er een significant verschil bestond tussen de controle- en de patiëntengroep wat betreft de 3D-FD-waarden van elke corticale regio. De significantie van de resultaten was gebaseerd op de false discovery rate (FDR-gecorrigeerde p = 0,05) (28). De grootte van de associatie tussen de 3D-FD waarde van individuele hersengebieden en klinische kenmerken, zoals ziekteduur en SARA, werd bepaald door Pearson’s r-meting (figuur 1E). Deze analyses werden uitgevoerd met behulp van de Statistics Toolbox in MATLAB 2010.
Results
Patients With SCA3 Revealed Significant Lesions in Typical Infratentorial Lesions Regions
Ervaren neuroradiologen rapporteerden de MRI-bevindingen voor patiënten met SCA3 (tabel 1). Figuur 2 illustreert de vergelijking van 3D-FD waarden in elke kwab tussen de gezonde groep en de SCA3 groep. Over het geheel genomen vertoonden patiënten met SCA3 significant verminderde 3D-FD waarden in elke kwab, en het cerebellum werd geassocieerd met de meest substantiële vermindering van de 3D-FD waarde (figuur 2). De 3D-FD waarden van de cerebellaire cortex van SCA3 toonden een significante correlatie met hun SARA scores (r = -0.3346; p = 0.023). We verkavelden de cerebrale en cerebellaire cortex verder in 97 regio’s en kwantificeerden de atrofie in elk verkaveld gebied. Patiënten met SCA3 hadden typische infratentoriale letsel regio’s, met inbegrip van pontine kernen, cerebellaire cortex, en inferieure olijven. De details van de significant verminderde 3D-FD-waarden van atrofie regio’s tussen de gezonde groep en de SCA3 groep zijn samengevat in tabel 2.
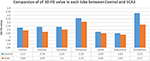
Figuur 2. Vergelijking van de 3D-FD-waarden in elke kwab tussen de gezonde groep en de SCA3-groep. De 3D-FD-waarde in elke kwab van SCA3 was significant lager dan die van de controlegroep. De p-waarde van significant verschil van cerebellum, frontale kwab, pariëtale kwab, en occipitale kwab zijn kleiner dan 0,01, en voor andere kwabben zijn kleiner dan 0,05.
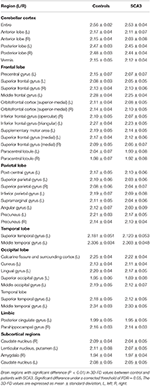
Tabel 2. Significante atrofische regio’s bij patiënten met SCA3 (p < 0,05).
Patiënten met SCA3 vertoonden cerebrale gelateraliseerde supratentoriale laesies
Naast de infratentoriale laesies werden bij alle patiënten met SCA3 ook laesies in supratentoriale regio’s waargenomen. Zij vertoonden wijdverspreide laesies in 39 cerebrale verkavelde regio’s (p < 0,05), waaronder frontale kwab, pariëtale kwab, occipitale kwab, en temporale kwab. Zij onthulden laterale atrofie, en voornamelijk in de linker hemisfeer (rechts/links: 12/27). Vooral in de occipitale en temporale kwabben vertoonden patiënten met SCA3 alleen in de linker hemisfeer significant verlaagde 3D-FD waarden. De significante geatrofieerde regio’s in frontale gebieden waren de premotorische cortex (links precentrale gyrus, bilaterale superieure frontale gyrus, en links-midden frontale gyrus), aanvullende motorische cortex (links aanvullend motorisch gebied), en primaire motorische cortex (links precentrale gyrus) (figuur 3).
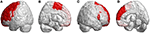
Figuur 3. Regio’s in de frontale kwab met lagere 3D-FD-waarden bij patiënten met SCA3 in vergelijking met controles. (A) Links-buitenaanzicht, (B) links-binnenaanzicht, (C) rechts-buitenaanzicht, en (D) rechts-binnenaanzicht. Patiënten met SCA3 hadden significant verlaagde 3D-FD waarden in frontale gebieden, waaronder de premotorische cortex (linker precentrale gyrus, bilaterale superieure frontale gyrus, en linker-midden frontale gyrus), aanvullende motorische cortex (linker aanvullende motorische gebied), en primaire motorische cortex (linker precentrale gyrus). Andere geatrofieerde gebieden werden waargenomen in de linker inferieure frontale gyrus (operculair), linker inferieure frontale gyrus (driehoekig), bilaterale orbitofrontale cortex (superieur-1 mediaal), bilaterale superieure frontale gyrus (mediaal), en bilaterale paracentrale lobule bij patiënten met SCA3. Alle significant verlaagde 3D-FD waarden regio’s zijn geïllustreerd in rood.
Andere geatrofieerde regio’s waren in de linker inferieure frontale gyrus (operculaire), linker inferieure frontale gyrus (driehoekig), bilaterale orbitofrontale cortex (superieur-mediaal), bilaterale superieure frontale gyrus (mediaal), en bilaterale paracentrale lobule. In de pariëtale kwab werden verlaagde FD waarden vastgesteld in de linker postcentrale gyrus, linker supramarginale gyrus, linker hoekige gyrus, bilaterale superieure pariëtale gyrus, en bilaterale precuneus van patiënten met SCA3 (figuur 4).
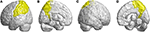
Figuur 4. Regio’s binnen de pariëtale kwab die een afname van de 3D-FD-waarde aangeven bij patiënten met SCA3 in vergelijking met controles. (A) Links-buitenaanzicht, (B) links-binnenaanzicht, (C) rechts-buitenaanzicht, en (D) rechts-binnenaanzicht. Vergeleken met controles, hadden patiënten met SCA3 significant lagere 3D-FD waarden in de linker postcentrale gyrus, linker supramarginale gyrus, linker hoekige gyrus, bilaterale superieure pariëtale gyrus, en bilaterale precuneus van de pariëtale kwab. Alle significant verminderde 3D-FD waarden regio’s worden geïllustreerd in yellow.
In de occipitale kwab, SCA3 patiënten onthuld significant lagere FD waarden in de calcarine fissuur en de omliggende cortex, cuneus, linguale gyrus, en de superieure en middelste occipitale gyri in de linker hemisfeer (Figuur 5A, blauwe kleur). In de temporale kwab, regio’s met verminderde FD waarden waren in de links-superior temporale en links-midden temporale gyri van patiënten met SCA3 (Figuur 5A, paarse kleur). De 3D-FD waarden in de linker-posterior cingulate gyrus van de limbische regio waren ook significant verminderd bij patiënten met SCA3 (Figuren 5B,D, groene kleur). Regio’s van significante atrofie werden waargenomen in de basale ganglia, met inbegrip van de bilaterale nucleus caudatus en links putamen, bij patiënten met SCA3 (Figuren 5B,D, aqua blauwe kleur). In de rechter-buitenste occipitale kwab, werden geen significante geatrofieerde regio’s waargenomen bij patiënten met SCA3 (figuur 5C).
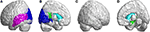
Figuur 5. Regio’s in de occipitale kwab, temporale kwab en subcorticale kwab die significant lagere 3D-FD-waarden aangeven bij patiënten met SCA3 in vergelijking met controles. (A) Links-buitenaanzicht, (B) links-binnenaanzicht, (C) rechts-buitenaanzicht, en (D) rechts-binnenaanzicht. De blauwe gebieden tonen significant lagere 3D-FD waarden in de occipitale kwab, inclusief de calcarine fissuur en de omliggende cortex, cuneus, en linguale gyrus en de superieure en middelste occipitale gyrus in de linker hemisfeer. Paarse regio’s geven lagere 3D-FD waarden in de linker-superior temporale gyrus en links-midden temporale gyrus. Aqua blauwe regio’s vertegenwoordigen lagere 3D-FD waarden in subcorticale gebieden, met inbegrip van de bilaterale caudate en links putamen. Groene regio’s vertegenwoordigen significant lagere 3D-FD-waarden in de linker-posterior cingulate gyrus en parahippocampus van het limbisch systeem.
In figuur 6, vonden we veel cerebrale geatrofieerde regio’s opgenomen cerebellum, cerebellair-thalamocorticale, en basale ganglia-thalamocorticale link circuits die impliceerde dat patiënten met SCA3 onthulde cerebellair-thalamocorticale en basale ganglia-thalamocortical beschadigd in deze pathways.

Figuur 6. SCA3 is betrokken bij zowel de cerebellaire-thalamocorticale als de basale ganglia-thalamocorticale paden. (A) Links-buitenaanzicht, (B) links-binnenaanzicht, (C) rechts-buitenaanzicht, en (D) rechts-binnenaanzicht. In de cerebellaire-thalamocorticale lus, patiënten met SCA3 vertonen significant lagere 3D-FD waarden in de cerebellaire, premotorische, en aanvullende motorische cortexen. De verlaagde 3D-FD waarden in de cerebellaire cortex en andere motor-gerelateerde cerebrale gebieden bij patiënten met SCA3 bieden een verklaring voor de aanwezigheid van klinische symptomen. In de basale ganglia-thalamocorticale lus, vertonen patiënten met SCA3 significant lagere 3D-FD waarden in de frontale cortex, primaire motorische cortex, putamen, en caudate. Deze resultaten onthullen morfologische veranderingen in de basale ganglia-thalamocorticale lus bij patiënten met SCA3.
Discussie
Clinisch gezien vertonen patiënten met SCA3 een cerebellair syndroom en parkinsonisme (3-5). De geatrofieerde gebieden van infratentoriale en supratentoriale cortex vermeld in tabel 2, en toonde een breed scala van overlappende gebieden als in twee functionele regio’s, namelijk cerebellum-gerelateerde (CB-gerelateerde) cortex (29) en basale ganglia-gerelateerde (BG-gerelateerde) cortex (30). De CB-gerelateerde cortex omvat het cerebellum, prefrontale, sensorimotorische cortices, prefrontale cortex, en temporale kwab, en BG-gerelateerde cortex omvatten primaire motorische cortex, aanvullende motorische gebied, premotorische cortex, en basale ganglia. Onze resultaten kwamen overeen met eerdere conventionele neuroimaging studies dat het cerebellum de meest getroffen en geatrofieerde regio is bij patiënten met SCA3 (4, 31, 32). Bovendien had de 3D-FD waarde in de cerebellaire cortex van patiënten met SCA3 een significant negatieve correlatie met SARA scores (r = -0,3346; p = 0,023) zoals Rezende et al. ooit hadden gerapporteerd (33).
In de infratentoriale regio’s, hadden patiënten met SCA3 een significant verlaagde 3D-FD waarden in putamen en caudate. Neuropathologische studies hebben neuronaal verlies aangetoond in het putamen en de caudate, wat kan leiden tot atrofie van de basale ganglia in associatie met parkinsonisme (34). Parkinsonkenmerken zijn het prevalente fenotype van de SCA3-mutatie en gaan gewoonlijk gepaard met basale ganglia-symptomen (35-37). In necropsiestudies is de betrokkenheid van de basale ganglia bij patiënten met SCA3 veel voorkomend. Functionele beeldvorming met behulp van PET-onderzoek heeft ook vroege functionele achteruitgang van de caudatus en het putamen aangetoond bij patiënten met SCA3. Bovendien hadden patiënten met SCA3 een significant kleiner volume van de basale ganglia (35). Echter, verwante studies hebben zich alleen gericht op de basale ganglia en infratentoriale regio’s. In figuur 6, hebben we geverifieerd dat SCA3 kan niet alleen de basale ganglia laesies, maar ook de cerebellaire-thalamocorticale en basale ganglia-thalamocorticale pathways damage.
Patiënten met SCA3 vertonen significant verminderde 3D-FD waarden van de premotorische cortex en aanvullende motorische cortex in hun cerebellaire-thalamocorticale lus. De premotorische cortex en het aanvullend motorisch gebied zijn geassocieerd met bewegingscontrole, zoals spierkracht en richting van reiken. Schade in deze gebieden kan leiden tot ataxie van het lopen, de houding en het ledemaat, naast bewegingsontleding (38, 39). De verlaagde 3D-FD waarden van de cerebellaire cortex en andere motorische gerelateerde hersengebieden bij patiënten met SCA3 kunnen de aanwezigheid van klinische symptomen verklaren. Bovendien vertonen patiënten met SCA3 in de basale ganglia-thalamocorticale lus significant verlaagde 3D-FD waarden in de frontale en primaire motorische cortex. De primaire motorische cortex is ook een belangrijke bestemming voor de output van de basale ganglia (40). Verstoringen van de basale ganglia-thalamocorticale lus kan ook bijdragen aan Parkinson motorische disfunctie (41). De resultaten van deze studie benadrukken de morfologische veranderingen in de basale ganglia-thalamocorticale lus bij patiënten met SCA3, die eerdere neuroimaging studies niet hebben aangepakt.
Recentelijk gebruikten we diffusie tensor imaging (DTI) om watermoleculaire diffusie van witte stof (WM) alteratie in SCA3 te meten (15). We ontdekten dat SCA3 wijdverspreide witte stof laesies onthulde in de bilaterale cerebrale-frontale, -pariëtale, -temporale, en -occipitale WM; cerebellaire WM; de thalamus, en de hersenstam. Identiek, in deze studie zagen we de SCA3 bijna in dezelfde verkavelde regio’s van deze WM laesies die GM laesies onthulden. Deze huidige bevindingen bevestigen de betrokkenheid van supratentoriale gebieden bij patiënten met SCA3. Braga et al. rapporteerden soortgelijke bevindingen en toonden aan dat SCA3 CCAS veroorzaakt door de aantasting van executieve functies, verbale vlotheid, abstract redeneren, en werkgeheugen (8). In neuropathologische studies werd aangetoond dat CCAS het gevolg is van de verstoring van het cerebellaire circuit, dat geassocieerd is met de prefrontale, superieure pariëtale, superieure temporale, en limbische cortexen (42, 43). Studies hebben de rol van het cerebellum in de cognitieve functie bevestigd; echter, cognitieve, affectieve en visuospatiale functies zijn direct geassocieerd met corticale degeneratie. De significant geatrofieerde gebieden van de supratentoriale gebieden bij patiënten met SCA3 waren uitgebreider dan de CCAS-geassocieerde gebieden. De atrofie van de supratentoriale cortex kan de primaire factor zijn die geassocieerd is met het disfunctioneren van de ataxie en Parkinsonisme-gerelateerde gebieden. Deze bevindingen suggereren dat SCA3 niet langer moet worden beschouwd als een ziekte die beperkt is tot het cerebellum en zijn verbindingen; in plaats daarvan moet het worden beschouwd als een pathologie die de hele hersenen aantast.
Hoewel deze studie nog steeds bepaalde beperkingen had. De belangrijkste beperkingen in deze studie zijn het ontbreken van specifieke cognitieve evaluaties en klinische parameters voor het beoordelen van CCAS in SCA. Verder onderzoek is gerechtvaardigd met betrekking tot de correlatie tussen de huidige resultaten en klinische gegevens, zoals functionele MRI gegevens. Dit kan bijdragen tot een nauwkeuriger methode voor het beoordelen van de associatie tussen cognitieve met motorische betrokkenheid en regionale atrofie bij patiënten met SCA3.
Conclusies
In deze studie hebben we de 3D-FD methode gebruikt om regionale morfologische variaties bij patiënten met SCA3 te kwantificeren en de associatie tussen supratentoriële atrofie en motorische betrokkenheid bij patiënten met SCA3 te beoordelen. Onze resultaten vonden significante degeneratie van de cerebrale cortex in specifieke regio’s, die mogelijk cerebellair gerelateerd of basale ganglia gerelateerd zijn. Onze bevindingen zouden kunnen correleren met de veel voorkomende symptomen van SCA3, zoals ataxie, Parkinsonisme, dysarthrie en dysmetrie. SCA3 moet niet langer worden beschouwd als een ziekte die beperkt is tot het cerebellum en zijn verbindingen; in plaats daarvan moet het worden beschouwd als een pathologie die de hele hersenen aantast.
Data Availability Statement
Alle datasets die voor deze studie zijn gegenereerd, zijn opgenomen in het artikel/Supplementary Material.
Ethics Statement
De studies waarbij menselijke deelnemers betrokken waren, werden beoordeeld en goedgekeurd door de Institutional Review Board van het Taipei Veterans General Hospital. De patiënten/deelnemers gaven hun schriftelijke geïnformeerde toestemming om deel te nemen aan deze studie.
Author Contributions
P-SW en Y-TW organiseerden het onderzoeksproject, beoordeelden en bekritiseerden het manuscript. T-YW schreef het manuscript. H-MW had toegang tot de onderzoeksgegevens. B-WS organiseerde het onderzoek en voerde de dataverzameling uit. C-WJ voerde de statistische analyse uit, schreef en reviseerde het manuscript.
Funding
Deze studie werd gefinancierd door het Ministerie van Wetenschap en Technologie, Taiwan (MOST108-2634-F-010-002); National Health Research Institutes, Taiwan (NHRI-EX106-10526EI); National Yang-Ming University en Shin-Kong Wu-Ho Su Memorial Hospital Research Program (107GB006).
Conflict of Interest
De auteurs verklaren dat het onderzoek werd uitgevoerd in de afwezigheid van enige commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
Acknowledgments
De auteurs willen alle personen bedanken die aan deze studie hebben deelgenomen en Wallace Academic Editing bedanken voor het redigeren van dit manuscript.
Supplementary Material
Het Supplementary Material voor dit artikel is online te vinden op: https://www.frontiersin.org/articles/10.3389/fneur.2020.00124/full#supplementary-material
1. Kawaguchi Y, Okamoto T, Taniwaki M, Aizawa M, Inoue M, Katayama S, et al. CAG expansies in een nieuw gen voor de ziekte van Machado-Joseph op chromosoom 14q32.1. Nat Genet. (1994) 8:221-8. doi: 10.1038/ng1194-221
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Riess O, Rub U, Pastore A, Bauer P, Schols L. SCA3: neurologische kenmerken, pathogenese en diermodellen. Cerebellum. (2008) 7:125-37. doi: 10.1007/s12311-008-0013-4
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Stevanin G, Durr A, Brice A. Clinical and molecular advances in autosomal dominant cerebellar ataxias: from genotype to phenotype and physiopathology. Eur J Hum Genet. (2000) 8:4-18. doi: 10.1038/sj.ejhg.5200403
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Schols L, Bauer P, Schmidt T, Schulte T, Riess O. Autosomaal dominante cerebellaire ataxieën: klinische kenmerken, genetica, en pathogenese. Lancet Neurol. (2004) 3:291-304. doi: 10.1016/S1474-4422(04)00737-9
PubMed Abstract | CrossRef Full Text
5. Roeske S, Filla I, Heim S, Amunts K, Helmstaedter C, Wüllner U, et al. Progressive cognitive dysfunction in spinocerebellaire ataxia type 3. Movement Disord. (2013) 28:1435-8. doi: 10.1002/mds.25512
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Braga-Neto P, Pedroso JL, Alessi H, Dutra LA, Felicio AC, Minett T, et al. Cerebellair cognitief affectief syndroom in de ziekte van machado joseph: kern klinische kenmerken. Cerebellum. (2012) 11:549-56. doi: 10.1007/s12311-011-0318-6
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Zawacki TM, Grace J, Friedman JH, Sudarsky L. Executive and emotional dysfunction in Machado-Joseph disease. Movement Disord. (2002) 17:1004-10. doi: 10.1002/mds.10033
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Braga-Neto P, Dutra LA, Pedroso JL, Barsottini OGP. Cognitieve disfunctie bij spinocerebellaire ataxie type 3: variabele topografieën en patronen. Movement Disord. (2014) 29:156-7. doi: 10.1002/mds.25756
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Lopes TM, D′Abreu A, Junior MCF, Yasuda CL, Betting LE, Samara AB, et al. Wijdverspreide neuronale schade en cognitieve disfunctie bij spinocerebellaire ataxie type 3. J Neurol. (2013) 260:2370-9. doi: 10.1007/s00415-013-6998-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Roeske S, Filla I, Heim S, Amunts K, Helmstaedter C, Wüllner C, et al. Reply to: cognitive dysfunction in spinocerebellaire ataxie type 3: variable topographies and patterns. Movement Disord. (2014) 29:157-8. doi: 10.1002/mds.25755
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Barbas H. Anatomic basis of cognitive-emotional interactions in the primate prefrontal cortex. Neurosci Biobehav R. (1995) 19:499-510. doi: 10.1016/0149-7634(94)00053-4
PubMed Abstract | CrossRef Full Text | Google Scholar
12. D’Abreu A, Franca MC Jr, Yasuda CL, Campos BA, Lopes-Cendes I, Cendes F, et al. Neocortical atrophy in machado-joseph disease: a longitudinal neuroimaging study. J Neuroimaging. (2012) 22:285-91. doi: 10.1111/j.1552-6569.2011.00614.x
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Soong BW, Liu RS. Positron emissie tomografie bij asymptomatische gendragers van de ziekte van Machado-Joseph. J Neurol Neurosur PS. (1998) 64:499-504. doi: 10.1136/jnnp.64.4.499
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Wullner U, Reimold M, Abele M, Burk K, Minnerop M, Dohmen BM, et al. Dopamine transporter positron emission tomography in spinocerebellaire ataxias type 1, 2, 3, and 6. Arc Neurol. (2005) 62:1280-5. doi: 10.1001/archneur.62.8.1280
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Jao CW, Soong BW, Huang CW, Duan CA, Wu CC, Wu YT, et al. Diffusion tensor magnetic resonance imaging for differentiating multiple system atrophy cerebellar type and spinocerebellar ataxia type 3. Brain Sci. (2019) 9:354. doi: 10.3390/brainsci9120354
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Kang JS, Klein JC, Baudrexel S, Deichmann R, Nolte D, Hilker R. White matter damage is related to ataxia severity in SCA3. J Neurol. (2014) 261:291-9. doi: 10.1007/s00415-013-7186-6
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Guimarães RP, D’Abreu A, Yasuda CL, Franca MC Jr, Silva BH, Cappabianco FA, et al. Een multimodale evaluatie van microstructurele witte stof schade in spinocerebellaire ataxie type 3. Mov Disord. (2013) 28:1125-32. doi: 10.1002/mds.25451
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Wu YT, Shyu KK, Jao CW, Wang ZY, Soong BW, Wu HM, et al. Fractal dimension analysis for quantifying cerebellar morphological change of multiple system atrophy of the cerebellar type (MSA-C). NeuroImage. (2010) 49:539-51. doi: 10.1016/j.neuroimage.2009.07.042
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Schmitz-Hübsch T, du Montcel ST, Baliko L, Berciano J, Boesch S, Depondt C, et al. Scale for the assessment and rating of ataxia. Ontwikkeling van een nieuwe klinische schaal. Neurologie. (2006) 66:1717-20. doi: 10.1212/01.wnl.0000219042.60538.92
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Hoehn MM, Yahr MD. Parkinsonisme: begin, progressie, en mortaliteit. Neurology. (1998) 50:318. doi: 10.1212/WNL.50.2.318
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Jardim LB, Pereira ML, Silveira I, Ferro A, Sequeiros J, Giugliani R. Neurologic findings in Machado-Joseph disease: relation with disease duration, subtypes, and (CAG)n. Arch Neurol. (2001) 58:899-904. doi: 10.1001/archneur.58.6.899
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Soong B-W, Lu Y-C, Choo K-B, Lee H-Y. Frequentieanalyse van autosomaal dominante cerebellaire ataxieën bij Taiwanese patiënten en klinische en moleculaire karakterisering van spinocerebellaire ataxie type 6. Arch Neurol. (2001) 58:1105-9. doi: 10.1001/archneur.58.7.1105
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Woods RP, Grafton ST, Holmes CJ, Cherry SR, Mazziotta JC. Geautomatiseerde beeldregistratie: I. General methods and intrasubject, intramodalitym validation. J Comput Assist Tomo. (1998) 22:139-52. doi: 10.1097/00004728-199801000-00027
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Tzourio-Mazoyer N, Landeau B, Papathanassiou D, Crivello F, Etard O, Delcroix N, et al. Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain. NeuroImage. (2002) 15:273-89. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Mandelbrot BB. Fractals: Vorm, Toeval en Dimensie. San Francisco, CA: Freeman (1977). p. 365.
Google Scholar
26. Esteban FJ, Sepulcre J, de Mendizabal NV, Goni J, Navas J, de Miras JR, et al. Fractal dimension and white matter changes in multiple sclerosis. NeuroImage. (2007) 36:543-9. doi: 10.1016/j.neuroimage.2007.03.057
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Ha TH, Yoon U, Lee KJ, Shin YW, Lee JM, Kim IY, et al. Fractale dimensie van cerebrale corticale oppervlak in schizofrenie en obsessief-compulsieve stoornis. Neurosci Lett. (2005) 384:172-6. doi: 10.1016/j.neulet.2005.04.078
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Benjamini Y, Hochberg Y. Controlling the false discovery rate: a practical and powerful approach to multiple testing. J R Stat Soc B. (1995) 57:289-300. doi: 10.1111/j.2517-6161.1995.tb02031.x
CrossRef Full Text | Google Scholar
29. Schmahmann JD, Pandya DN. Anatomical investigation of projections to the basis pontis from posterior parietal association cortices in rhesus monkey. J Comp Neurol. (1989) 289:53-73. doi: 10.1002/cne.902890105
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Girard B, Tabareau N, Berthoz A, Slotine JJ. Selectieve Versterking met behulp van een contracterende model van de Basale Ganglia. Pont A Mousson: NeuroComp (2006). p. 30-3.
Google Scholar
31. Burk K, Abele M, Fetter M, Dichgans J, Skalej M, Laccone F, et al. Autosomaal dominante cerebellaire ataxie type I klinische kenmerken en MRI in families met SCA1, SCA2 en SCA3. Hersenen. (1996) 119:1497-505. doi: 10.1093/brain/119.5.1497
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Dohlinger S, Hauser TK, Borkert J, Luft AR, Schulz JB. Magnetische resonantie beeldvorming in spinocerebellaire ataxias. Cerebellum. (2008) 7:204-14. doi: 10.1007/s12311-008-0025-0
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Rezende TJ, D’Abreu A, Guimaraes RP, Lopes TM, Lopes-Cendesc I, Cendes F, et al. Cerebral cortex involvement in Machado-Joseph disease. Eur J Neurol. (2015) 22:277-83, e23-4. doi: 10.1111/ene.12559
CrossRef Full Text | Google Scholar
34. Lu CS, Chang HC, Kuo PC, Liu YL, Wu WS, Weng YH, et al. Het parkinson-fenotype van spinocerebellaire ataxie type 3 in een Taiwanese familie. Parkinsonism Relat D. (2004) 10:369-73. doi: 10.1016/j.parkreldis.2004.03.009
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Klockgether T, Skalej M, Wedekind D, Luft AR, Welte D, Schulz JB, et al. Autosomaal dominante cerebellaire ataxie type I. MRI-gebaseerde volumetrie van achterste fossa structuren en basale ganglia in spinocerebellaire ataxie type 1, 2 en 3. Hersenen. (1998) 121:1687-93. doi: 10.1093/brain/121.9.1687
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Socal MP, Emmel VE, Rieder CRM, Hilbig A, Saraiva-Pereira ML, Jardim LB. Intrafamilial variability of Parkinson phenotype in SCAs: novel cases due to SCA2 and SCA3 expansions. Parkinsonism Relat D. (2009) 15:374-8. doi: 10.1016/j.parkreldis.2008.09.005
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Bettencourt C, Santos C, Coutinho P, Rizzu P, Vasconcelos J, Kay T, et al. Parkinson-fenotype bij de ziekte van Machado-Joseph (MJD/SCA3): een verslag van twee gevallen. BMC Neurol. (2011) 11:131. doi: 10.1186/1471-2377-11-131
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Kandel ER, Schwartz JH, Jessell TM. Beginselen van de Neurale Wetenschap. New York, NY: McGraw-Hill (1991). p. 626-46.
Google Scholar
39. Asbury AK, McKhann GM. Diseases of the Nervous System: Clinical Neurobiology. Philadelphia, PA: W.B. Saunders (1992). p. 319-341.
40. Hoover JE, Strick PL. Multiple output channels in the basal ganglia. Science. (1993) 5:819-21. doi: 10.1126/science.7679223
CrossRef Full Text | Google Scholar
41. Jan C, Pessiglione M, Tremblay L, Tandé D, Hirsch EC, François C, et al. Quantitative analysis of dopaminergic loss in relation to functional territories in MPTP-treated monkeys. Eur J Neurosci. (2003) 18:2082-6. doi: 10.1046/j.1460-9568.2003.02946.x
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Rub U, de Vos RA, Brunt ER, Sebesteny T, Schols L, Auburger G, et al. Spinocerebellaire ataxie type 3 (SCA3): thalamische neurodegeneratie treedt op onafhankelijk van thalamische ataxine-3 immunopositieve neuronale intranucleaire inclusies. Brain Pathol. (2006) 16:218-27. doi: 10.1111/j.1750-3639.2006.00022.x
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Rub U, Seidel K, Ozerden I, Gierga K, Brunt ER, Schöls L, et al. Consistente aantasting van het centrale somatosensorische systeem bij spinocerebellaire ataxie type 2 en type 3 en de betekenis daarvan voor klinische symptomen en revalidatietherapie. Brain Res Rev. (2007) 53:235-49. doi: 10.1016/j.brainresrev.2006.08.003
PubMed Abstract | CrossRef Full Text | Google Scholar