Glycogeen en zetmeel, megadalton grote glucosepolymeren, vormen het belangrijkste reservoir van direct beschikbare energie en koolstofverbindingen in de meeste levende organismen. Bij zoogdieren staan de glucose-opname en het glucosegebruik onder strenge controle. Defecten in de normale glucosehuishouding worden in verband gebracht met een aantal menselijke pathologieën zoals glycogeenopslagziekten en diabetes, waarbij aanhoudende hyperglykemie gecorreleerd is met een vroegtijdige aanvang en een verhoogde ernst van de ziekte. Bij de metabolische routes voor de katalytische omzetting van glycogeen zijn verschillende enzymen betrokken, waaronder glycogeensynthase dat de verlenging katalyseert en glycogeenfosforylase dat de afbraak katalyseert van a(1,4)-gekoppelde glucanen. De biochemische en structurele studies van glycogeen- en maltodextrinefosforylases in de afgelopen 30 jaar hebben een grote rijkdom aan informatie opgeleverd over de afbraak van glycogeen. Deze studies hebben aangetoond dat de regulatie van glycogeenfosforylase een fascinerend voorbeeld is van covalent en niet-covalent allosterisme, voortreffelijk gecoördineerd door hormonale controle. Informatie die de tertiaire en quaternaire structuren beschrijft is nu beschikbaar voor praktisch alle enzymen die rechtstreeks betrokken zijn bij de glycogeenverwerking. Verrassend genoeg is er zeer weinig structurele informatie gerapporteerd over glycogeensynthase, dat glycogeenverlenging katalyseert door de opeenvolgende toevoeging van ![]() -(1,4)-gekoppelde glucoseresiduen aan het niet-reducerende uiteinde van het polymeer, met behulp van ADP/UDP-glucose als glucosedonor.
-(1,4)-gekoppelde glucoseresiduen aan het niet-reducerende uiteinde van het polymeer, met behulp van ADP/UDP-glucose als glucosedonor.
We hebben nu de kristalstructuur van het glycogeensynthase van Agrobacterium tumefaciens (AtGS) bepaald bij 2,3 Å resolutie, zowel in zijn apo-vorm als in de aanwezigheid van ADP. De gegevens werden verzameld op ID29, en de structuur werd opgelost met de SAD-techniek (single wavelength anomalous diffraction), gevolgd door dichtheidsmodificatieprocedures. Het eiwit wordt aangetroffen als een dimeer in de asymmetrische eenheid, waarbij elk monomeer bestaat uit twee ‘Rossmann-vouw’-domeinen (figuur 81) die zijn georganiseerd zoals in de structuren van glycogeenfosforylase en andere glycosyltransferasen van de GT-B-superfamilie. Een diepe spleet tussen beide domeinen bevat het katalytisch centrum. Een belangrijk verschil tussen zoogdier- (familie GT3) en bacteriële (GT5) glycogeensynthasen, is dat alleen GT3-enzymen strak gereguleerd worden door fosforylering en niet-covalente allosterische modulatie. Volgens de op structuur gebaseerde meervoudige sequentie-afstemming tussen GT3, GT5 en glycogeen fosforylase sequenties, zijn de regulerende fosforylatie sites in menselijk glycogeen synthase waarschijnlijk gelegen in de 25-residue N-terminale en 120-residue C-terminale inserties, buiten de niet-gereguleerde GT-B kern van bacteriële glycogeen synthases. Mutagenesestudies hadden eerder twee geconserveerde Arg-clusters in GT3-enzymen geïdentificeerd als onderdeel van de allosterische site(s) voor zowel de fosfo-Ser/Thr-residuen als de niet-covalente activator Glc-6P. De overeenkomstige residuen in AtGS bevinden zich aan een uiteinde van het C-terminale domein, ver van het reactiecentrum, wat wijst op een regulerend effect over lange afstand.
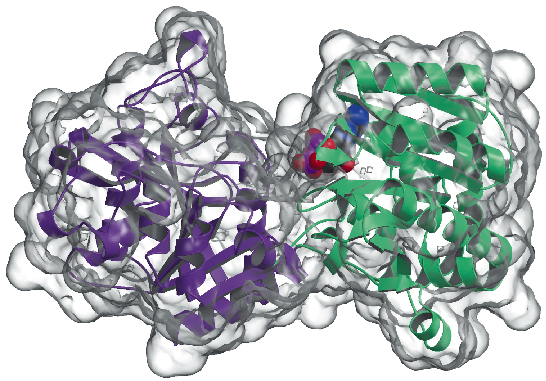
Fig. 81: Glycogeensynthase-structuur: het voor oplosmiddelen toegankelijke oppervlak is transparant weergegeven. Let op de gebonden ADP-molecule (getekend als VDW-bolletjes).
De structuur van AtGS vertoont een opvallende topologische gelijkenis met de kernstructuren van glycogeen/ maltodextrine fosforylases (familie GT35) (figuur 82a), ook al zijn de sequentie-identiteiten laag (~14%). De structuur van elk Rossmann-domein van AtGS ligt beduidend dichter bij die van fosforylases uit de GT35-familie dan bij enig ander nucleotide-afhankelijk glycosyltransferase. Glycogeensynthase en fosforylases vertonen ook een sterke gelijkenis op hun katalytische sites (Figuur 82b). De ADP-ribose en de pyridoxalgroepen liggen op gelijkwaardige posities, evenals het distale fosfaat van ADP in AtGS en het anorganische fosfaatsubstraat in fosforylases. Bovendien zijn ook de kritische aminozuren die interageren met de glucosemotieven van de substraten geconserveerd. Het katalytische mechanisme dat door glycogeensynthasen en fosforylasen wordt gebruikt, is daarom waarschijnlijk vergelijkbaar, waarbij subtiele veranderingen in de structuur hun globaal verschillende functionele eigenschappen verklaren.
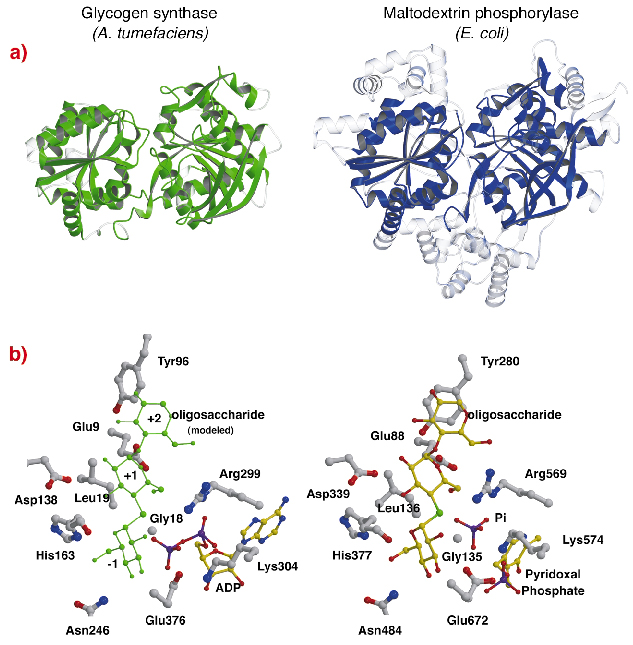
Fig. 82: Homologie met glycogeenfosforylase: (a) na structurele uitlijning, gesuperponeerde equivalente residuen tussen AtGS en E. coli maltodextrine fosforylase MalP, zijn weergegeven in vast materiaal (niet-uitgelijnde gebieden, in transparant); (b) de katalytische sites van AtGS en MalP.
De aanvankelijke suggestie dat glycogeensynthese eenvoudigweg een omkering van de degradatieve fosforolyse vertegenwoordigde, bleek onjuist te zijn toen Leloir aantoonde dat UDP-Glc en glycogeensynthase, en niet Glc-1-P en glycogeenfosforylase, verantwoordelijk waren voor de polysaccharidestrekkingsprocessen. Ons werk toont nu echter aan dat de tegenovergestelde onafhankelijke reacties in de glucose-glycogeen interconversie gekatalyseerd worden door nauw verwante homologe enzymen.