- Introduction
- Epidemiologie
- Het organisme en de pathofysiologie van C. difficile diarree
- Klinische manifestaties
- Diagnose
- Praktische richtlijnen voor de diagnose van C. difficile-diarree-syndromen
- Endoscopische diagnose van C. difficile diarree en colitis
- Behandeling
- Behandeling van recidiverende C. difficile diarree
- Erge C. difficile colitis
- Conclusie
Introduction
Clostridium difficile-associated diarrhea (CDAD) wordt steeds vaker gezien als een oorzaak van nosocomiale ziekte. De frequentie en incidentie van CDAD varieert sterk en wordt beïnvloed door meerdere factoren, waaronder nosocomiale uitbraken, patronen van antimicrobieel gebruik, en individuele gevoeligheid. Er zijn geen rapporten van prospectieve studies door ziekenhuizen die positieve toxine A of A / B en de resultaten van CDAD en de complicaties ervan volgen.
De Centers for Disease Control and Prevention (CDC) heeft seculiere trends in de incidentie van CDAD geanalyseerd, en het meldde een gestage toename van 1987 tot 2001 (1). In dit rapport meldde 30% van de 440 infectieziektenartsen die deelnamen aan een webgebaseerde enquête dat zij hogere percentages CDAD, ernstigere CDAD en meer recidiverende CDAD zien dan in het verleden. Er is een algemene indruk dat er een toename is van het aandeel gevallen met ernstige en fatale complicaties, en een toename van het recidiefpercentage onder getroffen patiënten.
Naast morbiditeit en mortaliteit is de economische last van C. difficile-infectie in termen van vertraagd ontslag en andere ziekenhuiskosten aanzienlijk.
Epidemiologie
De frequentie en incidentie van CDAD varieert tussen ziekenhuizen en binnen een bepaalde instelling in de loop van de tijd. Het risico op ziekte neemt toe bij patiënten met blootstelling aan antibiotica, gastro-intestinale chirurgie, toenemende verblijfsduur in zorginstellingen, ernstige onderliggende ziekte, immuno-compromiserende aandoeningen en gevorderde leeftijd.
C. difficile wordt in de feces uitgescheiden. Elk oppervlak, apparaat of materiaal (bv. commode, badkuip en elektronische rectale thermometer) dat met feces besmet is, kan als reservoir voor C. difficile-sporen dienen. Sporen worden voornamelijk via de handen van medisch personeel dat een besmet oppervlak of voorwerp heeft aangeraakt, overgedragen op patiënten (2-6).
 klik voor grote versie
klik voor grote versie
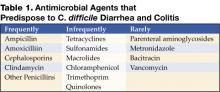
Figuur 1 . Digitale röntgenfoto van CT-scan toont nodulaire haustale verdikking in het transversale colon.
Het organisme en de pathofysiologie van C. difficile diarree
C. difficile is een grampositieve, anaerobe, sporenvormende bacil die verantwoordelijk is voor het ontstaan van antibiotica-geassocieerde diarree en colitis. C. difficile werd voor het eerst beschreven in 1935 als een component van de fecale flora van gezonde pasgeborenen en aanvankelijk werd gedacht dat het niet pathogeen was (7). De bacil kreeg de naam difficile omdat hij langzaam groeit en moeilijk te kweken is. C. difficile is momenteel verantwoordelijk voor bijna alle oorzaken van pseudomembraneuze colitis en maar liefst 20% van de gevallen van antibiotica-geassocieerde diarree zonder colitis. Hoewel slechts 5% van de algemene bevolking dit organisme in de ontlasting aantreft, raakt maar liefst 21% van de volwassenen ermee gekoloniseerd tijdens een ziekenhuisopname (2,6).
Een verandering van de normale microflora in het colon, gewoonlijk veroorzaakt door een antibioticatherapie, is de belangrijkste factor die vatbaar is voor infectie met C. difficile. Bijna alle antibiotica zijn in verband gebracht met C. difficile diarree en colitis. De antibiotica die het vaakst in verband worden gebracht zijn clindamycine, cefalosporinen, ampicilline en amoxicilline (tabel 1) (8).
Naast antibioticatherapie zijn oudere leeftijd en ernst van de onderliggende ziekte belangrijke risicofactoren voor C. difficile-infectie. Andere risicofactoren zijn de aanwezigheid van een nasogastrische tube, gastro-intestinale procedures, zuurremmende medicatie, verblijf op de intensive care unit, en de duur van de ziekenhuisopname (9).
C. difficile diarree wordt voornamelijk veroorzaakt door de uitwerking van toxines A en B die worden geproduceerd door bacteriële vermenigvuldiging in het darmlumen. Deze toxinen binden zich aan het colonslijmvlies en oefenen daar hun schadelijke werking op uit. Het organisme beschadigt het colon zelden door directe invasie, en diarree wordt veroorzaakt door de effecten van toxinen die in het darmlumen worden geproduceerd en zich aan het slijmvliesoppervlak hechten. De meeste toxigene isolaten produceren beide toxinen, en ongeveer 5-25% van de isolaten produceren noch toxine A noch B, en veroorzaken geen colitis of diarree (3-5).
Klinische manifestaties
Infectie met C. difficile kan een breed scala aan klinische manifestaties veroorzaken, waaronder asymptomatisch vervoer, milde tot matige diarree, en fulminante ziekte met pseudomembraneuze colitis (10). Bij patiënten die CDAD ontwikkelen, beginnen de symptomen meestal snel na de kolonisatie. Kolonisatie kan optreden tijdens een antibioticakuur of tot enkele weken na een antibioticakuur. CDAD gaat meestal gepaard met frequente, losse stoelgang die overeenkomt met proctocolitis. Slijm of occult bloed kan aanwezig zijn, maar zichtbaar bloed is zeldzaam.
Diagnose
De diagnose van CDAD is gebaseerd op een voorgeschiedenis van recente of huidige antibioticatherapie, de ontwikkeling van diarree of andere aanwijzingen van acute colitis, en het aantonen van infectie door toxigene C. difficile, gewoonlijk door detectie van toxine A of toxine B in de ontlasting.
 klik voor grote versie
klik voor grote versie
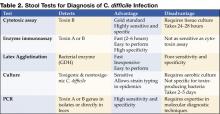
Figuur 1 . Digitale röntgenfoto van CT-scan toont nodulaire haustale verdikking in het transversale colon.
Praktische richtlijnen voor de diagnose van C. difficile-diarree-syndromen
- De diagnose moet worden vermoed bij iedereen met diarree die in de afgelopen 2 maanden antibiotica heeft gekregen en/of bij wie de diarree 72 uur of langer na ziekenhuisopname begint.
- Wanneer de diagnose wordt vermoed, moet één ontlastingmonster naar het laboratorium worden gestuurd om te worden getest op de aanwezigheid van C. difficile en/of zijn toxinen.
- Wanneer de diarree aanhoudt ondanks een negatief ontlastingtoxineresultaat, kunnen een of twee extra monsters worden gestuurd voor onderzoek met dezelfde of verschillende tests (4). Endoscopie is voorbehouden voor speciale situaties, zoals wanneer een snelle diagnose nodig is en de testresultaten vertraagd zijn of de test niet zeer gevoelig is, wanneer de patiënt ileus heeft en er geen ontlasting beschikbaar is, of wanneer ook andere colonziekten een rol spelen.
Er is nog geen eenvoudige, goedkope, snelle, gevoelige en specifieke test voor de diagnose van C. difficile diarree en colitis, noch zijn alle beschikbare tests geschikt om door elk laboratorium te worden gebruikt (tabel 2) (11).
Endoscopische diagnose van C. difficile diarree en colitis
Sigmoïdoscopie en colonoscopie zijn niet geïndiceerd voor de meeste patiënten met CDAD (10,12). Endoscopie is echter nuttig in speciale situaties, zoals wanneer de diagnose twijfelachtig is of de klinische situatie een snelle diagnose vereist. De resultaten van endoscopisch onderzoek kunnen normaal zijn bij patiënten met milde diarree of kunnen in matige gevallen aspecifieke colitis laten zien. Het aantreffen van colonpseudomembranen bij een patiënt met antibiotica-geassocieerde diarree is vrijwel pathognomonisch voor C. difficile colitis. Enkele patiënten zonder diagnostische kenmerken in het rectosigmoïd hebben pseudomembranen in de meer proximale delen van het colon (13). Andere endoscopische bevindingen zijn erytheem, oedeem, brosheid en aspecifieke colitis met kleine ulceraties of erosies.
Behandeling
De eerste stap in de behandeling van C. difficile diarree en colitis is het staken van de precipiterende antibiotica indien mogelijk (10,12). Diarree verdwijnt bij ongeveer 15-25% van de patiënten zonder specifieke anti-C. difficile therapie (14,15). Conservatieve behandeling alleen is echter niet geïndiceerd bij patiënten die systemisch ziek zijn of die meerdere medische problemen hebben, omdat het moeilijk te voorspellen is welke patiënten spontaan beter zullen worden. Indien het niet mogelijk is het precipiterende antibioticum te staken wegens andere actieve infecties, moet het antibioticaschema van de patiënt indien mogelijk worden gewijzigd om gebruik te maken van middelen die minder kans maken CDAD te veroorzaken (b.v, aminoglycosiden, trimethoprim, rifampine, of een quinolon).
Antiperistaltische middelen, zoals difenoxylaat plus atropine (Lomotil), of loperamide (Imodium), en verdovende pijnstillers moeten worden vermeden omdat zij de klaring van toxinen uit het colon kunnen vertragen en daardoor toxine-geïnduceerde colonschade kunnen verergeren of ileus en toxische dilatatie kunnen precipiteren (12,16). Specifieke therapie om C. difficile uit te roeien moet worden toegepast bij patiënten met aanvankelijk ernstige symptomen en bij patiënten bij wie de symptomen aanhouden ondanks het staken van de behandeling met antibiotica. Hoewel de diagnose van C. difficile colitis idealiter moet worden vastgesteld voordat antimicrobiële therapie wordt toegepast, bevelen de huidige ACG-richtlijnen aan dat empirische therapie moet worden gestart bij zeer suggestieve gevallen van ernstig zieke patiënten (tabel 3 op pagina 54) (12).
Huidig worden orale vancomycine of metronidazol, gebruikt gedurende 7 tot 10 dagen, door de meeste auteurs en de huidige richtlijnen als eerstelijnstherapie beschouwd. Metronidazol in een dosis van 250 mg 4 keer per dag wordt door de meeste auteurs en ACG-richtlijnen aanbevolen als het geneesmiddel van keuze voor de initiële behandeling van C. difficile colitis (12). Deze aanbevelingen zijn grotendeels gebaseerd op werkzaamheid, lagere kosten, en bezorgdheid over de ontwikkeling van vancomycine-resistente stammen. Belangrijke nadelen van metronidazol zijn een minder wenselijk geneesmiddelenprofiel en contra-indicaties bij kinderen en zwangere vrouwen.
Vancomycine daarentegen, in een dosis van 125 mg 4 maal daags, is veilig en goed verdraagbaar en bereikt ontlastingniveaus die 20 keer hoger zijn dan de vereiste minimale remmende concentratie voor de behandeling van C. difficile. Nadelen van het gebruik van vancomycine zijn de kosten en de mogelijke ontwikkeling van vancomycineresistente stammen. De huidige ACG-richtlijnen beschouwen vancomycine als het middel van keuze bij ernstig zieke patiënten en in gevallen waarin het gebruik van metronidazol uitgesloten is.
Gecontroleerde klinische onderzoeken ontbreken voor patiënten met fulminante colitis die mogelijk geen orale therapie verdragen. Toediening van metronidazol intraveneus of toediening van vancomycine via een nasogastrische buis of rectaal klysma is beschreven in kleine case series (17-20). Intraveneuze toediening van vancomycine wordt niet aanbevolen, omdat het geneesmiddel niet in het colon wordt uitgescheiden (17).
Behandeling van recidiverende C. difficile diarree
Ondanks succesvolle initiële behandeling van CDAD, treedt bij 15-20% van de patiënten recidief diarree op in combinatie met een positieve ontlastingstest voor C. difficile toxine. Symptomatisch recidief is zelden te wijten aan falende behandeling of antimicrobiële resistentie tegen metronidazol of vancomycine. Behandelingstherapie omvat conservatieve therapie (veel patiënten zijn echter bejaard en zwak en kunnen geen diarree verdragen), therapie met specifieke anti-C. difficile antibiotica, het gebruik van anionbindende harsen, therapie met micro-organismen (probiotica), en immunoglobulinetherapie.
De meest voorkomende therapie voor recidiverende C. difficile diarree is een tweede kuur met hetzelfde antibioticum dat werd gebruikt om de eerste episode te behandelen (12). In een grote observationele studie in de Verenigde Staten reageerde 92% van de patiënten met recidiverende CDAD met succes op een enkele herhaalde kuur, meestal met metronidazol of vancomycine (14). Er zijn aanwijzingen dat patiënten met een recidief in het verleden een hoog risico hebben op nieuwe episoden van CDAD nadat de antibioticatherapie is gestaakt. Er zijn geen gegevens die suggereren dat opeenvolgende episoden progressief ernstiger of gecompliceerder worden (21). Er zijn verschillende behandelingsschema’s voorgesteld voor patiënten met meerdere recidieven van C. difficile diarree. Eén benadering is het geven van een verlengde kuur van vancomycine (of metronidazol) met gebruikmaking van een afnemend doseringsschema gevolgd door pulstherapie (tabel 4).
Cholestyramine, een anionenuitwisselingshars dat in een dosis van 4 gram 3 tot 4 maal daags gedurende 1 tot 2 weken wordt toegediend, bindt C. difficile-toxinen en kan samen met antibiotica worden gebruikt om herhaalde recidieven te behandelen. Omdat cholestyramine zowel vancomycine als toxinen kan binden, moet het ten minste 2 tot 3 uur na de inname van vancomycine worden ingenomen.
Erge C. difficile colitis
De incidentie van fulminante C. difficile colitis is gerapporteerd op 1,6-3,2% (22). Hoewel recente nauwkeurige cijfers van andere centra ontbreken, wordt het erkend als een toenemende oorzaak van complicaties en overlijden. Het klinisch syndroom van fulminante C. difficile colitis kan worden herkend met een goede kennis van het spectrum van ziektepresentatie.
A. Diarree: Hoewel diarree het kenmerk van C. difficile colitis is, is deze niet altijd aanwezig, en de afwezigheid ervan kan tot diagnostische verwarring leiden. Wanneer diarree afwezig is, lijkt dit secundair te zijn aan ernstige dysmotiliteit van de dikke darm. Zelfs wanneer diarree aanwezig is, kan dit worden gezien als een ondergeschikte component van een aspecifiek septisch beeld.
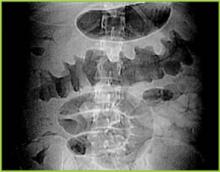 Overgenomen met toestemming van BUMC Proceedings 1999; 12:249-250
Overgenomen met toestemming van BUMC Proceedings 1999; 12:249-250
Figuur 1 . Digitale radiografie van CT scan toont nodulaire haustale verdikking in het transversale colon.
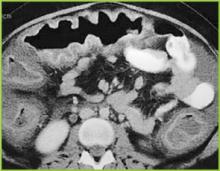 Overgenomen met toestemming van BUMC Proceedings 1999; 12:249-250
Overgenomen met toestemming van BUMC Proceedings 1999; 12:249-250
Figuur 2 . CT-beeld van de bovenbuik bevestigt duidelijke haustrale verdikking in het transversale colon.
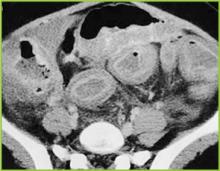 Overgenomen met toestemming van BUMC Proceedings 1999; 12:249-250
Overgenomen met toestemming van BUMC Proceedings 1999; 12:249-250
Figuur 3 . CT-beeld van het midden van de buik toont een duidelijke verdikking van het hele colon. Milde ontstekingsveranderingen zijn aanwezig in het pericolonische vet.
B. Ernstige ziekte: Fulminante colitis is een ongebruikelijke vorm van C. difficile-infectie, die slechts bij 3% van de patiënten voorkomt, maar die verantwoordelijk is voor vrijwel alle ernstige complicaties. Patiënten met ernstigere vormen van de ziekte kunnen zich met of zonder diarree presenteren. Wanneer patiënten colitis ontwikkelen die gelokaliseerd is in de blindedarm en de rechterzijde van het colon, kan de diarree minimaal of afwezig zijn. Bij afwezigheid van diarree kunnen de enige aanwijzingen voor de diagnose systemische tekenen van toxiciteit zijn (koorts, tachycardie, leukocytose en/of volumedepletie).
Een verhoogd aantal witte bloedcellen kan een belangrijke aanwijzing zijn voor een op handen zijnde fulminante C. difficile colitis. De snelle verhoging van het perifere aantal witte bloedcellen (gewoonlijk zo hoog als 30.000 tot 50.000) met een aanzienlijke overmaat aan banden en soms meer onrijpe vormen gaat vaak vooraf aan hemodynamische instabiliteit en de ontwikkeling van orgaan disfunctie. Zelfs bij patiënten die gedurende langere tijd weinig symptomen vertonen, kan plotseling en onverwacht een shock optreden. Het is moeilijk te voorspellen welke patiënten niet op medische behandeling zullen reageren. Daarom kunnen vroegtijdige waarschuwingssignalen zoals een leukemie-reactie van onschatbare waarde zijn.
Hypotensie is een late bevinding en kan resistent zijn tegen vasopressor-ondersteuning. Abdominale symptomen variëren van distensie tot gegeneraliseerde tederheid met waakzaamheid. Colonperforatie gaat meestal gepaard met abdominale rigiditeit, onvrijwillige waakzaamheid, rebound tederheid, en afwezigheid van darmgeluiden. Vrije lucht kan zichtbaar zijn op de röntgenfoto van de buik. Elke verdenking van perforatie in deze situatie moet onmiddellijk een chirurgische ingreep noodzakelijk maken. De dood treedt meestal in voordat vrije lucht en perforatie kunnen optreden. In één studie bleek perforatie, in tegenstelling tot de meeste andere literatuur, zeldzaam te zijn (22).
Röntgenfoto’s van de buik kunnen een uitgezet colon (met een grootste diameter van >7 cm) laten zien, in overeenstemming met toxisch megacolon. Patiënten met megacolon kunnen een geassocieerde dunne darm ileus hebben met uitgezette dunne darm op gewone abdominale radiografieën, met lucht-vloeistofniveaus die een dunne darm obstructie of ischemie nabootsen. CT zonder contrast en endoscopie kunnen snel de diagnose stellen of ten minste sterk wijzen op fulminante C.difficile colitis. Op de CT-scan kunnen ascites, verdikking en/of verwijding van de colonwand worden aangetoond. Deze bevindingen kunnen nuttig blijken bij het categoriseren van de ernst van de colitis.
Aanvallender ingrijpen bij medisch niet reagerende patiënten, met inbegrip van snelle identificatie van patiënten die niet reageren op medische therapie, is van cruciaal belang voor een positief resultaat, en in deze groep moet vroegtijdig chirurgisch worden ingegrepen (figuren 1-3).
Het is belangrijk dat iedereen die betrokken is bij de patiëntenzorg in ziekenhuizen, verpleeghuizen en verzorgingshuizen wordt voorgelicht over het organisme en de epidemiologie ervan, rationele benaderingen voor de behandeling en verzorging van patiënten met C. difficile diarree, het belang van handen wassen tussen contacten met patiënten, het gebruik van handschoenen bij de verzorging van een patiënt met C. difficile diarree, en het vermijden van onnodig gebruik van antimicrobiële middelen.
Conclusie
De laatste jaren is bezorgdheid ontstaan over de stijgende incidentie en het aantal ernstige complicaties van CDAD in Noord-Amerikaanse ziekenhuizen (22,23). Het tijdschrift van de Canadian Medical Association publiceerde in 2004 een rapport met details over een uitbraak van CDAD waarbij verschillende ziekenhuizen in Montreal betrokken waren. De introductie van nieuwe hypervirulente en zeer overdraagbare stammen van C. difficile werd als mogelijke oorzaak voor de uitbraak genoemd (24). Een verslechterende infrastructuur, inadequate infectiecontrolepraktijken, het toenemende aantal verzwakte patiënten, een vergrijzende bevolking en hypervirulente stammen werden alle waarschijnlijk geacht bij te dragen aan de recente uitbraken in Canada (25).
Twee epidemiologische onderzoeken in de Verenigde Staten en Canada (24,26) onderzochten onafhankelijk van elkaar monsters van C. difficile en ontdekten dat een gemuteerde versie van de “wilde” stam verantwoordelijk was voor de uitbraken in Quebec en de recente toename van CDAD in ziekenhuizen in de Verenigde Staten (22,23). Klinische epidemiologen van het CDC onderzochten C. difficile-isolaten van ziekenhuizen in de Verenigde Staten met recente (d.w.z. 2001-2004) CDAD-uitbraken (22,23). Het rapport wijst op de opkomst van een nieuwe epidemische stam, “BI” (verschillend van de “J”-stam van 1989-1992), die verantwoordelijk kan zijn voor de recente toename van het aantal en de schijnbare ernst van CDAD (26).
CDAD en colitis kunnen in de meeste gevallen worden behandeld door de toediening van metronidazol of vancomycine. Bij sommige patiënten ontwikkelt zich ondanks adequate en tijdige medische behandeling ernstige levensbedreigende toxiciteit, en is chirurgisch ingrijpen noodzakelijk. Systemische symptomen van infectie met C. difficile zijn naar verluidt niet het gevolg van bacteriëmie, colonperforatie of ischemie, maar van toxine-geïnduceerde ontstekingsmediatoren die uit het colon vrijkomen (27-29). Bij refractaire gevallen van ernstige ziekte moet vroegtijdig chirurgisch worden ingegrepen. Chirurgisch ingrijpen is echter verre van ideaal en brengt een zeer hoog percentage complicaties en een aanzienlijk risico op sterfte met zich mee (22). De toekomstige klinische benadering van de behandeling van nosocomiale C. difficile colitis kan uiteindelijk specifieke antitoxine hyperimmunoglobulinen en remmers van de ontstekingscascade omvatten (28,30,31).
- Archibald LK, Banerjee SN, Jarvis WR. Secular trend in hospital-acquired Clostridium difficile disease in the United States; 1987-2001. J Infect Dis. 2004;189:1585-9.
- Fekety R. Antibiotica-geassocieerde colitis. In: Mandell G, Bennet JE, Dolin R, eds. Principles and Practice of Infectious Diseases. 4th ed. New York: Churchill Livingston; 1996:978-806.
- Mitty RD, LaMont T. Clostridium difficile diarrhea: Pathogenesis, epidemiology, and treatment. Gastroenterologist. 1994;2:61-9.
- Bartlett JG. Clostridium difficile: Geschiedenis van zijn rol als enterisch pathogeen en de huidige stand van de kennis over het organisme. Clin Infect Dis. 1994;18(Suppl 4):265-72.
- Johnson S, Gerding D. Clostridium difficile. In: Mayhall CG, ed. Hospital Epidemiology and Infection Control. Baltimore, Md: Williams & Wilkins; 1996:99-408.
- Mcfarland LV, Mulligan ME, Kwok RY, Stamm WE. Nosocomiale verwerving van Clostridium difficile. N Engl J Med. 1989;320:204-10.
- Hall IC, O Toole E. Intestinal Flora in new-born infants: With a description of a new pathogenic anaerobe, Bacillus difficile. Am J Dis Child. 1935;49:390-402.
- Kelly CP, LaMont JT. Behandeling van Clostridium difficile diarree en colitis. In: Wolfe MM, ed. Gastro-intestinale farmacotherapie. Philadelphia, Pa.: WB Saunders; 1993:199-212.
- Bignardi GE. Risicofactoren voor Clostridium difficile infectie. J Hosp Infect. 1998;40:1-15.
- Kelly CP, Pothoulakas C, LaMont JT. Clostridium difficile colitis. N Engl J Med. 1994;330:257-62.
- Linevsky JK, Kelly CP. Clostridium difficile colitis. In: Lamont JT, ed. Gastro-intestinale Infecties: Diagnosis and Management. New York: Marcel Dekker; 1997:293-325.
- Fekety R. Guidelines for the diagnosis and management of Clostridium difficile associated diarrhea and colitis. American College of Gastroenetrology, Comité Praktijkparameters. Am J Gastroenterol. 1997;92:739-50.
- Tedesco FJ, Corless JK, Brownstein RE. Rectale sparing bij antibiotica-geassocieerde pseudomembraneuze colitis: Een prospectieve studie. Gastroenterology. 1982;83:1259-60.
- Olson MM, Shanholtzer CJ, Lee JT Jr, Gerding DN. Ten years of prospective Clostridium difficile-associated disease surveillance and treatment at the Minneapolis VA Medical Center, 1982-1991. Infect Control Hosp Epidemiol. 1994;15: 371-81.
- Teasley DG, Gerding DN, Olson MM, et al. Prospective randomized trial of metronidazole versus vancomycin for Clostridium-difficile-associated diarrhoea and colitis. Lancet. 1983;2:1043-6.
- Walley T, Milson D. Loperamide-gerelateerd toxisch megacolon in Clostridium difficile colitis. Postgrad Med J. 1990;66:582.
- Malnick SD, Zimhony O. Treatment of Clostridium difficile associated diarrhea. Ann Pharmacother. 2002;36:1767-75.
- Sehgal M, Kyne L. Clostridium difficile disease. Curr Treatment Options Infect Dis. 2002;4:201-10.
- Apisarnthanarak A, Razavi B, Mundy LM. Adjunctive intracolonic vancomycin for severe Clostridium difficile colitis: case series and review of the literature. Clin Infect Dis. 2002;35:690-6.
- Friendenberg F, Fernandez A, Kaul V, Niami P, Levine GM. Intraveneuze metronidazol voor de behandeling van Clostridium difficile colitis. Dis Colon Rectum. 2001;44:1176-80.
- Fekety R, McFarland LV, Surawicz CMGreenberg, RN, Elmer GW, Mulligan ME. Recurrent Clostridium difficile diarrhea: characteristics of and risk factors for patients enrolled in a prospective, randomized, double-blind trial. Clin Infect Dis. 1997;24:324-33.
- Dallal RM, Harbrecht BG, Boujoukas AJ, et al. Fulminant Clostridium difficile: an underappreciated and increasing cause of death and complications. Ann Surg. 2002;235:363-72.
- Morris AM, Jobe BA, Sontey, M, Sheppard BC, Deveney CW, Deveney KE. Clostridium difficile colitis: een steeds agressievere iatrogene ziekte? Arch Surg. 2002;137:1096-100.
- Eggerston L, Sibbald B. Hospitals battling outbreaks of C. difficile. CMAJ. 2004;171:19-21.
- Valiquette L, Low DE, Pepin J, McGeer A. Clostridium difficile infectie in ziekenhuizen: a brewing storm. CMAJ. 2004;171:27-9.
- McDonald LC, Killgore GE, Thompson A, et al. Emergence of an epidemic strain of Clostridium difficile in the United States, 2001-4: Potentiële rol voor virulentiefactoren en antimicrobiële resistentie-eigenschappen. Infectious Diseases Society of America 42e jaarlijkse bijeenkomst. Boston, MA, 30 september – 3 oktober 2004. Abstract # LB-2.
- Flegel W, Muller F, Daubener W, Fischer HG, Hadding U, Northoff H. Cytokine response by human monocytes to Clostridium difficile toxin A and toxin B. Infect Immun. 1991;59:3659-66.
- Castagliuolo I, Keates A, Qiu B, et al. Increased substance P responses in dorsal root ganglia, intestinal macrophages during Clostridium difficile toxin A enteritis in rats. Proc Natl Acad Sci U S A. 1997;94:4788-93.
- Castagliuolo I, Keates A, Wang C, et al. Clostridium difficile toxine A stimuleert macrophage-inflammatory protein-2 productie in rat intestinal epithelial cells. J Immunol. 1998;160:6039-45.
- Kelly C, Chetham S, Keates S, et al. Survival of anti-Clostridium difficile bovine immunoglobulin concentrate in the human gastrointestinal tract. Antimicrob Agents Chemother. 1997;41:236-41.
- Salcedo J, Keates S, Pothoulakis C, et. al. Intraveneuze immunoglobulinetherapie voor ernstige Clostridium difficile colitis. Gut. 1997;41:366-70.