Immunofluorescentie (IF) is een gangbare morfologische benadering die wordt gebruikt om de distributie van subcellulaire componenten te bepalen. Bij IF-analyses zijn antilichamen nodig die zijn geconjugeerd met fluorescerende kleurstoffen. Het antilichaam herkent specifiek het antigeen door binding aan de epitoop van het doelwit, en de fluorofoor wordt gedetecteerd onder een fluorescentiemicroscoop. Op die manier kunnen subcellulaire componenten tegen een donkere achtergrond worden gevisualiseerd. IF kan ook worden gebruikt als alternatieve semikwantitatieve analysemethode om de expressie van de betrokken stof te controleren.
Er zijn drie soorten IF: directe IF, indirecte IF en gecombineerde IF.
Directe IF is het gebruik van een enkel primair antilichaam dat is geconjugeerd met fluorescerende kleurstof.
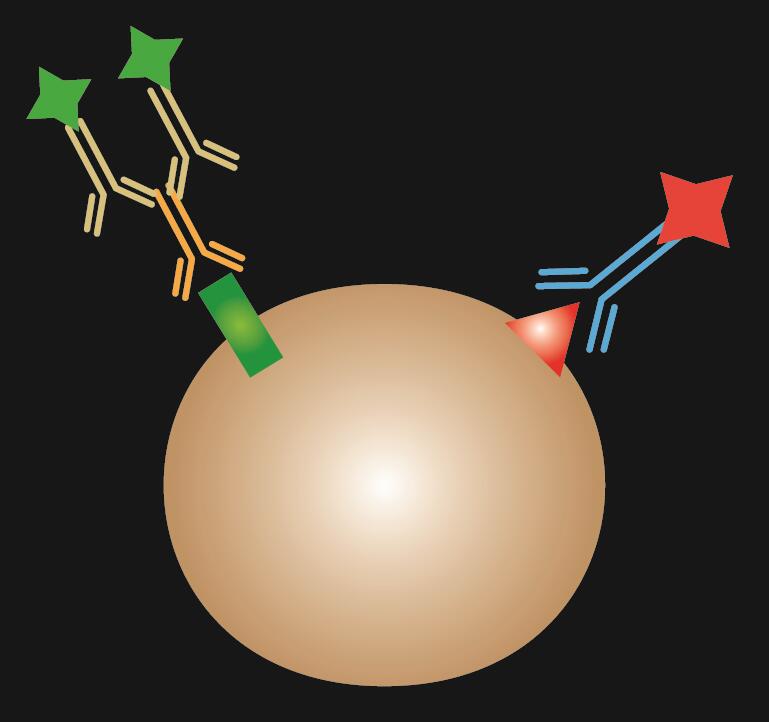
Indirecte IF is het gebruik van twee antilichamen voor de kleuring: primair antilichaam dat specifiek bindt aan epitoop en een bijpassend secundair antilichaam dat is geconjugeerd met fluorescentiekleurstof.
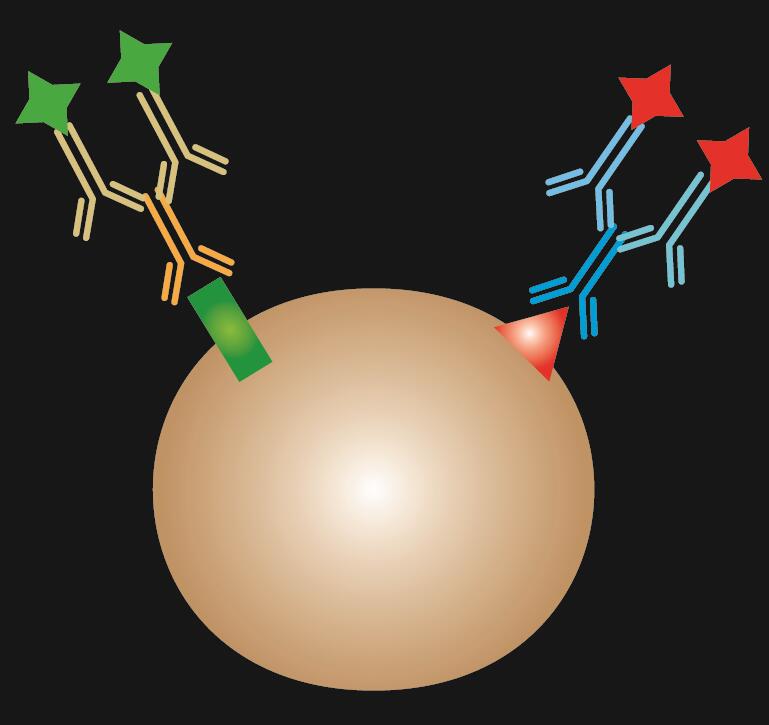
Gecombineerde IF is een combinatie van directe en indirecte IF-kleuring.
Tabel 1. Vergelijking van directe, indirecte en gecombineerde IF.
| IF type | Direct | Indirect | Gecombineerd |
|---|---|---|---|
| Schematisch diagram | 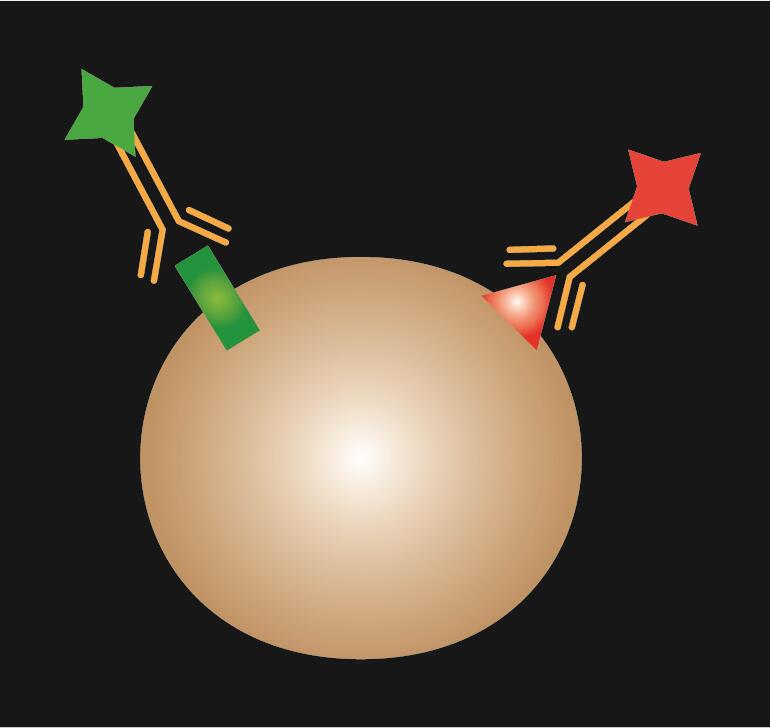 |
 |
 |
| Voordelen |
|
|
|
| Voordelen |
|
|
|
Van de drie soorten IF, is de indirecte IF-methode het populairst.
IF kan worden toegepast op weefselcoupes, gekweekte cellijnen en afzonderlijke cellen. Het proces van IF is vergelijkbaar met immunohistochemie (IHC).
- Monsterafname en fixatie
Monsters moeten snel worden gefixeerd na weefselverwijdering, en het is beter om pre-fixatie uit te voeren door middel van hartinfusie met 4% formaldehyde of paraformaldehyde bij kleine dieren zoals knaagdieren. Aanbevolen wordt de weefsels niet dikker te maken dan 10 mm en het volume van het fixeermiddel ten minste 15-20 maal groter te maken dan het volume van het weefsel. Fixatie is zeer belangrijk voor het behoud van de morfologie en de structuur van de cel, alsmede van de integriteit van het antigeen. Fixatieoplossingen moeten dus zorgvuldig worden gekozen volgens de verschillende antigenen en weefselmonsters.
Tabel 2. Fixatiestrategie voor gedeeltelijke antigenen.
| Antigeen | Fixeeroplossing | Fixatievoorwaarde |
|---|---|---|
| Meest eiwit | 95~100% alcohol 4% paraformaldehyde |
3~10 min bij 37℃ 4~24 uur bij 4℃ |
| Enzym | Aceton | 15 min bij RT |
| Hormoon | 95% alcohol plus 1~5% ijsazijn | 30 min. bij 4℃ |
| Immune globulin | 95% alcohol Carbon tetrachloride |
10 min bij 37℃ dan 15 min bij 4℃ |
| Fibrous protein | 95% alcohol plus 1~5% ijsazijn | 10 min bij 37℃ dan 15 min bij 4℃ |
| Virus | Aceton Carbon tetrachloride Alcohol |
5~10 min bij RT dan 30~60 min bij 4℃ |
| Polysaccharide en bacteriën | Aceton 10% formaldehyde Methanol |
3~10 min bij RT dan 30~60 min bij 4℃ |
| Lipoid | 10% formaldehyde | 3~10 min bij RT |
| Gekweekte cel | Warm 4% paraformaldehyde | 15~20 min bij RT |
- Dehydratie en inbedden
Dehydratie is vereist bij de voorbereiding van weefselcoupes om de volgende redenen:
1. Paraffine sectie: Paraffine is niet mengbaar met water.
2. Diepgevroren sectie: Bevroren ijskristallen zouden de morfologie van de cellen vernietigen.
Dehydratie wordt altijd uitgevoerd door het weefsel onder te dompelen in een ernstige van toenemende gradiënt ethanoloplossing of sucroseoplossing.
Daarna kunnen weefselmonsters worden ingebed door gesmolten paraffinewas toe te voegen voor paraffineprosecties, terwijl OCT-verbinding wordt toegevoegd voor bevroren secties. Deze stap zorgt voor de juiste hardheid voor zachte weefselmonsters en maakt het mogelijk het weefsel gemakkelijk te snijden.
- Sectie en kleuring
Ingebedde weefsels kunnen worden doorgesneden tot dunne plakjes met een microtoom of vriesmicrotoom. De dikte van de plakjes moet worden bepaald aan de hand van de celdiameter en het doel van IF-assay. Dunnere plakjes (≤ 10 urn) worden voorgesteld om direct te monteren op zelfklevende dia’s vóór kleuring, zoals ze zijn gemakkelijk te worden gestaved in de meerdere wasstappen. Dikkere plakjes (10 ~ 30 pm) zal betere beelden te bereiken door het gebruik van vrij zwevende methode, als het primaire antilichaam kan doordringen aan beide zijden van de slice. En vrij zwevende secties zijn gemonteerd op dia’s na kleuring. Vrij zwevende secties van kleine weefsels zoals de dorsale ganglia wortel van de muis (DRG) zijn moeilijk uit te voeren en gemakkelijk te verliezen monster. Daarom wordt de kleefstripmethode aanbevolen voor sommige kleine weefselmonsters. De kleuringsstappen moeten in het donker worden uitgevoerd wanneer een met fluorescerende kleurstof geconjugeerd antilichaam wordt gebruikt.
Reik naar IF-protocollen:
- Steek sectie
- Vrij zwevende sectie
- Gekweekte cellen
- Imaging en analyse
Positieve signalering wordt gevirtualiseerd onder een fluorescentiemicroscoop in een donkere achtergrond. De plaats van belang wordt meestal bepaald door co-kleuring van een eiwit waarvan de plaats bekend is. Als alternatief kan het aantal positieve cellen of de fluorescentie-intensiteit van positieve signalering worden gemeten voor een kwantitatieve analyse. Een sterkere fluorescentie-intensiteit wijst bijvoorbeeld op een relatief hoge expressie van het doeleiwit.
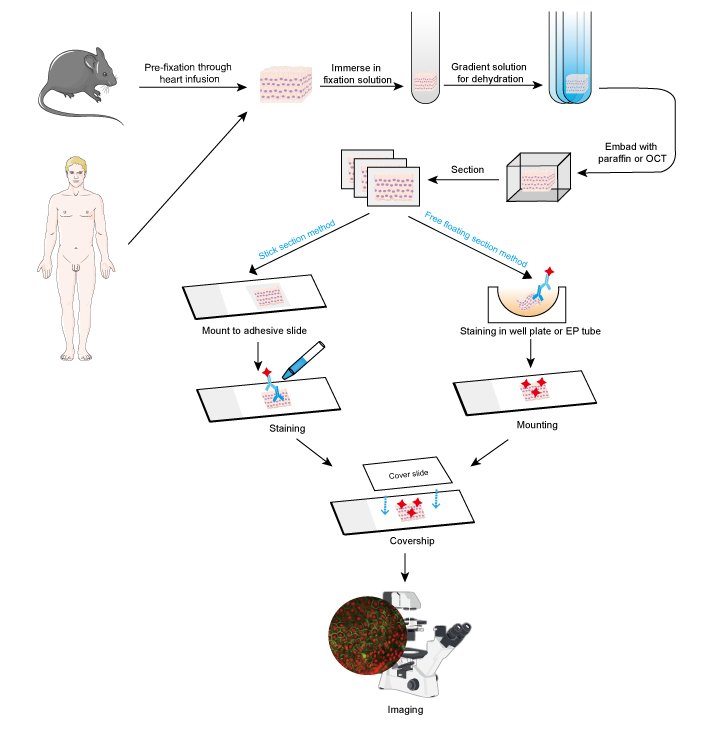
Figuur 1.
IF en IHC zijn beide krachtige benaderingen voor morfologieanalyse met belangrijke diagnostische en prognostische toepassingen. In uw onderzoek moet rekening worden gehouden met een aantal verschillen:
Tabel 3. Vergelijking tussen IHC en IF
| IHC | IF | |
|---|---|---|
| Labelingsmethode | Chromogeen | Fluorescerend |
| Processing step | Meer als substraat nodig | Minder |
| Image |
|
|
| microscoop | lichtmicroscoop | fluorescentiemicroscoop |
| stabiliteit | stabiel gedurende jaren | minder stabiel door fotobleaching |
| Voorbeeld (muis hippocampus) |
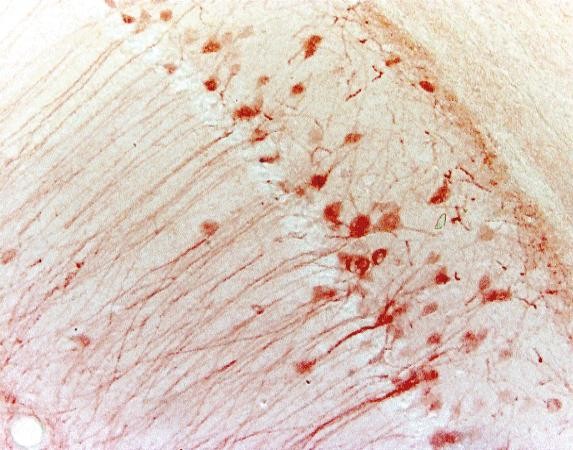 |
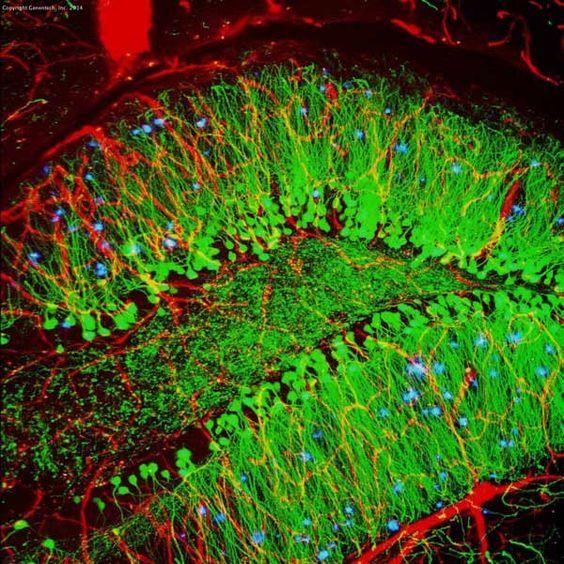 |