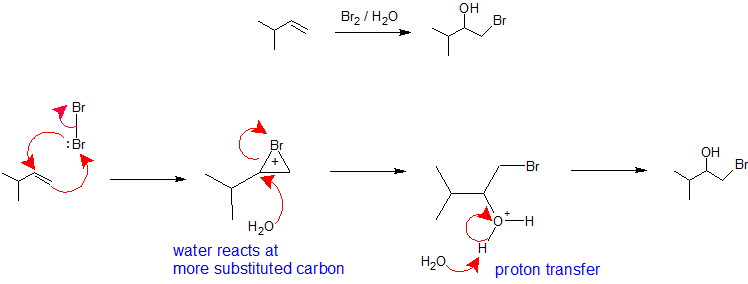
Mechanismen die de regioselectiviteit verklaren
X2/H2O of X2/ROH: De regioselectiviteit van halohydrinevorming uit een alkeenreactie met een halogeen in een nucleofiel oplosmiddel is analoog aan de oxymercuratie-demercuratie-route. Het halogeenmolecuul neemt de rol van elektrofiel op zich en accepteert nucleofiele pi elektronen van het alkeen terwijl het tegelijkertijd een binding vormt met de andere vinylkoolstof om een bromonium (of chloroium) ion te creëren. De vorming van het bromonium- (of chloronium-)ion stabiliseert de positieve lading en voorkomt herschikking van het carbokation. Het oplosmiddel neemt de rol van nucleofiel op zich omdat het in een veel hoger percentage aanwezig is dan de vertrekkende groep en reageert met de meest gesubstitueerde koolstof van het cyclische bromonium- (of chloronium-)ion om regiochemie te creëren. De stereochemie van deze reactie is anti-additie omdat het oplosmiddel het bromoniumion met achterwaartse oriëntatie benadert om het additieproduct te produceren. Aangezien de interactie van het halogeen met het alkeen echter van bovenaf of van onderaf kan plaatsvinden, is er geen stereochemische controle bij deze reactie en zal er in voorkomend geval een mengsel van enantiomeren ontstaan. De laatste stap van dit mechanisme is een protonoverdracht naar een watermolecuul in het oplosmiddel om het additieproduct te neutraliseren.
HOX of RSCl: De regioselectiviteit van de reacties met hypohaloge zuren en sulfenylchloride kan worden verklaard door hetzelfde mechanisme dat we hebben gebruikt om de Markovnikov-regel te rationaliseren. De binding van een elektrofiel intermediair aan de dubbele binding van een alkeen vormt bij voorkeur het stabielere (sterker gesubstitueerde) carbokation. Dit tussenproduct zou vervolgens snel moeten combineren met een nucleofiele stof om het additieproduct te produceren.
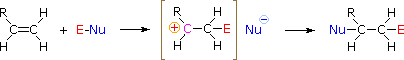
Om dit mechanisme toe te passen moeten we het elektrofiele deel in elk van de reagentia bepalen. Door gebruik te maken van elektronegativiteitsverschillen kunnen we gewone additiereagentia ontleden in elektrofiele en nucleofiele groepen, zoals hiernaast is weergegeven. In het geval van hypochlorige en hypobrome zuren (HOX), reageren deze zwakke Brønsted zuren (pKa’s ongeveer 8) niet als proton donors; en aangezien zuurstof elektronegatiever is dan chloor of broom, zal het elektrofile een halogenide kation zijn. De nucleofiele soort die zich bindt aan het tussenliggende carbokation is dan het hydroxide-ion, of waarschijnlijker water (het gebruikelijke oplosmiddel voor deze reagentia), en de producten worden halohydrinen genoemd. Sulfenylchloriden voegen op de omgekeerde manier toe, omdat het elektrofileen een zwavelkation is, RS(+), terwijl het nucleofiele deel een chloride-anion is (chloor is elektronegatiever dan zwavel).
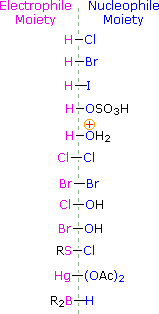
Hieronder staan enkele voorbeelden van de toevoeging van verschillende elektrofiele halogeenreagentia aan alkeengroepen. Let op de specifieke regiochemie van de producten, zoals hierboven uitgelegd.
Oefening
1. Voorspel het product van de volgende reactie:

2. Bij de behandeling van buteen met NBS in aanwezigheid van water blijkt uit het product dat het broom op de minst gesubstitueerde koolstof zit, is dit Markovnikov of anti-Markovnikov?
Antwoord

2. Aangezien het broom de eerste toevoeging aan het alkeen is, zou deze toevoeging een anti-Markovnikov toevoeging zijn.
Bijdragers
-
Prof. Steven Farmer (Sonoma State University)
-
William Reusch, emeritus hoogleraar (Michigan State U.), Virtual Textbook of Organic Chemistry