XeF4 または四フッ化キセノンはキセノンとフッ化物原子からなる化学化合物で、キセノン原子はフッ化水素酸とフッ化物原子からなる。 世界で初めて発見された二元系化合物である。 化学式は
Xe +2 F2 -> XeF4
XeF4は白い固体で、固体の場合4.040 g cm-3の密度を持つ。 通常の条件下では、無色の結晶のように見えます。 昇華温度は115.7℃(華氏240.26度)です。 他のフッ化キセノンと同様に、四フッ化キセノンは発熱性生成物です。 常温常圧では、安定した状態を保ちます。 水と瞬時に反応し、酸素分子、フッ化水素、純粋なキセノンガスを放出する。
| 分子名 | Xenon Tetrafluoride (XeF4) |
| 原子価の数 分子内の電子数 | 36 |
| XeF4のハイブリダイゼーション | sp3d2 hybridization |
| 結合角 | |
| XeF4の分子構造 | 正方形平面 |
その物性や化学特性をより知るためには、その分子構造を知ることが必要です。 そのルイス構造と分子形状を知る必要があります。 ここでは四フッ化キセノンのルイス構造を調べてみましょう。
ルイス構造を作るためには、XeF4の価電子を知り、分子内の原子の配置を知る必要があります。
内容
XeF4 価電子
この分子にはキセノンが1原子、フッ素が4原子含まれています。 この両原子の価電子を計算し、XeF4の価電子の総数を求めます。
キセノンの価電子数=8
フッ素の価電子数=7*4(フッ素原子は4個なので4倍)
Xef4の価電子の総数です。 8 + 7*4
: 8 + 28
: 36
したがってXeF4の価電子は合計36個となります。
XeF4のルイス構造
四フッ化キセノンの価電子がわかったので、そのルイス構造を描くのが楽になります。 このルイス点構造は、分子内の個々の原子の周りの価電子を、それが形成する結合とともに絵で表したものです。
構造中の結合は線で示し、結合形成に参加していない電子は点で示します。 結合を形成しない電子は非結合電子あるいは孤立電子と呼ばれる。
ここで、キセノンは最も電気陰性度の低い原子なので、中央に置き、他のすべてのフッ素原子をその周りに置くことにします:

さて、すべての原子を置いたところで、それぞれのフッ素原子とキセノン原子間の結合を見ていきましょう。 この分子には単結合が4つあるので、36個のうち8個の電子が使われています。
原子の周りに残りの価電子を配置し始めます。 各フッ素原子は、結合を作るために1個の電子が使われたので、その周りに6個の価電子を持つことになります。
すでに28個の電子のうち24個をフッ素原子の周りに配置していることにお気づきでしょうか。 残りの非結合電子や孤立電子対は、オクテットルールの例外であるキセノンに配置されることになります。
この2組の非結合電子をキセノンに配置すると、キセノンに2つの孤立電子、各フッ素原子に6つの非結合電子があるルイス構造ができあがります。
XeF4の混成
中心のキセノン原子の軌道が混成され、新しい混成軌道が形成されることになります。 キセノンは5p軌道に6個の電子、5s軌道に2個の電子を持つ。 キセノンの基底状態では、d軌道とf軌道には電子が存在しない。 しかし、この原子が励起状態になると、p軌道にあった2個の電子がd軌道に移動し、その結果、不対電子は全部で4個となる。 このうち、2個の不対電子はp軌道に、残りの2個の不対電子はd軌道に存在する。 これらの混成軌道により、XeF4はsp3d2混成軌道となる。
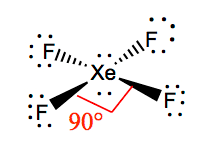
XeF4の分子構造
ある分子のルイス構造が分かれば、その分子構造を理解するのは容易である。 キセノンは2個の孤立電子を持つので、これらの孤立電子が反発力を回避できるような構造をとります。 これらの反発を最小限に抑えるために、ローンペアは垂直な面を持つことになります。 また、フッ素原子が4つあるため、分子形状が正方形の平面となるような配置になります。 XeF4の電子配置は八面体であり、四フッ化キセノンの分子形状は正方形の平面となる。

XeF4 Bond angles
F-Xe-F の結合角度は90度、ローンペアは180度です。 フッ素原子が互いに90度ずれているため、分子平面内で電子が対称に分布していることになります。 これらの結合角は、正方形の平面的な分子形状の形成に寄与している。
XeF4 Polarity – Is XeF4 Polar or Nonpolar?
キセノン原子とフッ素原子の結合は極性ですが、XeF4は無極性分子です。 どうしてでしょうか? Xe-F結合はすべて相互に反対側にあり、双極子モーメントの和はゼロになります。 キセノン原子に4個の電子があり、それが非結合電子のペアとして局在しているため。 分子内の原子と電子の全体的な配置が、双極子のベクトル和がゼロになるようになっているので、XeF4は無極性分子である。
おわりに
四フッ化キセノンは比較的理解しやすい分子の一つである。 すべてのフッ素原子が対称的に配置されているため、ルイス構造は最も複雑でない構造の1つである。 分子内のローンペアは、その反発力を最小限に抑えるため、八面体の垂直な面に配置されています。
このブログ記事をまとめると、XeF4は36個の価電子を持っていると言えます。 キセノンの中心原子に非結合電子のローンペアを2つ持っています。 この分子は、八面体の電子形状と正方形の平面状の分子形状を持つ。 XeF4は非極性分子であり、sp3d2混成である
。