Abstract
低品位イルメナイトは大気圧、80℃の濃塩酸で浸出することが可能である。 不溶物をろ過した後、TiO2+とFe2+を含む溶液を加熱して水酸化チタンを析出させ、HClを回収する。 その後、水酸化チタンを焼成して95%以上のTiO2を含む合成ルチルとし、FeCl2を酸素加水分解または流動化させてHClとFe2O3を回収する。 このプロセスは当然、高品位のイルメナイトに適用することができます。 高品位イルメナイトにしか適用されない電炉法をバイパスし、汚染度の高い硫酸法より優れている。
キーワード
塩酸浸出、マグペイ法、合成ルチル、酸素加水分解、電気炉、塩素化、硫酸法
導入
チタンの主要鉱物はルチル、TiO2およびイルメナイト、FeTiO3です(図1および2)。 ルチルは塩素化法によって金属チタンや酸化チタン顔料に加工するのが容易であるが、イルメナイトは鉄分を多く含むため、加工が複雑である。 世界のチタンの埋蔵量は90%がチタン鉄鉱で、ルチルは10%に過ぎないので、チタン鉄鉱の処理は冶金学上重要な問題であることは明らかである。4 % TiO2)
イルメナイト鉱床はケベック州のように塊状であったり(図3)、磁鉄鉱、モナザイト、その他の有価鉱物を伴う黒砂(図4)であり、物理的方法で分離されている(図5)。 第1磁気分離では磁鉄鉱を、第2磁気分離ではイルメナイトを、弱い磁石で分離する。

図3 ケベック州の巨大イルメナイト

図4 インドのような黒いビーチサンド
初期の顔料製造法
硫酸法
1916年にニューヨーク、ナイアガラフォールズのチタンピグメント社とノルウェーのチタン社は同時にこの新しい白顔料の商業生産開始を開始しました。 当時、塗料に使われる白色顔料は、白鉛、亜鉛華、リトポンが主流であったが、このチタン顔料は、白鉛、亜鉛華、リトポンの3種類からなる。 この方法は、イルメナイトを110~120℃の濃硫酸で処理し、硫酸第一鉄と硫酸チタニルを生成させるものである
FeTiO3 + 4H+ → Fe2+ + TiO2+ + 2H2O
この反応は耐酸レンガを敷いた大型コンクリートタンク(図6)で、高圧蒸気の直接注入またはパグミル(図7)で加熱して行われる。 反応終了時に反応器内で生成する固化塊は、水または希酸に溶解して反応器から排出される。 不溶性の残留物をろ過によって除去した後、120〜130g/LのTiO2と250〜300g/LのFeSO4を含む溶液を10℃で真空下に濃縮してFeSO4・7H2Oを結晶化させ、これを遠心分離によって除去することができた。 その後、希釈と播種により酸化チタンを溶液から沈殿させ、希薄なH2SO4を生成し、廃棄する(図8、図9)。 しかし、ブラジルのサルバドールにある最大の顔料メーカーは、廃棄物を海に捨て、潮の満ち引きで除去するため、今でもこの技術を使っている。

図5:ブラックサンドの選鉱による有価物回収

図6:耐酸レンガを敷いた大型コンクリートタンク

図7:ブラックサンドの選鉱による有価物回収

図8:ブラックサンドの選鉱による有価物回収 図10:黒砂を敷き詰めた大型タンク。 加熱パグミル

図8:硫酸法によるTiO2顔料の製造

図9:硫酸法によるTiO2顔料の製造。 チタンホワイト、〜100%TiO2
塩素化法
米国デュポン社は1950年からイルメナイト鉱石の直接塩素化、分留による製品分離、TiCl4の酸化(図10)により顔料を生産する。 イルメナイトからの顔料製造のための簡略化されたDu Pontプロセス
2FeTiO3 + 7Cl2 + 3C → 2TiCl4 + 2FeCl3 + 3CO2
TiCl4 + O2 → TiO2 + 2Cl2
このプロセスの問題は塩化第2鉄からの塩素回収またはこの多量の副産物のマーケティングにある。
鉄の分離
希硫酸やFeSO4の廃棄に伴う公害問題のため、鉱石中の鉄は早い段階で分離される。
電気炉法
電気炉法は1950年代に開発された方法である。 鉱石に酸化鉄を還元するのに十分な量の無煙炭を混ぜ、1 650℃の電気炉に投入し、酸化鉄を金属に還元し、チタンをスラグとして分離する(図11)。 還元時の反応は次の通りである。

図11 電気炉による鉄分離プロセス
FeTiO3 + C → Fe + CO + TiO2(スラグ)
Fe2O3 + 3C → 2Fe + 3CO
この方法はリオティントのモントリオール近くのソレル工場と南アフリカのリチャーズベイのQITで使用されている。
チタンスラグとは主にチタン酸マグネシウム(Fe,Mg)Ti4O10と少量の珪酸塩で、典型的な分析値は72-85%のTiO2総量です。 少量のTiO2がTi2O3に還元される。 鉄酸化物の還元は完全には行われないため、スラグ中に酸化鉄が残り、融点が低下する。 TiO2融点1840℃、イルメナイト融点1435℃<774><2955>このスラグはチタンが多く鉄が少ないので(図12)、TiO2顔料や金属チタンの製造にはイルメナイトより好ましい。 しかし、ケベック州のスラグは不純物が多く、他のスラグが約6%であるのに対し、約16.6%と塩素化には適さない。 この不純物は、塩素を不必要に消費するだけでなく、廃棄の問題にもなります。 さらに、これらの不純物の中には、例えば、次のようなものがあります。 図12 チタンスラグ(FeTi4O10、70-80 % TiO2)
これらの理由から、チタンスラグは硫酸法による顔料の製造にのみ使用されていた。 このスラグはイルメナイトと同様に処理されるが、鉄の大部分はすでに前工程で還元により分離されているため、硫酸第一鉄の分離は必要ない(図13)。 しかし、スラグの硫酸処理は廃酸の処理問題があり、1980年代に中止され、スラグを高圧の塩酸で不純物の大部分を浸出し、塩素処理に適したTiO2 94.5%に高めた新しい技術に取って代わられた。

図13:酸化チタン顔料製造のためのチタンスラグ浸出、現在は廃止
湿式冶金法
湿式冶金法は1960年代に開発され、イルメナイトから鉄を溶出し「合成ルチル」と呼ばれるチタン(90-95% TiO2)含有量の多い残留物を得るものであった。 また、アルテア法では、顔料グレードのTiO2が得られることもある。 これらのプロセスはすべて、塩化第一鉄を処理してリサイクル用のHClと副産物としてのFe2O3を得るために酸素加水分解プロセスを使用している。
高圧法
この方法では、高品位のイルメナイトをオートクレーブで20%の塩酸を120℃、200kPaで分解し、鉄は塩化第一鉄として可溶化し、ルチルの化学分析を持つ約95%のTiO2を含む固体を残して合成ルチル(図14)と呼ばれるようになる。

図14:合成ルチル
FeTiO3 + 2H+ → TiO2 + Fe2+ + H2O
低級イルメナイトは、すべての珪酸と不溶物質が製品を汚染するのでこの方法で処理することができない。 合成ルチルを塩素で処理してTiCl4を調製し、そこから公害問題なしにTiO2またはチタン金属を得ることができる。 このプロセスは、米国、英国、日本、台湾、オーストラリアで使用されています。 酸素加水分解は以下に述べるように様々な方法で実施され得る。
大気圧プロセス
2014年にカナダのMagpie Incorporationによって、低級イルメナイトが大気圧で濃塩酸を用いて80℃で溶解できることが発見された。 不溶物を除去するために濾過した後、溶液を蒸留してHClを回収し、チタニルイオンを加水分解してTiO2とする。 ろ過後、残渣を焼成して合成ルチルを製造する(図16):

図15:イルメナイトからの合成ルチルの製造

図16:合成ルチルを製造する。 低品位イルメナイトからの98%以上TiO2の製造
FeTiO3 + 4HCl → TiO2+ + Fe2+ + 4Cl- + 2H2O
TiO2+ + 2Cl- + H2O → TiO2 + 2HCl
従来の電気炉精錬-オートクレーブの改良より常圧での新しい浸出技術の優位性は明らかである。
酸素加水分解
塩化鉄溶液を酸素加水分解によりHClとFe2O3に再生する:
2FeCl2 + 2H2O + 1/2O2 → Fe2O3 + HCl
これは漬物液処理と同じ技術で、塩化鉄をHClに再生し、Fe2O3もHClに再生する。 2つの方法がある
流動床式オキシ加水分解
流動床式反応器では、塩化第一鉄溶液は高温の酸化第二鉄の大きなベッドに導入され、高温の流動化燃焼ガスによって加熱される(図17)。 燃焼ガスはよく攪拌された酸化物のベッドを流れるので、すぐにベッドと熱平衡に達する。 溶液は酸化物層の上に供給される。 供給された液体は高温の酸化物粒子の外層を濡らし、すぐに蒸発して既存の酸化物の上に新しい固体酸化物のオニオン状の層を形成し、それによって高密度の均一な粒子が生成される。

図17 塩化第一鉄のオキシ加水分解用流動床反応器
スプレーロースター式オキシ加水分解
このタイプのオキシ加水分解ロースターでは、空の円筒容器に塩化第一鉄溶液をスプレーし、下部バーナーの高温ガスの上昇流により必要エネルギーを供給している(図18)。 スプレーロースターはガス流速を低く抑えるために直径が大きくなっている。 ガス速度が速い場合、オフガスとともに多くの粒子が溶出され、製品の品質やロースターの効率が低下する。 オフガスと酸化物は約400℃~500℃でロースターから向流に排出される。 高温反応部での噴霧粒子の滞留時間は非常に短いので、素早く加熱できる非常に小さな液滴をアトマイズで作る必要がある。 高速加熱により、各液滴の表面には酸化物の固体皮膜が形成される。 液滴の大部分が加熱されると、水分が気化し、酸化物の殻を突き破る。 したがって、スプレーロースト酸化物は、非常に微細な「ふわふわした」中空球体で構成されています。

図18:スプレーロースターでの酸素加水分解による塩化第一鉄溶液からのHClの再生
チタンの製造
金属チタンはルチル、合成ルチルまたはチタンスラグを塩素化して、マグネシウムによるTiCl4の金属発熱炉での還元によってチタンに生成する(図19と20) 。
TiO2 + C + 2Cl2 → TiCl4 + CO2
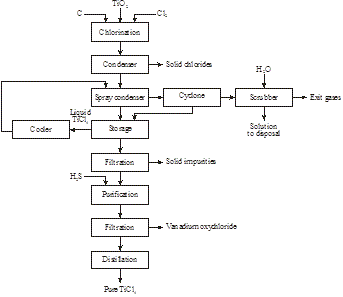
Figure19: ルチル、合成ルチル、またはチタンスラグからのTiCl4の生成

Figure20: ルチル、合成ルチル、またはチタンスラグからのチタンの生成。 TiCl4
TiCl4 + Mg → Ti + MgCl2
Magneium chlorideを電気分解してマグネシウムと塩素を回収し、再利用する方法です。 図21は還元後に炉から取り出された金属発熱炉で、ここからスポンジチタンが回収される(図22)。

図21:炉から取り出される金属熱反応器

図22:炉から取り出されたチタンスポンジ(上)とMgCl2(下)
- Barksdale J (1966) Titanium, Its Occurrence, Chemistry and Technology, Ronald Press, New York.No.7(1966)による。
- Sibum H (1997) “Titanium”, pp.1129-1179 in Handbook of Extractive Metallurgy edited by F. Habashi, published by WILEY-VCH, Weinheim, Germany.
- Habashi F (1993) A Textbook of Hydrometallurgy(2ndedtn).The Hamburge (1999) “Titanium”, p.1129-1179.
- DuPont (2007) Brochure™ Ti-Pure® titanium dioxide.
- Habashi F (2002) Textbook of Pyrometallurgy, Métallurgie Extractive Québec, Québec City, Canada.
- Toromanoff I, Habashi F (1985) Transformation of a Low-Grade Titanium Slag into Synthetic Rutile Intern.TRF (1985)チタンの低品位スラグの合成ルチルへの転化, Métallurgie Extractive Québec, カナダ. J. Mineral Processing 15: 65-81
- Habashi F (1996) Pollution Problems in the Mineral and Metallurgical Industries, Metallurgy Extractive Quebec, Quebec City.
- Habashi F (1993) Pressure Hydrometallurgy (2nd edtn.). Métallurgie Extractive Québec, Québec City, Canada.
- Habashi F, Kamaleddine F, Bourricaudy E (2015) A New Process to Upgrade Ilmenite to Synthet-ic Rutile Proceedings Conference of Metallurgists, Canadian Institute of Mining, Metallurgy, and Petroleum, Montreal.HABASHI F, Kamaleddine F, Bourricaudy E. (1149)錬金術師会議、カナダ鉱業冶金石油協会、モントリオール。 Metall 69: 27-30に転載
- Habashi F (1993) Two Hundred Years Titanium. 顔料と金属製造のためのチタン鉱石の加工. Arab Min J 11: 74-84
.