Immunofluorescence (IF) は、細胞内成分の分布を決定するために用いられる一般的な形態学的アプローチである。 蛍光色素と結合した抗体が必要である。 抗体は標的のエピトープに結合することで抗原を特異的に認識し、蛍光色素は蛍光顕微鏡下で検出される。 従って、細胞内成分は暗い背景の中で可視化することができます。 IFには、直接IF、間接IF、複合IFの3つのタイプがあります。
間接IFは、エピトープに特異的に結合する一次抗体と蛍光色素を結合したマッチした二次抗体の2つの抗体を用いて染色する。
Combined IFは、直接法と間接法を組み合わせた染色法。 直接IF、間接IF、複合IFの比較。
| IF type | Direct | Indirect | Combined | |
|---|---|---|---|---|
| Schematic diagram | 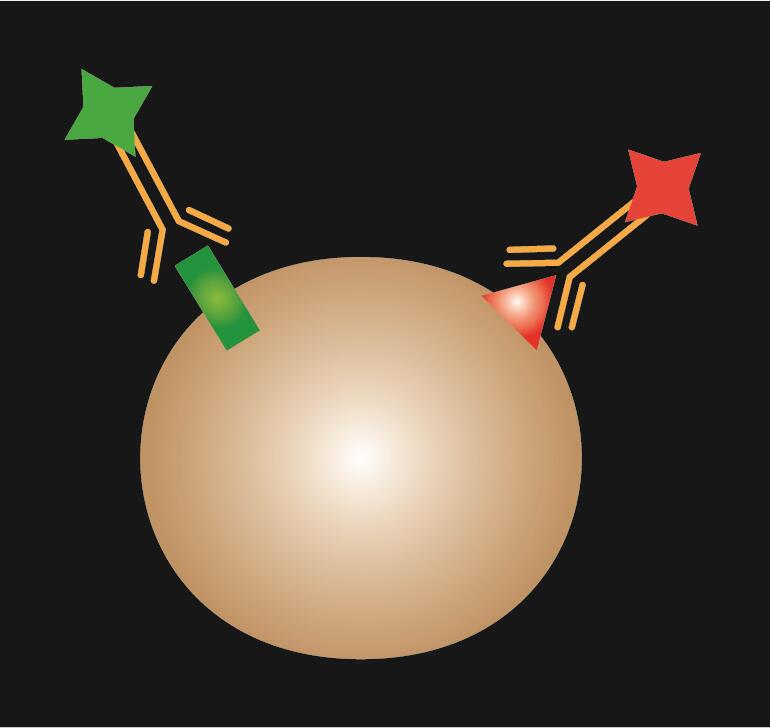 |
の略図。 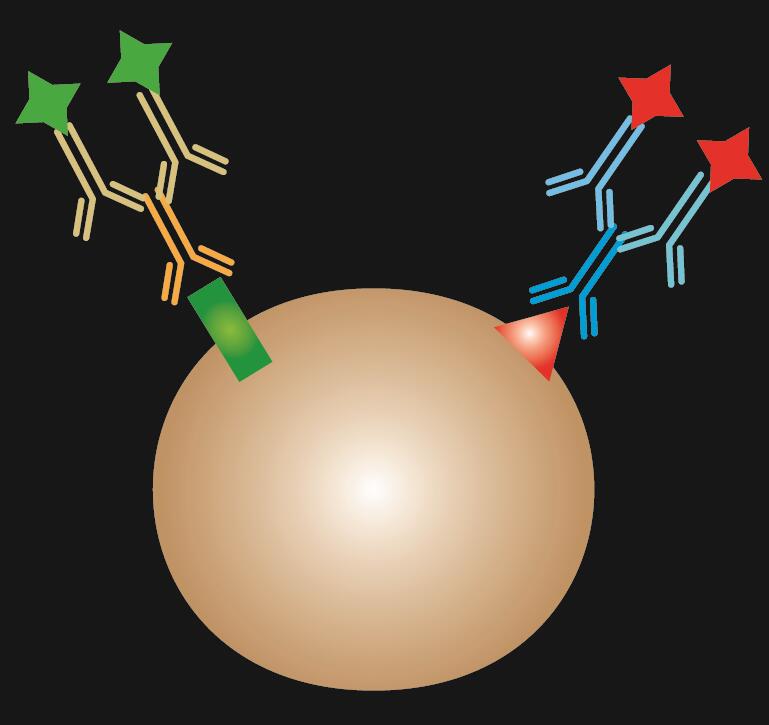 |
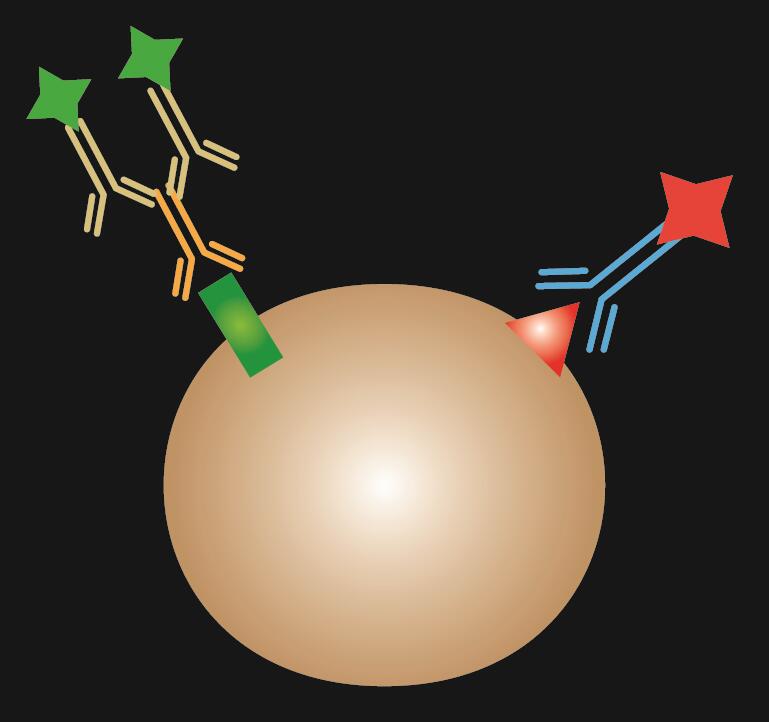 |
|
| 利点 |
|
|
|
|
| 欠点 |
|
|
3種類のIFがあるが、その中で 間接IF法が最もポピュラーです。
IF法は組織切片、培養細胞株、個々の細胞に対して使用することができます。 IFのプロセスは免疫組織化学(IHC)と似ています。
- Sample collection and fixation
サンプルを組織除去後に迅速に固定する必要があり、ネズミなどの小動物では4%ホルムアルデヒドまたはパラホルムアルデヒドで心臓注入による前固定を行う方がよいでしょう。 組織の厚さは10mm以下、固定液の量は組織の体積の15-20倍以上とすることが望ましい。 固定は、細胞の形態や構造、抗原の完全性を維持するために非常に重要です。 したがって、固定液は抗原や組織の種類に応じて慎重に選択する必要がある
Table 2. 部分抗原の固定化戦略。
| 抗原 | 固定液 | 固定条件 | ||
|---|---|---|---|---|
| Most protein | 95~100% Antigen | Fixation condition | Fixation solution | 3~10 min at 37℃ 4~24 hr at 4℃ |
| Enzyme | Acetone | 15 min at RT | ホルモン | 4℃で30分 |
| 免疫グロブリン | 37℃で10分後、4℃で15分 | |||
| 繊維タンパク質 | 95%アルコール+1~5%氷酢酸 | 10分後。 アセトン 四塩化炭素 アルコール |
RTで5~10分、その後30~60分。 4℃ | |
| 多糖類とバクテリア | アセトン 10%ホルムアルデヒド メタノール |
3~10分(RT)、30~60分(4℃ | ||
| リポイド | 10% ホルムアルデヒド | 3~10 min at RT | ||
| 培養細胞 | Warmed 4% パラフォルムアルデヒド | 15~20 min at RT at RT |
- Dehydration and embedding
組織切片の作成において脱水は以下の理由により必要である。
1. パラフィン切片。 パラフィンは水と混和しない。
2.凍結切片。
脱水は必ず、重勾配エタノール溶液またはスクロース溶液に組織を浸して行う。
その後、パラフィン切片には溶融パラフィンワックスを、凍結切片にはOCT化合物を加えて組織標本を埋め込むことができる。
- Section and staining
埋め込んだ組織は、ミクロトームや凍結ミクロトームで薄く切り取ることができる。 スライスの厚さは、細胞径やIFアッセイの目的に応じて決める必要があります。 薄切片(≦10μm)は、洗浄工程で剥がれやすいので、染色前に粘着スライドに直接マウントすることをお勧めします。 より厚いスライス(10~30μm)は、一次抗体がスライスの両面に浸透するため、フリーフローティング法を用いるとより良い画像が得られます。 また、フリーフローティング切片は、染色後にスライドにマウントします。 マウス背側神経節根(DRG)のような小さな組織のFree floating切片は、切片作製が難しく、サンプルを紛失しやすい。 そのため、一部の小さな組織では、スティックセクション法を推奨しています。 蛍光色素を結合させた抗体を使用する場合は、染色工程を暗所で行う必要があります。
IFプロトコル:
- Stick section
- Free floating section
- Cultured cells
- Imaging and analysis
蛍光顕微鏡で、暗い背景で陽性シグナルがバーチャル化される。 興味のある場所は、通常、場所がわかっているタンパク質の共染色によって決定される。 また、陽性細胞の量や陽性シグナリングの蛍光強度を測定し、定量的に解析することも可能である。 例えば、蛍光強度が強いほど、標的タンパク質の相対的な高発現を意味する。
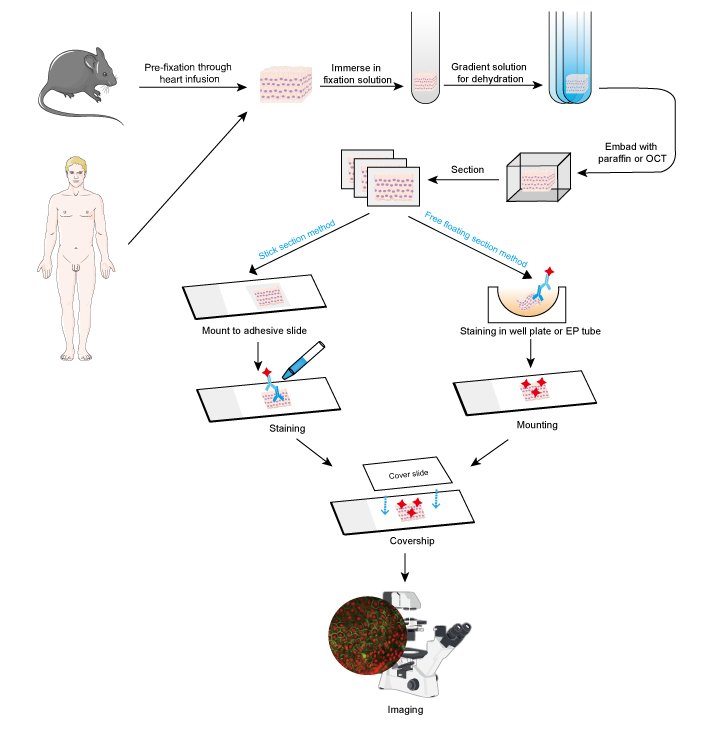
図1. 組織切片のIFのワークフロー
IF とIHCは、どちらも診断や予後に重要な応用が可能な形態学的解析の強力なアプローチです。 研究においては、いくつかの違いを考慮する必要がある。 IHCとIFの比較
| IHC | IF | |
|---|---|---|
| 標識方法 | 染色 | 蛍光 |
| 処理段階 | 基質として必要な量 | 少ない量 |
| 画像 |
|
|
| 顕微鏡 | 光顕微鏡 | 蛍光顕微鏡 |
| 安定 | Stable for Layer 年 | 光退色のため安定しない |
| 例 (マウス海馬) |
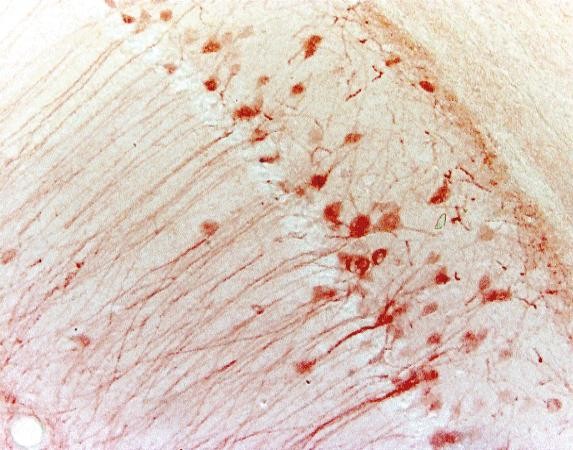 |
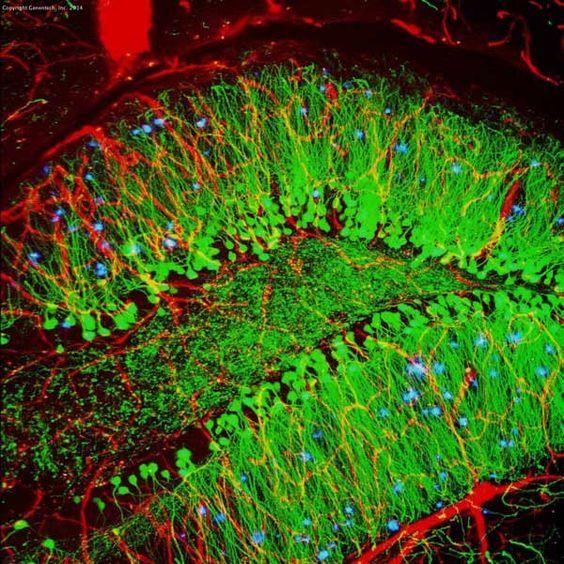 |
(敬称略