パーフォリン/グランザイム アポトーシス経路は、ウイルス感染細胞や形質転換細胞を排除するために細胞障害性リンパ球が用いる主要シグナル伝達経路である。 遺伝子破壊マウスを用いた研究では、パーフォリンがグランザイムと結合してアポトーシスを誘導することが示された。 3843>
パーフォリンとグランザイム
パーフォリンは孔を形成するタンパク質で、細胞質顆粒毒素としても知られています。 グランザイムは、細胞傷害性リンパ球(CL)の細胞傷害性顆粒内に貯蔵される、構造的に関連したセリンプロテアーゼのファミリーである。 パーフォリンとグランザイムは、協同で標的細胞のアポトーシスを誘導する(図1)。 標的細胞のアポトーシスを誘発するためには、グランザイムが必要であるが、それらはパーフォリンによって適切に運ばれることに依存している。 パーフォリンとグランザイムはともに、セルグリシンに関連した単一の高分子複合体の一部として標的細胞表面に結合し、グランザイムの受動拡散の確率をさらに低下させる。
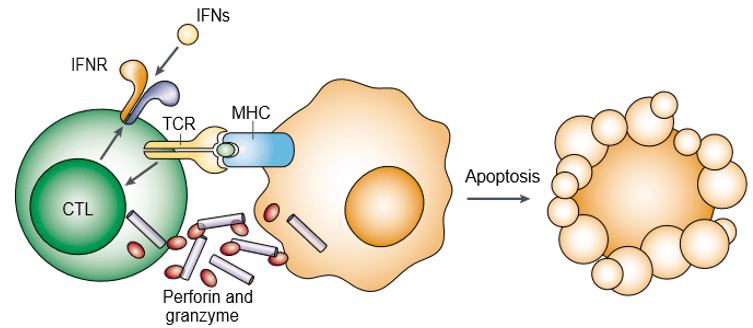
図 1. パーフォリンとグランザイムは協同で標的細胞のアポトーシスを誘導する
ヒトにはグランザイムA、B、H、K、Mがあり、マウスにはグランザイムA、B、C、D、E、F、G、K、L、M、Nがある。
パーフォリン/グランザイムによるアポトーシス経路のプロセスと制御
細胞障害性リンパ球から分泌されたグランザイムは標的細胞に入り、細胞死の重要なステップとなる。 顆粒内にパッケージされた主要な溶菌タンパク質は、異なる顆粒酵素と、顆粒酵素の細胞による内在化を促進する孔形成タンパク質パーフォリンである。
顆粒酵素Bは主に、直接カスパーゼ処理によってではなく、間接的にカスパーゼ活性化の引き金を引く。 これは、BH3-interacting domain death agonist (Bid)のようなBCL-2ファミリーの「BH3-only」アポトーシス促進メンバーを直接活性化することによって達成される。 Bidは、BCL-2ファミリーのBaxおよび/またはBakタンパク質とともに、シトクロムcのようなプロアポトーシスミトコンドリアメディエーターを細胞質へ漏出させる。 シトクロムcの放出はプロカスパーゼ9を活性化し、アポトーシスプロテアーゼ活性化因子1(Apaf-1)と結合することにより、プロカスパーゼ9は成熟カスパーゼ9となり、引き続きアポプトソームを形成し下流のカスパーゼ3が活性化される。 活性化されたカスパーゼ-3はICAD (inhibitor of the caspase-activated DNase, CAD) などの特定の基質を切断することができ、CADは核に移行してDNAを断片化することができる。 Bid以外にも、グランザイムBは、抗アポトーシスBcl-2ファミリーのメンバーであるMcl-1を不活性化して、ミトコンドリア外膜上に抗アポトーシスBcl-2ファミリータンパク質Bimを遊離させることができる。
グランザイムBと異なり、グランザイムMはミトコンドリアには依存せず、グランザイムBの阻害因子であるプロテイナーゼインヒビター9(PI-9)を切断して、グランザイムBを活性化することが可能である。 また、グランザイムMはグランザイムBと同様にICADを直接切断してCADを解き放つことができる。
グランザイムAはミトコンドリア内膜電位の喪失と活性酸素種(ROS)の放出を誘発する。 オリゴヌクレオソームDNA断片ではなく、一本鎖DNAのくびれを生成する。 活性酸素に応答して、SET、Ape1、pp32、HMG2、NM23-H1およびTREX1を含むER関連SET複合体が核に転移して、グランザイムAがDNA修復に関与するSET複合体の三つのメンバーを切断する。
疾患におけるパーフォリン/グランザイム・アポトーシス経路
遺伝子破壊マウスでの研究により、パーフォリン経路がウイルス病原体や形質転換細胞に対する防御に深く関わっていることが明確に示された。 しかし、パーフォリンは自然発生した形質転換細胞の免疫監視やB細胞の恒常性、T細胞記憶の制御に重要なメディエーターとして、意外にも生体内でその役割を担っていることも明らかにされている。 また、パーフォリンは、非肥満性糖尿病(NOD)マウスのインスリン依存性糖尿病など、ある種の自己免疫疾患モデルの発症に役立っている一方で、実験的自己免疫脳脊髄炎(EAE)など、他の自己免疫疾患を抑制している可能性があることも、逆説的な意味で明らかにされている。
顆粒の極性化とエキソサイトーシスを制御するパーフォリン/顆粒酵素アポトーシス経路が明らかにされつつあり、これらの経路は癌細胞と一部の細胞障害性リンパ球との相互作用によって破壊される可能性がある。 最近、グランザイムが標的細胞に入るには、特定の膜レセプターに結合することが必要であること、一部の腫瘍はグランザイムを中和するセリンプロテアーゼ阻害剤を合成していることが明らかになり、腫瘍が免疫攻撃から逃れるための新しい方法の可能性が示唆されている
。