分子の物性、混成、形状を理解するために、分子のルイス構造を知ることは重要です。 今日はI3-、または負の電荷を持つことからトリオダイドイオンとも呼ばれるI3- のルイス構造について見ていきます。 この分子には3つのヨウ素分子が含まれており、そのため化合物の名前はトリオダイドと呼ばれています。
ルイス構造
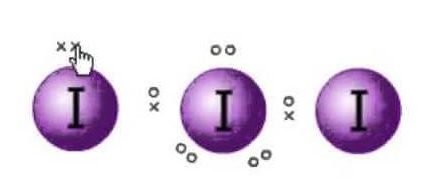
ルイス構造とは、分子の電子を表現したものです。 分子の混成と形状を決定するのに役立つローンペアと価電子があります。 ヨウ素の分子があるので、ヨウ素の分子が1つ中心になります。

ここにはヨウ素が3分子あり、さらに1個の電子があり、負の電荷を帯びていることがわかります。 だから、価電子の合計数は: 7×3 + 1= 22.
この分子には全部で22個の価電子があります。 さて、すべての原子が従う八分則というものがある。 この規則では、すべての原子は外側の軌道に8個の電子を持っていなければなりません。 もし中心原子の外殻に8個の電子があれば、他の2つの原子でオクテットを完成させる必要があります。 すべての原子が8重項を完成させるために外殻に8個の電子を必要とするので、中心のヨウ素原子の1個の電子は、隣接する両方のヨウ素原子に奪われることになります。 つまり、8-1-1=6となり、
両方の原子に電子が奪われます。
ですから、ヨウ素の中心原子の価電子は6個となります。 この6個の電子は、結合しない単独電子対を形成することになります。
ハイブリッド化
分子のハイブリッド化を知るために、簡単な公式がある。 この式は、分子の混成を知るのに役立つ混成数を求めるのに使われます。
混成数およびそれが決定する混成度は次のように表される。
- 2: sp混成
- 3: sp2混成
- 4: sp3混成
- 5: 混成
数を見つける公式は
Hybridization Number.というものである。 価電子数+1価+(負電荷)-(正電荷)/2
ヨウ素原子の価電子数は最外殻に7個あるので7個です。 ヨウ素は3個中2個が1価なので、1価の原子の数は2個です。
ここで、すべての値を
7+1+2/2
=10/2
=5
の式に従って配置すると、混成数は5となり、混成度はsp3dであることを意味します。
ある分子の混成を見つけるもう一つの方法は、孤立ペアと価電子の助けを借りることです。
I3-イオンの形

分子I3-は直線的な形をしています。 3つのヨウ素原子があり、そのうち1つは余分な負の電荷を持っています。 この1個の余分な電子のために、3個の単独電子と2個の結合対があり、立体数は5である。 中央のヨウ化物原子には3つの孤立電子対があるため、これらの対はできるだけ互いに反発し合おうとしています。 そこで、より遠くへ離れるために、このペアは赤道上の位置をとり、他の2つのヨウ素原子は互いに180度離れた位置にあるのです。
極性
ここで、このイオンの厄介な点があります。まず、電荷があるため、分子と呼ぶ代わりに多原子イオンと呼ぶことができます。 イオンは分子上にある電荷です。 I3-は電子を1個持っているので、このイオンは全体として負の電荷を持っています。 分子は、部分的に正に帯電した端と部分的に負に帯電した端の両方の電荷を持っているので、極性を持っています。 分子上の電荷の分離に応じて、分子上に双極子モーメントが存在する。
しかし、I3-イオンについて話すとき、それは負に帯電したイオンである。 ルイス構造を描いても、イオン全体の電荷が負であるため、双極子モーメントや極性結合は見られません。 つまり、極性でも非極性でもないのです。
最後に、この記事全体をまとめると、I3-は22価の電子、3つの孤立ペア、2つの結合ペア、sp3d混成を持つ多原子イオンです。 形状は直線的で、極性はない
。