はじめに
Spinocerebellar ataxia Type 3(SCA3)は染色体14q32.1のコード領域におけるCAG伸長を原因として起こる先天的な神経変性障害です(1、2)。 臨床的には、小脳症候群、パーキンソニズム、失調性歩行、構音障害、歩行困難、眼振、末梢神経障害、錐体外路症状、錐体外路症状などを示します(3-5)。 また、SCA3患者は、うつ病や不安症などの情緒障害にも悩まされていました(6、7)。 SCA3のこれらの高次機能障害は、従来の「オリーブ小脳」の神経変性パターンではなく、さらに小脳外構造の関与を示唆しています(8-12)。 さらに、SCA3障害は小脳性認知感情症候群(CCAS)と呼ばれている(6、8)。
研究では、PETや単一光子放射型コンピュータ断層撮影を用いて、大脳皮質における不顕性異常を同定している(13、14)。 しかし、これらの研究では、小脳経路の破綻はSCA3患者の認知・情動障害を完全に説明することはできないと報告されている。 例えば、SCA3患者の視空間障害は、頭頂葉との関連が顕著であり、小脳との関連は少ないことが報告されている。 SCA3におけるテント上領域の役割に焦点を当てた研究はほとんどない。 SCA3患者の機能障害を評価する上で、テント上領域の変性の定量化は極めて重要であろう。 神経画像研究において、皮質領域の萎縮を測定することは、認知障害や情動機能障害との関連を評価するために極めて重要である。
拡散テンソル画像(DTI)は白質(WM)の可視化と特性評価を容易にし、DTIはSCA3の研究にも有効である (15). SCA3は、WM優性萎縮性神経変性疾患であることが確認されています(16)。 これまでの研究で、SCA3患者は小脳と脳幹の領域で分数異方性(FA)が減少し、小脳、脳幹、視床、前頭葉と側頭葉で放射状拡散率(RD)が増加することが示されています(17)。 別のDTI研究では、SCA3患者では、両側の大脳前頭葉、頭頂葉、側頭葉、後頭葉のWM、小脳WM、視床、脳幹で広範囲にFAが減少していることが確認された(16)。 さらに,両側の大脳前頭部,頭頂部,側頭,後頭部WM,小脳WM,視床,脳幹で平均拡散率(MD)の増加が同様に広く重なって検出された(16)。 本研究では,ばらつきの少ない結果が得られるという利点のあるフラクタル次元(FD)法を用いて,皮質の形態変化を定量化し,脳幹上部の局所的な皮質萎縮を測定した(18)。 本研究では、各参加者の全脳から灰白質の97セグメントについて3D-FD値を測定した。 さらに、これらの灰白質病変の結果を、我々が最近行ったSCA3における白質病変のDTI解析と比較した。 本研究で評価された灰白質病変領域は、DTI研究で得られた白質病変領域と関連しており、この結果はSCA3患者の運動関連障害とテント上領域の萎縮との関連性を検証する可能性があると予想された。 本研究はヘルシンキ宣言に基づき実施され、台北栄民総医院の機関審査委員会の承認を得た。 すべての参加者は、この研究に参加する前に、書面によるインフォームドコンセントを提供した。 すべての参加者は、台北栄民総医院の放射線科から募集された。 SCA3 患者の運動失調の臨床評価には SARA (scale for the assessment and rating of ataxia) を適用した (19)。 SCA3におけるパーキンソン病進行の症状は、Modified Hoehn and Yahr staging (20)を用いて測定された。 運動失調症状の重症度を0~40で評価したSARAスコアを参考に、小脳変性症と比較して臨床的な重症度の進行度を示した。 自己申告による発症年齢(患者が何らかの運動失調症状の最初の兆候を示した年齢)は、各患者から取得した(21)。 各SCA3患者のCAG繰り返し長さは、先に述べたようにポリメラーゼ連鎖反応によって決定された(22)。 表1は、両群の人口統計学的データ、臨床データ、MR画像データを示している。 SCA3患者は、進行性で他の原因不明の運動失調を有し、SCA3遺伝子型が陽性であれば、組み入れ基準に合致した。 SCA3患者の罹病期間は8.89年±6.432年であった。 対照群には中枢神経系疾患がなく、試験期間中にいかなる神経学的異常も認められなかった。 経験豊富な神経放射線技師が、対照群のT1およびT2強調画像を検査し、他の神経学的疾患の兆候や予期せぬ異常がないことを確認した。 対照群と患者群の人口統計学的、臨床的、およびMR画像データ。
Magnetic Resonance Imaging
Data Acquisition and Processing
大脳と小脳全体をカバーする軸MRヒト脳画像は1.5T Vision Siemensスキャナ(ドイツ、エルランゲン)で取得された。 参加者は円偏光ヘッドコイルでスキャンしてT1強調画像を得た(TR = 14.4 ms; TE = 5.5 ms; マトリクスサイズ: 256 × 256; 1.5 mm axial slices; FOV = 256 × 256 mm2; voxel size, 1.0 × 1.0 × 1.5 mm3, number of slice = 128)。 各被験者の取得したT1強調画像をアキシャル画像に再フォーマットし,MRIcroソフトウェア(Chris Rorden, University of Nottingham, UK; www.sph.sc.edu/comd/rorden/mricro.html )により解析形式に変換した. 図1は、データ処理と統計解析のフローチャートである。 脳組織の抽出精度を向上させるため,MRIcro ソフトウェアの脳抽出ツールを用いて,画像ボリュームに自動スカル ストリッピング機能を適用した(図 1B). その後の処理は,DiffeoMap(Li, X.; Jiang, H.; and Mori, S.; Johns Hopkins University, www.MriStudio.org) を用いて行った. この手順では、12パラメータのアフィン変換(23)を用いて、JHU_MNI_SS_T_ss T1テンプレートに向けて各T1強調画像を正規化した。
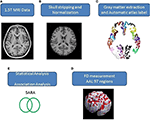
Figure 1. (A-E)画像処理の手順と統計解析<8730><8895><1821>アトラス抽出<6979><5859>画像データ処理は、SPM8ツールボックス(Wellcome Department of Cognitive Neurology, Institute of Neurology, University College London, London, UK, http://www.fil.ion.ucl.ac.uk/spm/)とIBASPMツールボックス(Individual Brain Atlases using Statistical Parametric Mapping, http://www.thomaskoenig.ch/Lester/ibaspm.htm)を用いて実行し、いずれもMATLAB 2010ソフトウェア(Mathworks, Natick, MA, USA)で実行させた。
この手順では、正規化後に3つのステップを行う。 (1)正規化した画像をネイティブ空間で灰白質、白質、脳脊髄液にセグメンテーション、(2)モントリオール神経研究所(MNI)解剖学アトラス(24)の解剖学的ラベルに基づいて灰白質を116の領域にパーセレーション、(3) 灰白質画像のMNI空間への変換とIBASPMによる116の自動解剖学ラベル構造への灰白質の各ボクサーの解剖的アライメント(24)、左大脳: 左大脳:45領域、右大脳:45領域、小脳:26領域;(図1C)。 小脳の26領域を解剖学的構造に従って7つの領域に統合し、各人についてラベル付けされた97(各大脳半球45、小脳7、補表1)の脳構造の体積を抽出した(図1C)。
FD法はもともと、マンデルブロが物体の形状に関する複雑さを一つの数値に定量化するために提案した方法である(25)。 FD法は複雑さの位相的測定に用いられ、FD値が高いほど、研究対象の組織の位相的複雑さが大きいことを表す(18, 26)。 FD値は、脳梁の形態的な複雑さを正確に表現する定量的な指標として、多くの神経内科医が実証している(18, 26, 27)。 FD解析は対数スケールに基づいているため、FD値が少し増加するだけで、複雑さがかなり増加することに対応することができる(18)。 本研究では、3D box-counting法を採用し、各参加者の脳全体から得た97セグメントの灰白質について3D-FD値を測定した(図1D)。 関連する研究がボックスカウント法のアルゴリズムを詳述している(18)。
統計解析
グループ間の性差と年齢差は、ピアソンのカイ二乗検定(χ2 = 0.384, p = 0.535)および両側2標本のt検定(p = 0.516)を別々に使用して測定した。 年齢と性別の影響を除去するために線形回帰を適用した。 各皮質領域の3D-FD値に関して、対照群と患者群の間に有意差があるかどうかを判断するために、2-tailed t-testを採用した。 結果の有意性は、偽発見率(FDR-corrected p = 0.05)に基づき判断した(28)。 個々の脳領域の3D-FD値と、疾患期間やSARAなどの臨床的特徴との間の関連の大きさは、ピアソンのr測定によって決定された(図1E)。 これらの解析は、MATLAB 2010のStatistics Toolboxを用いて行った。
結果
SCA3患者は典型的な脳底部病変領域に有意な病変を認めた
経験豊富な神経放射線科医は、SCA3患者のMRI所見を報告した(Table1)。 図2は、各葉の3D-FD値を健常群とSCA3群で比較したものである。 SCA3患者の3D-FD値は、すべての葉で有意に低下しており、小脳が最も大きく低下していることがわかる(図2)。 SCA3患者の小脳皮質の3D-FD値は、SARAスコアと有意な相関を示した(r = -0.3346; p = 0.023)。 さらに大脳皮質と小脳皮質を97の領域に分割し、分割した領域ごとに萎縮を定量化した。 SCA3患者では、脳橋核、小脳皮質、下オリーブなど典型的な脳下垂体病変領域が認められた。 健常者群とSCA3群の萎縮領域の3D-FD値の有意な減少の詳細は、表2にまとめた。 健常者群とSCA3群の各葉の3D-FD値の比較。 SCA3群の各葉の3D-FD値は、対照群に比べ有意に低い値を示している。 小脳、前頭葉、頭頂葉、後頭葉の有意差のp値は0.01より小さく、その他の葉のp値は0.05より小さかった。 SCA3患者における有意な萎縮領域(p<1069>0.05)
Patients With SCA3 Revealed Cerebral Lateralized Supratentorial Lesions
脳底部病変のほかに、すべてのSCA3患者で脳底部上部領域の病変も観察された。 前頭葉,頭頂葉,後頭葉,側頭葉など39の大脳半球領域(p<1069>0.05)に広範な病変が認められた. その結果,前頭葉,頭頂葉,後頭葉,側頭葉の39の大脳半球が横方向に萎縮し,左半球が優位であった(右/左:12/27). 特に後頭葉と側頭葉では、SCA3患者では左半球のみで3D-FD値が有意に減少していた。 前頭葉で有意に萎縮していた領域は、運動前野(左上前頭回、左中前頭回)、補足運動野(左補足運動野)、一次運動野(左上前頭回)であった(図3)。 SCA3患者の前頭葉内の領域で、対照群と比較して3D-FD値が低いことを示す領域。 (A)左外側、(B)左内側、(C)右外側、(D)右内側。 SCA3患者では、運動前野(左上前頭回、左中前頭回)、補足運動野(左補足運動野)、一次運動野(左上前頭回)などの前頭部領域で3D-FD値が有意に減少していた。 その他、SCA3患者では、左下前頭回(opercular)、左下前頭回(triangular)、両側眼窩前頭皮質(上-1内側)、両側上前頭回(内側)、両側傍中心小葉で萎縮した領域が観察された。
他の萎縮領域は,左下前頭回(opercular),左下前頭回(triangular),両側眼窩前頭皮質(上-中),両側上前頭回(内側),両側傍中心小葉であった. 頭頂葉では、SCA3患者の左中心後回、左上角回、両上頭頂回、両楔前部でFD値の低下が検出された(図4)
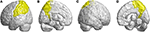
Figure 4. SCA3患者の頭頂葉内の領域で、対照群と比較して3D-FD値の減少を示す領域。 (A)左外側から見た図,(B)左内側から見た図,(C)右外側から見た図,(D)右内側から見た図。 SCA3患者では、対照群と比較して、頭頂葉の左中心後回、左上マージナル回、左角回、両側上頭頂回、両側楔前部で3D-FD値が有意に低下していることが示された。 後頭葉では,SCA3患者は左半球の踵裂とその周囲の皮質,楔状回,舌状回,上・中後頭回でFD値の有意な低下を認めた(図5A,青色). 側頭葉では、SCA3患者の左上側頭回と左中側頭回でFD値が低下している領域があった(図5A、紫色)。 大脳辺縁系領域の左後帯状回の3D-FD値も、SCA3患者では有意に減少していた(図5B,D、緑色)。 SCA3患者では、両側の尾状核と左被殻を含む基底核に著しい萎縮を示す領域が観察された(図5B,D、水色)。 右外後頭葉では、SCA3患者では有意な萎縮領域は観察されなかった(図5C)。
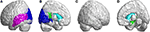
Figure 5. SCA3患者の後頭葉、側頭葉、皮質下葉内の領域で、対照群と比較して3D-FD値が有意に低いことを示す領域。 (A)左外側、(B)左内側、(C)右外側、(D)右内側。 青色領域は、左半球の踵裂とその周辺の皮質、楔状回、舌状回、上・中後頭回を含む後頭葉で3D-FD値が有意に低いことを示している。 紫色の領域は、左上側頭回と左中側頭回で3D-FD値が低いことを示している。 水色の領域は、両側の尾状核と左の被殻を含む皮質下領域で3D-FD値が低いことを示す。 緑色の領域は、大脳辺縁系の左上帯状回と海馬傍回で3D-FD値が有意に低いことを示す。
図6では、小脳、小脳-視床皮質、基底核-視床皮質のリンク回路など多くの脳萎縮領域があり、SCA3患者がこれらの経路で小脳-視床皮質、基底核-視床皮質の損傷を受けたことが示唆された

FIGURE6. SCA3は小脳-視床皮質経路と基底核-視床皮質経路の両方に関与している。 (A)左外側から見た図、(B)左内側から見た図、(C)右外側から見た図、(D)右内側から見た図。 小脳-視床皮質ループにおいて、SCA3患者は小脳、運動前野、補足運動野で有意に低い3D-FD値を示した。 SCA3患者の小脳皮質および他の運動関連大脳領域の3D-FD値の低下は、臨床症状の存在を説明するものである。 大脳基底核-視床皮質ループでは、前頭葉皮質、一次運動野、被殻、尾状核において有意に低い3D-FD値を示し、SCA3患者では、小脳皮質の3D-FD値が低下している。
考察
臨床的にSCA3患者は小脳症候群とパーキンソニズムを示す(3-5). 表2に示した小脳下層および上層皮質の萎縮領域は、小脳関連(CB関連)皮質(29)と基底核関連(BG関連)皮質(30)という2つの機能領域と同様に広い範囲で重複した領域を示している。 CB関連皮質には小脳、前頭前野、感覚運動野、前頭前野、側頭葉が含まれ、BG関連皮質には一次運動野、補足運動野、運動前野、大脳基底核が含まれています。 この結果は、小脳がSCA3患者で最も影響を受け萎縮する部位であるという従来の神経画像研究(4、31、32)と一致することが明らかになりました。 さらに、SCA3患者の小脳皮質の3D-FD値は、Rezendeらの報告(33)と同様にSARAスコアと有意な負の相関(r = -0.3346; p = 0.023)を示した。
脳底部では、SCA3患者は被殻と尾状部で3D-FD値が有意に低下していた。 神経病理学的研究では、被殻と尾状核の神経細胞減少が認められ、パーキンソニズムに伴う大脳基底核の萎縮が考えられる(34)。 SCA3変異の表現型はパーキンソン病が主流であり、通常、大脳基底核の症状を伴う(35-37)。 剖検では、SCA3患者では大脳基底核の病変がよくみられます。 PETを用いた機能イメージングでも、SCA3患者では尾状核と被蓋核の早期機能低下が証明されている。 さらに、SCA3患者では、大脳基底核の容積が有意に小さかった(35)。 しかし、関連する研究は、大脳基底核と脳下垂体領域のみに焦点を当てたものである。 図6では、SCA3では大脳基底核だけでなく、小脳-視床皮質および大脳基底核-視床皮質経路の障害もある可能性を検証した。 運動前野と補足運動野は,筋力やリーチの方向などの運動制御に関連する。 これらの領域の損傷は,運動分解に加えて,歩行,立脚,四肢の運動失調を誘発する可能性がある(38, 39). SCA3患者の小脳皮質や他の運動関連大脳領域の3D-FD値が低下していることは、臨床症状の存在を説明できるかもしれない。 さらに、大脳基底核-視床皮質ループにおいて、SCA3患者は前頭葉と一次運動野で3D-FD値の有意な減少を示す。 一次運動野はまた、大脳基底核の出力の主要な行き先である(40)。 大脳基底核-視床皮質ループの障害は、パーキンソン病の運動機能障害にも寄与している可能性がある(41)。 本研究の結果は、これまでの神経画像研究が対応してこなかったSCA3患者の大脳基底核-視床皮質ループの形態的変化を強調している。
最近、我々は拡散テンソル画像(DTI)を用いてSCA3における白質(WM)変化の水分子拡散を測定した(15)。 その結果,SCA3では両側の大脳前頭部,頭頂部,側頭部,後頭部の白質,小脳の白質,視床,脳幹に広範囲な白質病変が認められた. 本研究では、これらのWM病変のうち、GM病変とほぼ同じパーセル領域にSCA3が存在することが確認された。 これらの所見は、SCA3患者におけるテント上部の病変を確認するものである。 Bragaらは、SCA3が実行機能、言語流暢性、抽象的推論、ワーキングメモリの障害を通じてCCASを引き起こすことを示し、同様の知見を報告した(8)。 神経病理学的研究において、CCASは、前頭前野、上頭頂葉、上側頭葉、大脳辺縁系皮質に関連する小脳回路の障害に起因することが明らかにされた(42, 43)。 研究により、認知機能における小脳の役割が確認されている。しかし、認知、感情、視空間機能は皮質変性と直接的に関連している。 SCA3患者では、CCAS関連領域よりもテント上部の萎縮領域が有意に広範であった。 大脳皮質上部の萎縮は、運動失調やパーキンソン病関連領域の機能障害に関連する主要因である可能性がある。 これらの知見は,SCA3がもはや小脳とその接続部に限定された疾患と考えるのではなく,むしろ脳全体に影響を及ぼす病理と考えるべきことを示唆している。
しかしながら,本研究にはまだ一定の限界があった。 本研究の主な限界は,SCAにおけるCCASを評価するための特定の認知評価と臨床パラメータが欠如していることである。 本研究の結果と機能的MRIデータなどの臨床データとの相関については、さらなる検討が必要である。
結論
本研究では、3D-FD法を用いてSCA3患者の局所形態変化を定量化し、SCA3患者のテント上部の萎縮と運動関連の病変との関連を評価した。 その結果,小脳関連あるいは基底核関連と思われる特定の領域で大脳皮質の有意な変性が認められた. また、SCA3患者によくみられる運動失調、パーキンソニズム、構音障害、構音障害などの症状とも関連する可能性がある。
Data Availability Statement
本研究で作成したすべてのデータセットは論文/補足資料に含まれている。
Ethics Statement
人を対象とした研究は、台北栄民総医院の施設審査委員会によって審査・承認されている。 また、この研究への参加は、患者・参加者から書面による同意を得ている。
著者貢献
P-SWとY-TWは研究プロジェクトを企画し、原稿のレビューと批評を行った。 T-YWは原稿を執筆した。 H-MWは研究データにアクセスした。 B-WSは研究を企画し、データ収集を行った。 また、B-WSは研究を組織し、データ収集を行った。C-WJは統計解析を行い、原稿を書き、修正した。
研究助成
この研究は、台湾科学技術部(MOST108-2634-F-010-002)、台湾国立衛生研究所(NHRI-EX106-10526EI)、国立陽明大学および新光五湖記念病院研究計画(107GB006)から資金援助を受けている。
利益相反
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で行われたことを宣言している。
謝辞
著者らは、この研究に参加したすべての人に感謝し、この原稿を編集してくれたWallace Academic Editingに感謝したい。
補足資料
この論文の補足資料は、オンラインで見ることができる。 https://www.frontiersin.org/articles/10.3389/fneur.2020.00124/full#supplementary-material
1.川口泰司、岡本哲也、谷脇正樹、相澤正樹、井上正樹、片山晋一、他:染色体 14q32.1 における Machado-Joseph 病の新規遺伝子における CAG 拡張. Nat Genet. (1994) 8:221-8. doi: 10.1038/ng1194-221
PubMed Abstract | CrossRef Full Text | Google Scholar
2.邦訳:「マチャド・ヨーゼフ病の新規遺伝子における14q32.1に存在するCAGの拡大」。 Riess O, Rub U, Pastore A, Bauer P, Schols L. SCA3: neurological features, pathogenesis and animal models. 小脳。 (2008) 7:125-37. doi: 10.1007/s12311-008-0013-4
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Stevanin G, Durr A, Brice A. Clinical and molecular advances in autosomal dominant cerebellar ataxias: from genotype to phenotype and physiopathology. Eur J Hum Genet. (2000) 8:4-18. doi: 10.1038/sj.ejhg.5200403
PubMed Abstract | CrossRef Full Text | Google Scholar
4.小脳失調症の臨床と分子生物学的進歩。 このような状況下において,小脳失調症は臨床的に重要な疾患である. Lancet Neurol. (2004) 3:291-304. doi: 10.1016/S1474-4422(04)00737-9
PubMed Abstract | CrossRef Full Text
5.小脳失調症:臨床的特徴、遺伝、病態。 Roeske S, Filla I, Heim S, Amunts K, Helmstaedter C, Wüllner U, et al. 脊髄小脳失調症3型における進行性の認知機能障害。 Movement Disord. (2013) 28:1435-8. doi: 10.1002/mds.25512
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Braga-Neto P, Pedroso JL, Alessi H, Dutra LA, Felicio AC, Minett T, et al. machado joseph diseaseにおける小脳認知感情症候群:中核となる臨床的特徴。 Cerebellum. (2012) 11:549-56. doi: 10.1007/s12311-011-0318-6
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Zawacki TM, Grace J, Friedman JH, Sudarsky L. Executive and emotional dysfunction in Machado-Joseph disease(抹消者病における実行および感情機能障害). Movement Disord. (2002) 17:1004-10. doi: 10.1002/mds.10033
PubMed Abstract | CrossRef Full Text | Google Scholar
8.マチャド・ジョセフ病における遂行機能および情動機能障害。 Braga-Neto P, Dutra LA, Pedroso JL, Barsottini OGP. 脊髄小脳失調症3型における認知機能障害:多様なトポグラフィとパターン。 Movement Disord. (2014) 29:156-7. doi: 10.1002/mds.25756
PubMed Abstract | CrossRef Full Text | Google Scholar
9.認知機能障害は、脊髄小脳失調症3型の認知機能障害である。 Lopes TM, D′Abreu A, Junior MCF, Yasuda CL, Betting LE, Samara AB, et al. Spinocerebellar ataxia type 3における広範な神経細胞障害と認知機能障害. J Neurol. (2013) 260:2370-9. doi: 10.1007/s00415-013-6998-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10.脊髄小脳失調症3型における広範な神経損傷と認知機能障害。 Roeske S, Filla I, Heim S, Amunts K, Helmstaedter C, Wüllner C, et al. Reply to: cognitive dysfunction in spinocerebellar ataxia type 3: variable topographies and patterns. Movement Disord. (2014) 29:157-8. doi: 10.1002/mds.25755
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Barbas H. Anatomic basis of cognitive-emotional interactions in the primate prefrontal cortex.(霊長類の前頭前野における認知・情動相互作用の解剖学的基盤)。 また、”beautiful “は、”beautiful “と “beautiful “の合成語で、”beautiful “は、”beautiful “と “beautiful “の合成語で、”beautiful “は、”beautiful “と “beautiful “の合成語で、”veautiful “は、”veautiful “と “veautiful “の合成語で表します。 D’Abreu A, Franca MC Jr, Yasuda CL, Campos BA, Lopes-Cendes I, Cendes F, et al. Machado-Joseph diseaseにおける新皮質萎縮:神経画像縦断研究。 J Neuroimaging. (2012) 22:285-91. doi: 10.1111/j.1552-6569.2011.00614.x
PubMed Abstract | CrossRef Full Text | Google Scholar
13.大脳皮質萎縮症。 Soong BW, Liu RS. 無症状のMachado-Joseph病遺伝子保因者におけるPositron Emission Tomography。 J Neurol Neurosur PS. (1998) 64:499-504. doi: 10.1136/jnnp.64.4.499
PubMed Abstract | CrossRef Full Text | Google Scholar
14.曽我蕭白(Soong)BW(B)、劉(L)、劉(R)。 脊髄小脳失調症1型、2型、3型、6型におけるドーパミントランスポーターポジトロン・エミッション・トモグラフィー(DOPT)。 Arc Neurol. (2005) 62:1280-5. doi: 10.1001/archneur.62.8.1280
PubMed Abstract | CrossRef Full Text | Google Scholar
15.小児脊髄性運動失調症におけるドーパミントランスポーターポジトロン断層法(DOP)。 Jao CW, Soong BW, Huang CW, Duan CA, Wu CC, Wu YT, et al. Diffusion tensor magnetic resonance imaging for differentiating multiple system atrophy cerebellar type and spinocerebellar ataxia type 3.(拡散テンソル磁気共鳴画像による多系統萎縮症小脳型と脊髄小脳失調症3型の鑑別)。 Brain Sci. (2019) 9:354. doi: 10.3390/brainsci9120354
PubMed Abstract | CrossRef Full Text | Google Scholar
16.小脳萎縮症の鑑別のための拡散テンソル磁気共鳴画像. このように、SCA3では白質損傷と運動失調の重症度が関連している。 J Neurol. (2014) 261:291-9. doi: 10.1007/s00415-013-7186-6
PubMed Abstract | CrossRef Full Text | Google Scholar
17.白質損傷とSCA3の運動失調の重症度との関連性。 Guimarães RP, D’Abreu A, Yasuda CL, Franca MC Jr, Silva BH, Cappabianco FA, et al. 脊髄小脳失調症3型における微細構造白質障害のマルチモーダル評価。 Mov Disord. (2013) 28:1125-32. doi: 10.1002/mds.25451
PubMed Abstract | CrossRef Full Text | Google Scholar
18.小児脊髄性運動失調症における白質障害のマルチモーダル評価。 Wu YT, Shyu KK, Jao CW, Wang ZY, Soong BW, Wu HM, et al. Fractal dimension analysis for quantifying cerebellar morphological change of multiple system atrophy of the cerebellar type (MSA-C).小脳形態変化のフラクタル次元解析。 NeuroImage. (2010) 49:539-51. doi: 10.1016/j.neuroimage.2009.07.042
PubMed Abstract | CrossRef Full Text | Google Scholar
19.小脳の形態変化の定量的解析(フラクタル次元解析)。 Schmitz-Hübsch T, du Montcel ST, Baliko L, Berciano J, Boesch S, Depondt C, and al. Scale for the assessment and rating of ataxia.運動失調の評価と格付けに関するスケール。 新しい臨床尺度の開発。 Neurology. (2006) 66:1717-20. doi: 10.1212/01.wnl.0000219042.60538.92
PubMed Abstract | CrossRef Full Text | Google Scholar
20.神経学(Neurology)。 Hoehn MM, Yahr MD. パーキンソニズム:発症、進行、死亡率。 Neurology. (1998) 50:318. doi: 10.1212/WNL.50.2.318
PubMed Abstract | CrossRef Full Text | Google Scholar
21.パーキンソン病の発症と進行、死亡率。 Jardim LB, Pereira ML, Silveira I, Ferro A, Sequeiros J, Giugliani R. Machado-Joseph病における神経学的所見:疾患期間、サブタイプ、(CAG)nとの関連性. Arch Neurol. (2001) 58:899-904. doi: 10.1001/archneur.58.6.899
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Soong B-W、Lu Y-C、Choo K-B、Lee H-Y. 台湾の常染色体優性小脳失調症の頻度解析と脊髄小脳失調症6型の臨床的・分子生物学的特徴。 Arch Neurol. (2001) 58:1105-9. doi: 10.1001/archneur.58.7.1105
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Woods RP, Grafton ST, Holmes CJ, Cherry SR, Mazziotta JC. 自動画像登録。 このような場合、「閾値」を設定することが重要である。 J Comput Assist Tomo. (1998) 22:139-52. doi: 10.1097/00004728-199801000-00027
PubMed Abstract | CrossRef Full Text | Google Scholar
24.自動画像登録(Automated image registration):I.一般的な方法と被験者内、モダリティ内の検証。 Tzourio-Mazoyer N, Landeau B, Papathanassiou D, Crivello F, Etard O, Delcroix N, et al. MNI MRI単一被験者脳の巨視的解剖学的区画を用いたSPMにおける活性化の自動解剖学的ラベリング(Automated Anatomical Labeling of activations in SPM using a macroscopic Anatomical Parcellation of the MNI MRI single-subject brain. NeuroImage. (2002) 15:273-89. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
25. マンデルブローBB. フラクタル(Fractals)。 フラクタル:フォーム、チャンス、ディメンション。 サンフランシスコ、カリフォルニア州。 Freeman (1977). p. 365.
Google Scholar
26. また、このような場合にも、「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」。 NeuroImage. (2007) 36:543-9. doi: 10.1016/j.neuroimage.2007.03.057
PubMed Abstract | CrossRef Full Text | Google Scholar
27.多発性硬化症におけるフラクタル次元の変化と白質変化。 統合失調症と強迫性障害における大脳皮質表面のフラクタル次元. Neurosci Lett. (2005) 384:172-6. doi: 10.1016/j.neulet.2005.04.078
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Benjamini Y, Hochberg Y. このような場合、「偽発見率の制御:多重検定への実用的で強力なアプローチ」である。 J R Stat Soc B. (1995) 57:289-300. doi: 10.1111/j.2517-6161.1995.tb02031.x
CrossRef Full Text | Google Scholar
29.ベンジャミニ・Y・ホッホベルグ:偽発見率の制御:多重検定の実用的で強力なアプローチ。 Schmahmann JD, Pandya DN. このような場合,”beautiful “であることが重要である。 J Comp Neurol. (1989) 289:53-73. doi: 10.1002/cne.902890105
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Girard B, Tabareau N, Berthoz A, Slotine JJ. 大脳基底核の収縮モデルを用いた選択的増幅。 Pont A Mousson: NeuroComp (2006). p. 30-3.
Google Scholar
31. Brain. (1996) 119:1497-505. doi: 10.1093/brain/119.5.1497
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Dohlinger S, Hauser TK, Borkert J, Luft AR, Schulz JB. 脊髄小脳失調症における磁気共鳴画像。 小脳。 (2008) 7:204-14. doi: 10.1007/s12311-008-0025-0
PubMed Abstract | CrossRef Full Text | Google Scholar
33.小脳失調症における磁気共鳴画像。 Rezende TJ, D’Abreu A, Guimaraes RP, Lopes TM, Lopes-Cendesc I, Cendes F, et al. Machado-Joseph病における大脳皮質の病変. Eur J Neurol. (2015) 22:277-83, e23-4. doi: 10.1111/ene.12559
CrossRef Full Text | Google Scholar
34.邦訳:「大脳皮質病変」(邦訳:「大脳皮質病変」)。 呂 CS、張 HC、郭 PC、劉 YL、呉 WS、翁 YH、他 台湾の家族における脊髄小脳失調症3型のパーキンソン表現型。 また、”Parkinsonism Relat D.” (2004) 10:369-73. doi: 10.1016/j.parkreldis.2004.03.009
PubMed Abstract | CrossRef Full Text | Google Scholar
35. 常染色体優性小脳失調症1型,2型,3型における後窩構造および基底核のMRIによる容積測定. Brain. (1998) 121:1687-93. doi: 10.1093/brain/121.9.1687
PubMed Abstract | CrossRef Full Text | Google Scholar
36.小脳失調症1型と2型、3型における後窩構造と基底核のMRIによる体積測定。 Socal MP, Emmel VE, Rieder CRM, Hilbig A, Saraiva-Pereira ML, Jardim LB. SCAにおけるパーキンソン表現型の家族内変動:SCA2およびSCA3拡大による新規症例。 Parkinsonism Relat D. (2009) 15:374-8. doi: 10.1016/j.parkreldis.2008.09.005
PubMed Abstract | CrossRef Full Text | Google Scholar
37.邦訳:『パーキンソン病』『パーキンソン病と診断された人』『パーキンソン病と診断された人』『パーキンソン病と診断された人』『パーキンソン病と診断された人』『パーキンソン病と診断された人』。 Bettencourt C, Santos C, Coutinho P, Rizzu P, Vasconcelos J, Kay T, et al. Machado-Joseph病(MJD/SCA3)におけるパーキンソン病表現型:2症例の報告。 BMC Neurol. (2011) 11:131. doi: 10.1186/1471-2377-11-131
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Kandel ER, Schwartz JH, Jessell TM. 神経科学の原理。 ニューヨーク、NY: p. 626-46.
Google Scholar
39.菅野稔彦(1991).菅野稔彦(1991). アズベリーAK、マッカンGM。 神経系の疾患。 神経系の疾患:臨床神経生物学(Clinical Neurobiology). Philadelphia, PA: W.B. Saunders (1992). p. 319-341.
40. Hoover JE, Strick PL. 大脳基底核における複数の出力チャンネル. サイエンス。 (1993) 5:819-21. doi: 10.1126/science.7679223
CrossRef Full Text | Google Scholar
41.フーバー・JE・ストリック、大脳基底核における多重出力チャンネル。 Jan C, Pessiglione M, Tremblay L, Tandé D, Hirsch EC, François C, et al. MPTP投与サルにおけるドパミン神経損失と機能領域との関連性の定量的解析。 Eur J Neurosci. (2003) 18:2082-6. doi: 10.1046/j.1460-9568.2003.02946.x
PubMed Abstract | CrossRef Full Text | Google Scholar
42.邦訳:『神経衰弱』(講談社学術文庫)。 脊髄小脳失調症3型(SCA3):視床神経変性は視床ataxin-3免疫陽性神経細胞核内封入体とは独立して発生する。 Brain Pathol. (2006) 16:218-27. doi: 10.1111/j.1750-3639.2006.00022.x
PubMed Abstract | CrossRef Full Text | Google Scholar
43. このような状況下において,脊髄小脳失調症2型と3型における体性感覚中枢の一貫した病態と,その臨床症状およびリハビリテーション治療における意義について検討した. Brain Res Rev. (2007) 53:235-49. doi: 10.1016/j.brainresrev.2006.08.003
PubMed Abstract | CrossRef Full Text | Google Scholar
.