はじめに
Clostridium difficile関連下痢症(CDAD)は、院内感染の原因として認識される頻度が高まってきた。 CDADの頻度や発生率は大きく異なり、院内感染の発生、抗菌薬の使用パターン、個人の感受性など複数の要因に影響される。 toxin AまたはA/B陽性とCDADおよびその合併症の転帰を追跡した病院による前向き研究の報告はない。
The Centers for Disease Control and Prevention (CDC) はCDADの発生率の経年変化を分析しており、1987年から2001年まで着実に増加していることを報告している(1). この報告では、ウェブベースの投票に参加した440人の感染症専門医の30%が、過去に比べてCDADの発生率が高く、より重症のCDADや再発性のCDADが見られると回答している。 重症で致命的な合併症を持つ症例の割合が増加し、罹患した患者の再発率が増加しているという全体的な印象があります。
病的状態と死亡率に加えて、退院遅延やその他の病院コストなど、C. difficile感染症の経済負担はかなりのものです。
Epidemiology
CDADの頻度と発生率は病院間、およびある施設内で時間の経過と共に変化しています。 病気のリスクは、抗生物質への曝露、消化器系の手術、医療施設での滞在期間の延長、重篤な基礎疾患、免疫低下状態、高齢の患者で増加します。
C. difficile は糞便中に排出されます。 糞便で汚染されたあらゆる表面、装置、材料(例:便器、浴槽、電子直腸体温計)は、C. difficile の芽胞の貯蔵庫として機能する可能性があります。 芽胞は主に、汚染された表面や物品に触れた医療従事者の手を介して患者に移されます(2-6)
 click for large version
click for large version
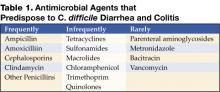
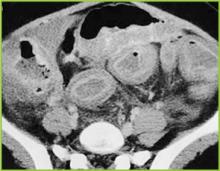
Figure 1 . CTスキャンのデジタルX線写真で、横行結腸の結節性ハウスタル肥厚を示す。
The Organism and Pathophysiology of C. difficile Diarrhea
C. difficileはグラム陽性、嫌気性の芽胞形成性細菌で、抗生物質に関係した下痢と大腸炎の発症に責任があるとされています。 C. difficileは、1935年に健康な新生児の糞便叢の構成要素として初めて報告され、当初は病原性があるとは考えられていませんでした(7)。 この菌は増殖が遅く、培養が困難なため、difficileと名付けられました。 現在、C. difficileは偽膜性大腸炎のほぼすべての原因となり、大腸炎を伴わない抗生物質関連下痢症の20%にも及ぶとされている。 一般集団のわずか5%の便から検出されるが、入院中に成人の21%がこの菌に汚染される(2,6)。
通常、抗生物質療法によって引き起こされる正常な大腸菌叢の変化が、C. difficileに感染しやすくなる主因とされている。 ほとんどすべての抗生物質がC. difficileの下痢や大腸炎に関連している。 最も頻繁に関連する抗生物質は、クリンダマイシン、セファロスポリン、アンピシリン、アモキシシリンです(表1)(8)。
抗生物質療法に加えて、高齢と基礎疾患の重症度はC. difficile感染症の重要な危険因子とされています。 その他の危険因子には、経鼻胃管の存在、胃腸の処置、酸分泌抑制薬、集中治療室への入院、入院期間などがあります(9)。
C. difficile下痢症は、主に腸管内腔内での細菌の増殖によって産生される毒素AおよびBの精製によって引き起こされます。 これらの毒素は大腸粘膜に結合し、有害な作用を及ぼす。 本菌が直接侵入して大腸を損傷することはほとんどなく、腸管内腔内で産生された毒素が粘膜表面に付着する作用によって下痢が引き起こされる。 毒素原性分離株の多くは両方の毒素を産生するが、約5〜25%の分離株は毒素AもBも産生せず、大腸炎や下痢を引き起こさない(3-5)。
臨床症状
C. difficileに感染すると、無症状保菌、軽度から中程度の下痢、偽膜性大腸炎による劇症型など様々な臨床症状を生じることがある(10)。 CDADを発症した患者の場合、症状は通常、保菌後すぐに始まる。 抗生物質の投与中に発症することもあれば、投与後数週間経ってから発症することもあります。 CDADは通常、直腸炎と同様に頻繁で緩い排便を伴います。
Diagnosis
CDADの診断は、最近または現在の抗生物質治療の履歴、下痢または急性大腸炎の他の証拠の発現、および通常便サンプル中の毒素Aまたは毒素Bの検出による、毒原性C. difficileによる感染の証明に基づいて行われます
 click for large version
click for large version
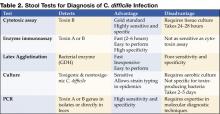
Figure 1 . CTスキャンのデジタルX線写真では、横行結腸の結節性ハウスタル肥厚を示す。
C. difficile下痢症診断のための実用的ガイドライン
- 過去2カ月以内に抗生物質を投与された下痢のある人および/または入院から72時間以上後に下痢を始めた人では診断を疑う必要があります。
- 診断が疑われる場合、C. difficileおよび/またはその毒素の存在を調べるために、1つの便検体を検査室に送るべきです。
- 便毒素の結果が陰性にもかかわらず下痢が続く場合、同じまたは異なる検査のために1つか2つの追加検体が送られます(4)。 内視鏡検査は、迅速な診断が必要で検査結果が遅れている場合や検査感度が低い場合、患者がイレウスで便が出ない場合、他の大腸疾患も考えられる場合など、特殊な場合にのみ行われる。 difficile下痢症および大腸炎を診断するための簡便で安価、高感度、特異的な検査はまだなく、利用可能なすべての検査がすべての検査室で採用できるわけでもありません(表2)(11)。
C. difficile下痢症と大腸炎の内視鏡診断
CDAD患者のほとんどに対してS 状結腸鏡および結腸鏡は適応ではありません(10,12)。 しかし、内視鏡検査は、診断が疑わしい場合や臨床状況により迅速な診断が必要な場合など、特殊な状況においては有用である。 内視鏡検査の結果は、軽度の下痢の患者では正常であったり、中等度の症例では非特異的な大腸炎を示すことがある。 抗生物質関連下痢の患者における大腸偽膜の所見は、事実上C. difficile性大腸炎の予兆である。 直腸S状結腸に診断上の特徴がない患者の中には、結腸のより近位部に偽膜を認めるものが数人いる(13)。 その他の内視鏡所見としては、紅斑、浮腫、friability、小さな潰瘍やびらんを伴う非特異的大腸炎がある。
治療
C. difficile下痢および大腸炎の管理における最初のステップは、可能ならば原因となる抗生物質を中止することだ(10,12)。 下痢は、特定の抗C. difficile療法を行わなくても、患者の約15~25%で消失する(14,15)。 しかし、全身疾患や複数の医学的問題を抱える患者では、どの患者が自然に改善するかを予測することは困難であるため、保存的管理のみでは適応とならない場合があります。 他の感染症が活発であるため、原因となる抗生物質を中止することができない場合、患者の抗生物質レジメンは可能であれば変更し、CDADを引き起こす可能性の低い薬剤(例えば、以下のようなもの)を使用する必要がある。
ジフェノキシレート+アトロピン(ロモチール)、ロペラミド(イモディウム)などの蠕動運動抑制剤、および麻薬性鎮痛剤は、結腸からの毒素排出を遅らせ、毒素による結腸障害を悪化させるかイレウスや中毒性拡張を促進させるため避けるべきである (12,16). C. difficileを根絶するための特別な治療は、最初に重篤な症状を示した患者や、抗生物質治療を中止しても症状が持続する患者において使用されるべきです。 C. difficile 大腸炎の診断は、理想的には抗菌療法を実施する前に確立されるべきですが、現在のACGガイドラインでは、重症患者の示唆に富む症例では経験療法を開始することを推奨しています(54ページの表3)(12)
現在、ほとんどの著者と現在のガイドラインでは7日から10日間使用するバンコマイシンまたはメトロニダゾールの経口が第一選択療法とされています。 メトロニダゾールは250mgを1日4回投与することが、C. difficile大腸炎の初期治療に選択すべき薬剤として、ほとんどの著者とACGガイドラインで推奨されています(12)。 これらの推奨は、主に有効性、低コスト、バンコマイシン耐性株の発生に関する懸念に基づいています。 一方、バンコマイシンは、125mgを1日4回投与することで、安全性と忍容性が高く、C. difficileの治療に必要な最小阻害濃度の20倍の便濃度を達成することができる。 バンコマイシンの使用に関する欠点は、コストとバンコマイシン耐性株の発生の可能性です。 現在のACGガイドラインでは、重症患者やメトロニダゾールの使用が不可能な場合、バンコマイシンを選択薬としている
経口療法に耐えられない劇症型大腸炎患者に対する対照臨床試験は不足している。 メトロニダゾールの静脈内投与や経鼻胃管や直腸浣腸によるバンコマイシンの投与は、小規模なケースシリーズで報告されている(17-20)。 バンコマイシンの静脈内投与は、大腸で排泄されないため推奨されない(17)。
Management of Recurrent C. difficile Diarrhea
CDADの初期治療が成功しても、患者の15~20%は、C. difficile毒素の便検査陽性に関連して下痢を再発する。 症状の再発は、治療の失敗やメトロニダゾールやバンコマイシンに対する抗菌薬耐性が原因であることは稀である。 管理へのアプローチには、保存療法(ただし、多くの患者は高齢で体が弱く、下痢に耐えられない)、特定の抗C. difficile抗生物質による治療、陰イオン結合樹脂の使用、微生物による治療(プロバイオティクス)、免疫グロブリン療法がある。
再発C. difficile下痢に対する最も一般的な治療は、初発の治療に使用した同じ抗生物質の2コース目とするものである(12)。 米国の大規模な観察研究では、再発性CDAD患者の92%が、通常メトロニダゾールまたはバンコマイシンを用いた1コースの反復療法にうまく反応しました(14)。 再発の既往がある患者は、抗生物質治療を中止した後、さらにCDADを発症するリスクが高いことを示唆する証拠がある。 連続したエピソードが徐々に重症化または複雑化することを示唆するデータはない(21)。 C. difficile 下痢の再発を何度も繰り返す患者に対して、様々な治療スケジュールが提案されています。 5765>
陰イオン交換樹脂であるコレスチラミン(4グラムを1日3~4回、1~2週間投与)は、C. difficile毒素と結合し、再発を繰り返す患者の治療に抗生物質と併用して使用されることがある。 コレスチラミンが毒素だけでなくバンコマイシンと結合する可能性があるため、バンコマイシンと少なくとも2~3時間離して服用する必要がある。
Severe C. difficile Colitis
劇症型 C. difficile colitisの発生率は1.6~3.2%と報告されている(22)。 最近の他施設からの正確な数値は不足しているが、合併症や死亡の原因として増加傾向にあると認識されている。 劇症型C. difficile大腸炎の臨床症候群は、疾患発現のスペクトルを正しく知ることで認識することができます。 下痢。 下痢はC. difficile性大腸炎の特徴であるが、常に存在するわけではなく、その不在が診断の混乱を招くこともある。 下痢がない場合は、重度の大腸運動障害に続発すると思われる。 下痢がある場合でも、非特異的な敗血症像の小さな構成要素であると認識されることがある
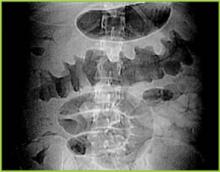 BUMC Proceedings 1999; 12:249-250
BUMC Proceedings 1999; 12:249-250
Figure 1 . CTスキャンによるデジタルX線写真では、横行結腸の結節性ハウスタル肥厚を示す。
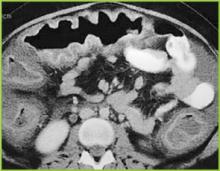 BUMC Proceedings 1999; 12:249-250 より転載
BUMC Proceedings 1999; 12:249-250 より転載
Figure 2 . 上腹部のCT画像で横行結腸の顕著な蹄葉肥厚を確認。
 BUMC Proceedings 1999; 12:249-250
BUMC Proceedings 1999; 12:249-250
Figure 3 . 中腹部のCT画像で、結腸全体の著明な肥厚を示す。 結腸周囲脂肪に軽度の炎症性変化が認められる。
B. 重症化する。 劇症型大腸炎はC. difficile感染症の珍しい型であり、患者の3%にしか発生しないが、事実上すべての重篤な合併症の原因となっている。 より重症の患者は、下痢を伴うこともあれば伴わないこともある。 患者が盲腸と右側結腸に限局した大腸炎を発症した場合、下痢は最小限か消失することがあります。 下痢がない場合、診断の手がかりは全身性の毒性症状(発熱、頻脈、白血球増加、体液減少)のみである。
白血球数の上昇は、切迫した劇症型C. difficile大腸炎の重要な手がかりとなりうる。 末梢白血球数の急激な上昇(一般に30,000~50,000と高い)は、バンドや時にはより未熟な型の著しい過剰を伴い、しばしば血行動態の不安定や内臓機能障害の発現に先行して起こることがある。 長期間にわたって軽度の症状を呈している患者であっても、突然、予期せぬショック状態への移行が起こることがある。 医学的治療に反応しない患者を予測することは困難である。 それゆえ、白血球反応のような早期の警告サインは貴重である。
低血圧は遅発性の所見で、血管圧制御のサポートに抵抗することがある。 腹部徴候は、膨満からガードリングを伴う全身の圧痛までである。 大腸穿孔は通常、腹部硬直、不随意運動、反跳性圧痛、腸音欠如を伴う。 腹部X線写真で遊離空気が確認されることもある。 このような状況で穿孔が疑われる場合は、直ちに外科的診察を受ける必要がある。 一般に、遊離気泡や穿孔が生じる前に死亡する。
腹部X線写真では、拡張した結腸(最大径>7cm)を示すことがあり、中毒性巨大結腸と一致する。 巨大結腸の患者は、腹部単純X線写真で小腸が拡張し、小腸閉塞または虚血を模した気液レベルを伴う小腸イレウスを併発することがある。 造影剤を使用しないCTと内視鏡検査により、劇症型C.difficile大腸炎を迅速に診断するか、少なくとも強く示唆することができます。 CTスキャン所見には、腹水、結腸壁の肥厚および/または拡張の証拠が含まれます。 これらの所見は、大腸炎の重症度を分類するのに役立つと思われます。
内科的治療に反応しない患者を迅速に特定するなど、内科的に反応しない患者に対してより積極的に介入することが、良い結果を得るために重要で、このグループには早期に外科的治療を行うべきです(図1~3)。 difficile下痢症患者の治療とケアに関する合理的なアプローチ、患者との接触時の手洗いの重要性、C. difficile下痢症患者をケアする際の手袋の使用、および抗菌薬の不必要な使用を避けること、について教育されることが重要です。 Canadian Medical Association誌は、2004年にモントリオールのいくつかの病院を巻き込んだCDADのアウトブレイクを詳細に報告した。 C. difficile の新しい高病原性・高伝染性株の導入が、この集団発生の原因であると推測されています(24)。 米国とカナダの 2 つの疫学調査(24,26)では、C. difficile のサンプルを独自に調査し、「野生株」の変異型が、ケベック州の集団発生と米国の病院における最近の CDAD の発生率の上昇の原因であることが判明した(22,23)。 CDCの臨床疫学者は、最近(すなわち2001年から2004年)CDADが発生した米国の病院から分離されたC. difficileを調査しました(22,23)。 この報告は、新しい流行株である「BI」(1989-1992年の「J」株とは異なる)の出現を示し、これが最近のCDADの発生率および見かけの重症度の上昇の原因となっている可能性がある(26)。 一部の患者では、適切かつ適時の医学的治療にもかかわらず、生命を脅かす重度の毒性が発現し、外科的介入が必要となる。 C. difficileの感染による全身症状は、菌血症や大腸穿孔、虚血に由来するものではなく、大腸から放出される毒素誘発性の炎症メディエーターに由来すると報告されています(27-29)。 難治性の重症例には、早期の外科的介入を行うべきである。 しかし、外科的治療は理想的とは言い難く、合併症の発生率が非常に高く、死亡率のリスクも大きい(22)。 院内 C. difficile 大腸炎の治療に対する将来の臨床的アプローチとして、最終的には特異的な抗毒素の高免疫グロブリンと炎症カスケードの阻害剤が必要になるかもしれません (28,30,31)。 米国における院内感染したクロストリジウム・ディフィシル病の経年的傾向;1987-2001年。 J Infect Dis. 2004;189:1585-9.
- Fekety R. Antibiotic-associated colitis(抗生物質関連大腸炎). In: マンデルG、ベネットJE、ドリンR、eds. 感染症の原則と実践。 第4版. ニューヨーク。 7647>
- Mitty RD, LaMont T. Clostridium difficile diarrhea: 病原性、疫学、および治療。 Gastroenterologist. 1994;2:61-9.
- Bartlett JG. Clostridium difficile:腸内病原体としての役割の歴史と、この菌に関する知識の現状。 Clin Infect Dis. 1994;18(Suppl 4):265-72.
- Johnson S, Gerding D. Clostridium difficile(クロストリジウム・ディフィシル). In: このような状況下で、「感染症対策」の重要性はますます高まっている。 Baltimore, Md:
- Mcfarland LV, Mulligan ME, Kwok RY, Stamm WE. Clostridium difficileの院内獲得。 N Engl J Med. 1989;320:204-10.
- Hall IC, O Toole E. Intestinal Flora in new-born infants.(新生児の腸内フローラ): 新しい病原性嫌気性菌Bacillus difficileの説明をもって。 Am J Dis Child. 1935;49:390-402.
- Kelly CP, LaMont JT. クロストリジウム・ディフィシル下痢症および大腸炎の治療。 In: Wolfe MM, ed. 消化器薬物療法。 Philadelphia, Pa.: WB Saunders; 1993:199-212.
- Bignardi GE. Clostridium difficile 感染の危険因子。 J Hosp Infect. 1998;40:1-15.
- Kelly CP, Pothoulakas C, LaMont JT.(ケリーCP、ポスラカスC、ラモントJT)。 クロストリジウム・ディフィシル大腸炎。 N Engl J Med. 1994;330:257-62.
- Linevsky JK, Kelly CP. クロストリジウム・ディフィシル大腸炎。 In: Lamont JT, ed. 消化器感染症。 Diagnosis and Management(診断と管理). New York: 7647>
- Fekety R. Clostridium difficile associated diarrhea and colitis の診断と管理に関するガイドライン。 米国消化器病学会、診療パラメーター委員会。 Am J Gastroenterol. 1997;92:739-50.
- Tedesco FJ, Corless JK, Brownstein RE. 抗生物質関連偽膜性大腸炎における直腸温存。 プロスペクティブスタディー。 胃腸病学。 1982;83:1259-60.
- Olson MM、Shanholtzer CJ、Lee JT Jr、Gerding DN. ミネアポリスVAメディカルセンターにおける10年間のプロスペクティブなクロストリジウム・ディフィシル関連疾患のサーベイランスと治療、1982年-1991年。 Infect Control Hosp Epidemiol. 1994;15: 371-81.
- Teasley DG, Gerding DN, Olson MM, et al. Clostridium-difficile-associated diarrhoea and colitis に対する metronidazole 対 vancomycin の前向き無作為化試験. Lancet. 1983;2:1043-6.
- Walley T, Milson D. Loperamide-related toxic megacolon in Clostridium difficile colitis(クロストリジウム・ディフィシル感染性大腸炎におけるロペラミド関連毒性巨大結腸). また、このような場合にも、「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」。 Ann Pharmacother. 2002;36:1767-75.
- Sehgal M, Kyne L. Clostridium difficile disease.2002;36:1767-75.マルニックSD, ジムニーO. Curr治療の選択肢の感染症。 2002;4:201-10.
- Apisarnthanarak A, Razavi B, Mundy LM. 重症クロストリジウム・ディフィシル大腸炎に対するバンコマイシンの併用:ケースシリーズと文献のレビュー。 Clin Infect Dis. 2002;35:690-6.
- Friendenberg F, Fernandez A, Kaul V, Niami P, Levine GM.を参照。 クロストリジウム・ディフィシル大腸炎の治療におけるメトロニダゾールの静脈内投与。 Dis Colon Rectum. 2001;44:1176-80.
- Fekety R, McFarland LV, Surawicz CMGreenberg, RN, Elmer GW, Mulligan ME. 再発性Clostridium difficile下痢症:前向き無作為化二重盲検試験に登録された患者の特徴と危険因子。 Clin Infect Dis. 1997;24:324-33.
- Dallal RM, Harbrecht BG, Boujoukas AJ, et al. Fulminant Clostridium difficile: an underappreciated and increasing cause of death and complications.重症クロストリジウム・ディフィシル:死と合併症の過小評価と増加する原因。 Ann Surg. 2002;235:363-72.
- Morris AM, Jobe BA, Sontey, M, Sheppard BC, Deveney CW, Deveney KE.・・・・・・・・・・。 クロストリジウム・ディフィシル大腸炎:ますます攻撃的になる医原性疾患か? Arch Surg. 2002;137:1096-100.
- Eggerston L, Sibbald B. Hospitals battling outbreaks of C. difficile.(C.ディフィシルのアウトブレイクと戦う病院)。 CMAJ. 2004;171:19-21.
- Valiquette L, Low DE, Pepin J, McGeer A. Clostridium difficile infection in hospitals: a brewing storm.病院におけるクロストリジウム・ディフィシル感染症:嵐の到来。 CMAJ. 2004;171:27-9.
- McDonald LC, Killgore GE, Thompson A, et al. 米国におけるClostridium difficileの流行株の出現、2001-4: 病原因子と抗菌薬耐性形質が果たす役割の可能性。 米国感染症学会第42回年次総会。 2004年9月30日〜10月3日、マサチューセッツ州、ボストン。 抄録番号 LB-2.
- Flegel W, Muller F, Daubener W, Fischer HG, Hadding U, Northoff H. Cytokine response by human monocytes to Clostridium difficile toxin A and toxin B. Infect Immun. 1991;59:3659-66.
- Castagliuolo I, Keates A, Qiu B, et al. Increased substance P responses in dorsal root ganglia, intestinal macrophages during Clostridium difficile toxin A enteritis in rats.(ラットにおけるクロストリジウム・ディフィシル・トキシンA腸炎時の後根神経、腸マクロファージにおけるサブスタンスP反応の増加). また、「膀胱炎」、「胃腸炎」、「大腸炎」、「膀胱炎」、「膀胱炎」、「膀胱炎」、「膀胱炎」、「膀胱炎」、「膀胱炎」、「膀胱炎」、「膀胱炎」、「膀胱炎」、「膀胱炎」、「膀胱炎」、「膀胱炎」、「膀胱炎」、「膀胱炎」、「膀胱炎」、「膀胱炎」、「大腸炎」、「膀胱炎」、「大腸炎」、「大腸炎」、「大腸腺管症症例数 J Immunol. 1998;160:6039-45.
- Kelly C, Chetham S, Keates S, et al. ヒト消化管における抗Clostridium difficileウシ免疫グロブリン濃縮物の生存率。 Antimicrob Agents Chemother. 1997;41:236-41.
- Salcedo J, Keates S, Pothoulakis C, et.al. Intravenous immunoglobulin therapy for severe Clostridium difficile colitis.(重症クロストリジウム・ディフィシル大腸炎に対する免疫グロブリン静注療法). Gut. 1997;41:366-70.