はじめに
慢性腎臓病(CKD)は高い死亡率と関連しており、特に心血管関連のものが原因であることが分かっています。 しかし、これらの患者における死亡率と従来の心血管危険因子との関連は限定的であり、逆説的である。 炎症や栄養に関連するいくつかのマーカー(例えば、CRPや血清アルブミン)が、CKDにおける死亡率の一貫した予測因子であることが示されているのみである1。
近年、いくつかの観察研究で、CKD患者における血清アルカリホスファターゼ(ALP)濃度の上昇と死亡率の間に関連があることが示されている2-5。 血清GGTは、従来からアルコール摂取や肝胆道系疾患の指標とされているだけでなく、いくつかの研究により、血清GGT値の上昇と心血管疾患、糖尿病、高血圧およびメタボリックシンドロームとの関連も示されています7。
GGT値は一般集団における死亡率の予測因子であり、実際、この酵素は最近、死亡率を予測する一連の生化学的パラメータの1つに含まれています。
さらに、血清GGT値は原因不明の高いALP値の解釈に役立つと考えられます。 本研究の目的は、血清GGT値が異常に上昇したCKD患者の臨床的特徴およびALPとの相互作用を調べ、死亡率の予測因子としてのこのパラメーターの価値を明らかにすることである。
材料と方法
本研究は、2002年1月から2013年10月まで、スペイン・バダホスのInfanta Cristina病院の腎臓内科の低クリアランス(進行性CKD)外来でフォローされている成人患者コホートに対して実施した後ろ向き観察的研究である。 本試験では,推定糸球体濾過量(eGFR)<4346>mL/min/1.73m2の18歳未満の透析導入前患者をすべて対象とした。 年齢、性別、体格指数(BMI)、合併症、投薬などの人口統計学的データおよび臨床パラメータを記録した。 主な併存疾患は、糖尿病、心不全、冠動脈疾患、脳血管疾患、末梢血管疾患、慢性閉塞性肺疾患、がん、慢性炎症性疾患である。
本研究では、「肝臓疾患」という用語には慢性肝臓疾患、肝硬変または肝移植と診断されている患者だけでなく、活動性アルコール中毒、活動性肝炎ウイルス感染(BまたはC)患者も含まれている。 非アルコール性脂肪肝炎(脂肪性肝疾患)は、これらの患者の間でよく見られる超音波所見であったが、この疾患は肝臓疾患のリストに含まれていなかった。
患者は、研究への参加時から死亡、腎移植、追跡不能またはデータ収集期間の終了(2014年12月31日)まで定期的に追跡された。
研究のレトロスペクティブデザインから、個人のインフォームドコンセントは得られていなかった。
生化学的測定
2002年1月から、血清GGTと総ALPが、当院の進行したCKDクリニックの患者におけるルーチンの生化学的パラメーター測定に加えられた。
GT値は自動分析装置(Advia Chemistry、Siemens Healthcare Diagnostics、ニューヨーク、アメリカ)で、γ-グルタミル-3-カルボキシ-4-ニトロアニリドとグリシログリシンを用いたキネティック比色法にて決定された。 変動係数は4.5%以下、基準範囲は0〜36U/L。
血清ALP値もオートアナライザー(アドビア化学)で測定した。ALPI法は、2-アミノ-2-メチル-1-プロパノール存在下でp-ニトロフェニルリン酸をp-ニトロフェノールにトランスリン酸化することによりアルカリニンホスファターゼ活性を測定するもので、測定値は0.5%以下、基準範囲は0〜36U/L。 変動係数は4%未満で、基準範囲は45-120U/Lであった。
血清GGTまたはALPが異常に上昇した患者を特徴づけるために、ベースラインの血液学および生化学パラメータ(表1に示す)も研究に含まれることになった。 生化学的パラメータは従来の実験室法(Advia Chemistry, New York, USA)で測定した。 副甲状腺ホルモン(分子7-84)(PTH)濃度は自動化学発光免疫測定法(DiaSorin、イタリア)、血清アルブミン濃度はブロモクレゾールグリーン法、高感度C反応性タンパク質は固相化学発光酵素免疫測定法(Immulite autoanalyser、Diagnostic Product Corporation、ニューヨーク、アメリカ)で測定された.
患者セットの臨床的および生化学的特徴、ならびにGGTまたはALPの異常高値によるサブグループ。
| 合計 | GGT および ALP 正常 | 高レベル GGT | ALP高値 | GGTとALPが同時に高値 | P* | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| N 患者数 | 909 | 596 | 141 | 104 | 68 | 1471 | |||||
| 65 (15) | 66 (15) | 63 (13) | 66 (17) | 66 (14) | 0.234 | ||||||
| 性別、男性/女性 | 485/424 | 316/280 | 81/60 | 46/58 | 42/26 | 0.094 | |||||
| なし | 31 | 37 | 21 | 29 | 9 | Mild-> | |||||
| 9中程度 | 52 | 48 | 63 | 59 | 54 | ||||||
| 重度 | 17 | 15 | 16 | 12 | 37 | ||||||
| アクティブスモーカーの方。 % | 15 | 14 | 21 | 10 | 25 | 0.011 | |||||
| 糖尿病, % | 39 | 35 | 46 | 41 | 50 | 0.013 | |||||
| 肝臓病、% | 3 | 2 | 6 | 2 | 10 | ||||||
| 虚血性心疾患, % | 16 | 14 | 10 | 16 | 38 | ||||||
| CNSまたは末梢性虚血症。 % | 21 | 19 | 18 | 23 | 34 | 0.031 | |||||
| 心不全、% | 18 | 16 | 21 | 14 | 37 | ||||||
| BMI、kg/㎡ | 29.4 (6) | 29.2 (5.8) | 29.4 (6) | 30.6 (6.7) | 29.4 (5.9) | 0.176 | |||||
| eGFR, mL/min/1.73 m2 | 14.7 (5.1) | 14.8 (5.1) | 14.8.6 (4.6) | 14.1 (4.4) | 15.6 (6.2) | 0.234 | |||||
| ヘモグロビン (g/dl) | 11.4 (1.7) | 11.4 (1.7) | 11.1 (1.7) | 11.4 (1.5) | 11.6 (1.8) | 0.205 | |||||
| 血清尿酸、mg/dL | 7.6 (1.9) | 7.5 (1.9) | 7.9 (2.0)1) | 7.5 (1.7) | 8.4 (2.4)a | ||||||
| 総コレステロール、mg/dL | 186(49) | 187(48) | 191(56) | 179(42) | 182(50) | 0.226 | |||||
| トリグリセリド, mg/dL | 147 (96) | 140 (76) | 167 (133)b | 140 (70) | 171 (163) | 0.003 | |||||
| 血清アルブミン、g/dL | 3.9 (0.5) | 3.9 (0.5) | 3.8 (0.5) | 3.9 (0.5) | 3.8 (0.5) | 0.151 | |||||
| 血清総カルシウム量、mg/dL | 9.1 (0.8) | 9.2 (0.0)9) | 9.2 (0.7) | 9 (0.9) | 8.9 (0.8) | 0.049 | |||||
| 血清リン、mg/dL | 4.7 (1.1) | 4.7 (0.9) | 4.6 (1.2) | 4.7 (1.1)2) | 4.6 (1.2) | 0.851 | |||||
| 血清重炭酸塩、mEq/L | 21.4 (3.9) | 21.6 (3.8) | 21.2 (3.7) | 20.5 (4.4) | 22.1 (4.5) | 0.026 | |||||
| PTH, pg/mL | 267 (220) | 241 (187) | 234 (184) | 448 (337)c | 281 (195) | ||||||
| ALT.L | 241 (181) | 242 (181) | 242 (181) | 242 (181)c | 242 (181)c IU/L | 18 (16) | 16 (8) | 25 (23)d | 15 (6) | 30 (39)d | |
| GGT。 IU/L | 36 (63) | 18 (8) | 69 (39)d | 19 (8) | 142 (181)d | ||||||
| ALP.L | 18 (8) | 142 (181) D IU/L | 99 (52) | 79 (20) | 89 (21) | 163 (67)e | 187 (88)e | ||||
| 血清フェリチン.IU/L, ng/mLg | 173 (247) | 148 (179) | 284 (361)d | 112 (118) | 271 (465)d | ||||||
| C反応タンパク質、mg/L | 9.9 (17.3) | 8.5 (15.6) | 14.6 (22.2)f | 6.9 (9.4) | 17.8 (24.2)f | ||||||
| タンパク尿、mg/gクレアチニン | 2462(2787) | 2227(2632) | 2726(3035) | 3023(3314) | 3109(2473) | 0.1(0.) 0.2(0.) | 0.1(0.) 以上 | 0.1(0.) 以上004 | |||
| レニン-アンジオテンシン阻害剤, % | 79 | 80 | 78 | 72 | 0.0% | 78 | 78502 | ||||
| β遮断薬, % | 26 | 25 | 30 | 22 | 35 | 0.1%未満。140 | |||||
| 利尿剤, % | 60 | 59 | 62 | 60 | 65 | 0.829 | |||||
| スタチン系薬剤, % | 53 | 54 | 53 | 55 | 47 | 0.762 | |||||
| Alopurinol, % | 22 | 25 | 26 | 13 | 0.200 | ||||||
| ビタミンD類縁体, % | 10 | 7 | 15 | 9 | 0.1%未満。201 | ||||||
| 抗血小板剤, % | 34 | 33 | 28 | 41 | 38 | 0.1%未満。124 | |||||
データは特に断らない限り、平均値(標準偏差)で表示しています。
グループ間のANOVAまたはχ2
a
P0.05 high GGT-ALP vs. normal GGT-ALP or high ALP, Scheffé test.
P0.05 high GGT vs. normal GGT-ALP, Scheffé test.
P0.0001 high ALP vs. high ALP, Scheffé test.
P0.0001 high GGT vs. normal ALP,
P0.05 high GGT vs. normal ALP,
P0.0001 high GGT or high GGT-ALP vs. normal GGT-ALP or high ALP、Scheffé test.
P0.0001 high ALP or high GGT-ALP vs. the high ALP, schedé test.
P0.001 high GGT or high GGT-ALP vs. normal GGT-ALP or high ALP, Scheffé test.
845 例でデータあり。
糸球体濾過量(eGFR)の推定にはMDRD-4式を用いた。12
血清フェリチンは欠損値のある唯一のパラメータであった。 利用可能な値の平均は記述的分析に含まれたが、欠損値は計算されず、この変数は生存分析に共変数として含まれなかった。
結果変数
結果変数はあらゆる原因による死亡であった。 4346>統計解析
連続変数の記述的比較には、その特徴に応じてパラメトリック検定またはノンパラメトリック検定を用い、カテゴリー変数にはカイ二乗検定を用いた。 GGTまたはALPの四分位による患者間の生存の差は、Kaplan-Meier曲線を用いて分析し、Mantel-Haenszel log-rank検定を用いて比較した。
多変量Cox比例ハザードモデルを用いて、ベースラインのGGTおよびALP値が全死亡までの時間に及ぼす影響を分析した。
ベースラインのGGTおよびALP値は正の偏った分布を示したため、連続変数として含めるために値は対数変換された。
異なる募集期間を考慮するため、募集期間(2002-2005、2006-2009、2010-2014)に対応するカテゴリ変数に従って多変量モデルも調整された。
GGTとALPは連続変数(対数変換)およびカテゴリー変数:上位四分位値と異常高値(GGT>36IU/L、ALP>120IU/L)として分析された
以下の回帰モデルも含まれた。 (1)一変量。 (2). 年齢、性別、併存疾患スコア、糖尿病、肝疾患、アクティブスモーカー、BMI、ベースラインeGFR、募集期間について調整した。 (3)モデル2と同じ変数に加え、血清総カルシウム、リン、PTH、アルブミン、CRP、トリグリセリド、尿酸、アラニンアミノトランスフェラーゼ(ALT)値で調整したもの。 (4) 後方条件付きステップワイズ消去法による最適適合モデル。
比例ハザードの仮定は、各変数の対数-マイナス対数曲線とシェーンフェルド残差を用いて検証した。 患者は死亡、追跡不能、腎移植、追跡終了(2014年12月31日)のいずれか先に発生した時点で打ち切られた。
記述的データは、連続変数については平均値と標準偏差、または中央値と四分位範囲、カテゴリー変数については絶対値とパーセントで示される。 A p値
結果患者特性
研究グループはCKDステージ4または5の透析前患者909人(平均eGFR14.7±5.1mL/min/1.73m2)であった。 平均年齢(±SD)は65±15歳で,53%が男性であった。 全員が白人であった。 ベースラインの臨床的および生化学的特徴を表1に示す。
GGTまたはALPの異常高値の有無による患者の臨床的および生化学的特徴を分析するために,患者は4つのサブグループに分けられた(表1):GGTおよびALP値が正常(患者の66%),GGTが高いがALPが正常(16%),GGTが正常だがALPが高い(11%),GGTとALPが同時に高値(7%)である。
このように,209名(23%)と172名(19%)の患者は,それぞれベースラインのGGTとALPが異常に高かった。 GGTとALPの上位四分位値はそれぞれ34IU/Lと112IU/Lであった。
サブグループ間の平均年齢と性分布に有意差はなかった。 合併症スコアと喫煙者の割合は,高GGT患者,特にGGTとALPが同時に高いグループで顕著に高かった(表1). しかし,GGT値が高い患者の約8%は肝臓疾患と診断されていた。
高GGTまたは高ALPのいずれかの患者における心血管疾患の有病率は,GGTおよびALP値が正常な患者のそれと同様だったが,この有病率はGGTおよびALPが同時に高い患者で著しく増加した。
生化学パラメータにおいてサブグループ間で有意差が観察された(Table 1)。 GGT高値の患者は,GGTとALPが正常値の患者,あるいはALPのみが高値の患者と比較して,尿酸,トリグリセリド,ALT,フェリチン,CRPの血清濃度が高値であった。 ALP単独高値患者のサブグループは、PTH値が高かった。 ベースラインの平均アルブミン値はサブグループ間で類似していた。
GGTまたはALPと関連するこれらの生化学的パターンは、二変量相関分析によって確認された(表2)。
| Log GGTa | Log ALPb | ヘモグロビン | 尿酸 | トリグリセリド | ALT | リン | カルシウム | フェリチン | アルブミン | PTH | C-.反応性タンパク質 | eGFR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Log GGTa | Log ALPb | 0.337** | ヘモグロビン | -0.001 | 0.029 | 尿酸 | 0.162** | 0.051 | 0.068* | 0.164** | 0.052***.0%未満 | 0.062***.0%未満 | 0.062***.0%未満 | 6668 | トリグリセリド | 0.164**.0% | 0.062***.0%未満 6471> 6471> 6471> 6471> 6471 | 0.063 | 0.083* | 6671 | alt | 0.083* | 6471 | 0.011 | 6671 6668 | |||||||||||||||||||||||||||||||||||||||||||
| 6671 | 6468 | 0.107** | 0.002 | 0.093** | 0.043 | 0.013 | 0.024 | 0.092* | -0.075* | 0.020 | 0.026 | カルシウム | 0.011.019 | -0.105** | 0.161** | 0.034 | 0.127** | 0.014 | -0.178** | 0.178** | 0.014 | 0.024 | 0.014 フェリチン | 0.014 フェリチン | 1014 フェリチン | 1014 フェリチン | 1014 フェリチン | 1014 フェリチン 1014244** | 0.050 | -0.149** | 0.054 | 0.059 | 0.195** | -0.037 | -0.043 | -0.043 | -101072* | -0.074* | 0.208** | -0.004 | 0.029 | 0.009 | -0.097** | 0.317** | -0.112** | -0.055 | -0.055 | 0.296** | -0.060 | 0.066* | -0.025 | -0.042 | 0.244** | -0.168** | -0.100** | -0.072* | 0.197** | 0.141* | ||||||||||
| C-reactive protein | 0.197** | 0.141* | 0.142* | 0.072**(単位:百万円088** | -0.190** | 0.076* | 0.005 | 0.021 | -0.048 | -0.055 | 0.238** | -0.233** | -0.077* | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| eGFR | 0.080* | -0.028 | 0.163** | 0.080* | 0.080* | 0.008 | -0.015 | 0.003 | -0.555** | 0.136** | 0.044 | 0.012 | -0.268** | 0.054 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 蛋白尿 | 0.098* | 0.131** | -0.055 | -0.081* | 0.161** | 0.077* | 0.207** | -0.250** | 0.005 | -0.534** | 0.065 | 0.005 | -0.158** |
P0.05.
P0.01.
ログ変換ガンマ・グルタミル・トランスフェラーゼ.P0.
対数変換アルカリホスファターゼ.
死亡率と関心のある他のイベント
合計365人(40%)が試験期間に死亡、患者セットの生存期間は中央値74ヶ月(表3)であった。 予想通り、最も多い死因は心血管系と感染症で、サブグループ間での有意差は認められなかった(表3)。
グループ全体およびGGTとアルカリホスファターゼ(ALP)によるサブグループでの死亡率およびその他の注目すべき結果変数。
| GGT高値群 | ALPが高い | GGTとALPが同時に高い | ||||
|---|---|---|---|---|---|---|
| 平均生存期間, ヶ月 | 74 | 86 | 61 | 82 | 38 | |
| 死亡した人。 N (%) | 365 (40) | 219 (37) | 61 (43) | 46 (44) | 39 (57) | |
| 死因、N (%)です。 | ||||||
| 突然死 | 58 (16) | 34 (16) | 13 (21) | 5 (11) | 6 (15) | |
| 心血管 | 82 (37) | 17 (28) | 23 (50) | 15 (39) | ||
| 感染症 | 53 (14) | 32 (15) | 9 (15) | 10 (22) | 2 (5) | |
| 悪性腫瘍 | 38 (10) | 24 (11) | 7 (11) | 1 (2) | 6 (15) | 3 (5) |
| その他 | 79 (22) | 47 (21) | 15 (25) | 7 (15) | 10 (26) | |
| 人工透析, N (%) | 526 (58) | 346 (58) | 80 (57) | 67 (64) | 33 (48) | |
| 腎臓移植, N (%) | 133 (15) | 92 (15) | 20 (14) | 16 (15) | 5 (7) | |
| Lost to follow-up.の略。 N (%) | 71 (8) | 49 (8) | 14 (10) | 6 (6) | 2 (3) | |
フォローアップ期間に実施。 58%の患者が透析を開始しなければならず、15%が腎臓移植を受けた(先天性移植はなかった)。
生存率の決定因子としてのガンマ・グルタミル・トランスフェラーゼとアルカリフォスファターゼ
図1と図2は、それぞれGGTとALP値の度数分布四分位に応じたカプラン・マイヤー生存曲線である。 GGT値またはALP値が高い患者(上位四分位)は生存率が悪かった。
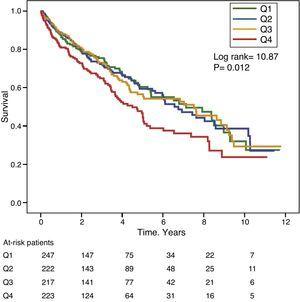
Kaplan-Meier Survival Curves according to frequency distribution quartiles of serum GGT levels (Q, quartiles).
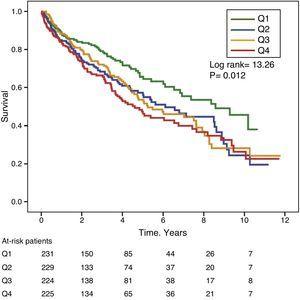
血清ALP値の度数分布四分位数によるKaplan-Meier生存曲線。 (Q=四分位).
Cox回帰モデルを使用すると、連続またはカテゴリー変数としてのGGT (上位四分位または血清値 >36IU/L) は分析したモデルで死亡率上昇と有意に関連していました (表4). ALPもまた、分析したすべてのモデルにおいて死亡率の増加と有意に独立して関連していたが、ALPを上位4分の1の値として定義されるカテゴリー変数として最適なモデルに含めた場合は、その限りでなかった。 このモデルでは、ALPと死亡率の関連度は統計的な有意差に達しなかった(P=0.052)(表4)。
| 変数 | 一変量HR(95%CI) | 多変量モデル1a HR(95%) | 多変量モデル2b HR(95% CI) | 多変量モデル3c HR(95% CI) | ||||
|---|---|---|---|---|---|---|---|---|
| Log->Log変形GGT | 1.310 (1.154-1.489) p0.0001 |
1.260 (1.095-1.449) p0.0001 |
1.174 (1.005-1.371) p=0.002 |
1.170 (1.004-1.371) p0.0001042 |
1.166 (1.010-1.347) P=0.036 |
|||
| GT 上限値 | 1.459 (1.163-1.829) P=0.001 |
1.415 (1.119-1.829) GGT 上限値 0.05 (1.052-1.830)788) P=0.004 |
1.329 (1.036-1.705) P=0.025 |
1.315 (1.064-1.714) P=0.013 |
||||
| ggt>36iu/l | 1.8 (2.9-1.9) 1.9 (2.9-1.9) | 1.9 (2.9-1.9) | 1.9 (2.1-1.9) | 0.9513 (1.202-1.905) p0.0001 |
1.509 (1.185-1.923) p=0.001 |
1.393 (1.078-1.800) p=0.011 |
1.390 (1.089-1.779) p=0.011 |
1.009 |
| 対数変換ALP | 1.635 (1.278-2.093) P0.0001 |
1.479 (1.149-1.904) P=0.002 |
1.395 (1.3.061-1.833) P=0.017 |
1.327 (1.008-1.746) P=0.044 |
||||
| ALP upper quartile | 1.332 (1.062-1.670) P=0.013 |
1.8 (1.062-1.776)P=0.024 | 1.7倍 | 1.8倍 | 1.8倍 | 1.277 (1.001-1.630) p=0.049 |
1.261 (0.998-1.594) p=0.052 |
|
| alp>120iu/l | 1.1。527 (1.197-1.947) p=0.001 |
1.419 (1.109-1.815) p=0.005 |
1.362 (1.048-1.770) p=0.021 |
1.305 (1.015-1.678) p=0.009 |
1.302 (1.066-1.770)P=0.008 | 1.362 (1.066-1.770) P=0.008038 |
年齢、性別、併存疾患指数、糖尿病、喫煙、肝臓疾患、BMI、eGFR、試験期間で調整したもの。
モデル1のすべての共変数に加え,カルシウム,リン,PTH,尿酸,トリグリセリド,ALT,アルブミン,C反応性蛋白について調整。
モデル1、2のすべての変数にGGTまたはALPを加えたモデルで、自動変数選択処理で最も適合度の高いもの。
GGT高値(>36IU/L)患者の死亡率のハザード比(HR)は、完全調整モデルでALP高値(>120IU/L)患者で観察されたもの(HR=1.31)と同様であった(表4)。 図3は、この関連を示すKaplan-Meier生存曲線と、GGTとALPが同時に高い場合の生存率低下に対する相加効果を示している。
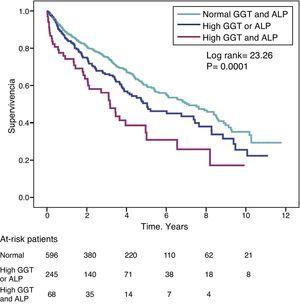
GGTとALPが正常値、GGTまたはALPが異常高値(どちらか一方)、GGTとALPが同時に高値の場合の試験患者のカプラン・マイヤー生存曲線
GGTとALPの死亡率との関連に、肝疾患の併存が交絡する可能性を評価するため、以前に肝疾患と診断された患者27名を除外してCox回帰モデルを構築した。 この適合モデルでは、高GGT(>36IU/L)は死亡率と統計的に有意な関係を維持した(HR=1.316; 95% CI: 1.016-1.705; P=0.03)、一方、ALP高値(>120IU/L)は統計的に有意な限界での関連を示した(HR=1.296、95% CI: 0.999-1.680; P=0.05)。
考察
本研究結果は、血清GGTまたはALP高値はCKD患者の高い死亡率と独立して関連していたことを示している。 また、肝疾患のない患者においても、両パラメータの同時上昇が死亡率の予測に相加的な影響を及ぼすことが、本研究で初めて明らかとなった。
この研究では、CKDと高いGGT値を持つ患者は、特に糖尿病と心不全などの併存疾患が多く、このサブグループのBMIは他の研究患者のものと変わらなかったが、メタボリックシンドロームに見られるような生化学的プロファイルを有していた。 この意味で、特定のALPアイソザイムを決定することは、孤立した上昇が骨リモデリングの増加に起因することができない場合、その起源を区別するのに有用である。
CKDと高いALPレベルの患者で報告された過剰死亡率は、骨-ミネラル代謝に対する非常に厳しい制御不能の結果として、潜在的な心血管の悪影響に起因するという議論がある(2、3、13、14)。 この関連を説明するために、動脈壁でのピロリン酸加水分解による血管石灰化の増加15、全身性炎症16,17、ビタミンDの欠乏18など、いくつかの発症メカニズムが提案されています。 しかし、CKD患者において骨由来のALPのアイソザイム(骨特異的ALP)の血清レベルと死亡率の間に有意な関連がないことから19、骨-ミネラル代謝との関連性に関する仮説に重大な疑問が投げかけられている。
本研究において、患者の11%はGGT値が正常でALP値が上昇しており、このサブグループの主な特徴は平均PTH値が高いことで、骨がALP上昇の起源となっているかもしれないと示唆した。 しかし、ALPとGGTが同時に高値であることは、主に心血管疾患などの併存疾患が多く、生化学的プロファイルがALP単独の患者よりもGGT単独の患者に近いサブグループの特徴であった。 したがって、CKDと高ALPの患者では、GGT高値の有無によって2つのリスクプロファイルを区別することができる。 GGTは、哺乳類の主な細胞内抗酸化物質の一つである細胞外の還元型グルタチオン(GSH)の加水分解を担う酵素で、前駆体アミノ酸がその後、細胞内の新しいGSH合成に使用されることを可能にします6。 したがって、GGTの増加は細胞内のGSH枯渇の表れであり、したがって、GGTは酸化ストレスのマーカーとみなすことができます6
血清GGTは一般集団における心代謝バイオマーカーであることが示されている。 様々な研究により、GGT値と心血管死亡率および全死亡率の間に有意な独立した関連があることが判明しています20-22。GGT値が高いと、冠動脈疾患および心不全の予後が悪くなることが示されています23,24。 また、動脈硬化性プラークの形成、その侵食、その後の破裂にGGTが関与している可能性も指摘されており25、生物学的見地から心血管疾患の罹患率や死亡率との関係を説明できる可能性がある。 Postorinoら9は、透析を受けている584人のCKD患者において、GGT高値と総死亡率および心血管系死亡率との間に強い独立した関連を観察している。 しかし、この研究では血清ALP濃度は測定されていない。
別の研究では、GGT高値はCKD患者の著しい内皮機能障害と関連しており、このマーカーの高値と心血管疾患のリスクとの関連性を示唆している10
全身性の酸化促進効果の可能性に加えて、他の仮説によってCKD患者のGGT値上昇と死亡率の関連性を説明できる可能性がある。 すなわち、GGTが高いということは、単にアルコール乱用や肝臓疾患、つまり死亡率の高さを正当化するような併存疾患を示している可能性がある。 しかし、この研究では、慢性アルコール中毒、慢性肝疾患または肝トロピックウイルス感染症の患者を除外しても、GGTは死亡率との有意な関連を維持しており、この関連における肝臓疾患の独占的な役割は除外されている。
それにもかかわらず、脂肪肝疾患と鬱血性肝臓疾患は、高いGGTレベルを引き起こす可能性がある二つの副臨床肝臓疾患です(26,27)。 脂肪性肝疾患はCKD患者に比較的よく見られる所見であり、肝合併症の発症よりも心血管危険因子と密接に関連している27。脂肪性肝疾患に関連する臨床および生化学的特徴は、我々の研究でGGTが高い患者のサブグループに見られたものと同様である。 しかし、この研究では、ほとんどの患者で脂肪肝疾患の診断が十分に検討されていなかったため、高いGGTが主にこの疾患によるものであると保証することはできない。
Congestive liver diseaseは、右側心不全または容積過多、重症肺高血圧、弁膜症など中心静脈圧を上昇させるあらゆる原因に起因する、受動的鬱血のスペクトラムを指す28。 血清 GGT または ALP の上昇は、左心室拡張機能障害を持つ CKD 患者に特徴的な生化学的異常であり、特に肺うっ血を伴う場合 29、これらの患者における死亡の危険因子として認識されています30
GGT 上昇は、ミクロソーム酵素の誘発を反映することもあります31。 本研究では,CKD患者に最もよく処方される薬剤はいずれもGGTまたはALPの高値と有意に関連していなかったが,市販薬(特に鎮痛剤)が本患者のGGT高値に影響を及ぼす可能性は否定できない
本研究は一連の限界を有している。 レトロスペクティブなデザインであるため,因果関係を確立することができなかった。 本研究は単一施設で実施され,研究対象となったコホートは,地域住民を代表するものではあるが,民族的には同質であった(白人)。 GGTとALPは時間的に変化する共変量として分析されていないため、GGTの一過性の上昇と時間的に維持される上昇とは予後的意義が異なる可能性がある。 しかし、本研究では、CKDのある段階での横断的解析で高GGTが検出されたことは、心血管の合併症および死亡率との関係から、非常に興味深い臨床表現型と関連していた。 最後に、骨特異的ALPおよびより具体的に骨リモデリングに関連する他のパラメータは測定されなかった。
結論として、GGT値の異常な上昇はCKD患者において共通の所見であり、合併症、特に心疾患により多く見られるもので、死亡率と独立して関連している。 血清GGTとALPの同時上昇は、死亡リスクを増大させる。 したがって、血清GGTとALPの複合測定は、CKD患者においてさらなる予測情報を提供する可能性がある。
利益相反
著者らは、利益相反がないことを宣言している。