Abstract
ヒ素は低濃度で増殖を刺激し、高濃度で細胞増殖を阻害する、生体プロセスに対する二相性効果を持っていることがわかった。 この二相性効果により、化学療法中に癌細胞を抑制するためには、ヒ素濃度を適切な閾値に維持する必要がある。 2139>
Key words
ヒ素、二相性、風土病、発がん、化学療法
Highlights
- ヒ素は低レベルで細胞増殖を促進する発がん物質であるが、ヒ素が高濃度で細胞増殖の抑制に寄与することを明らかにした。
- また、ヒ素は高濃度では細胞増殖を抑制する発がん抑制剤である。
- ヒ素の生物学的役割は、細胞増殖に対する二相性の効果を示す。
- アポトーシスは、ヒ素の二重特性に関連する潜在的なメカニズムかもしれない。
解説
ヒ素は自然界に広く分布し、しばしば酸素や硫黄と結合して化合物となる。 ヒ素は生物学的プロセスとも密接に関連している。 その病態生理的な特徴は以下のような側面に取り入れられている。 (a) 低用量ヒ素は細胞増殖と発癌を刺激する。 亜ヒ酸ナトリウムをヒトHepG2癌細胞または非腫瘍HHI-5肝細胞の処理に利用した場合、初期段階で細胞死の割合が負であり、これは低用量亜ヒ酸が細胞増殖を促進することを意味します(図1)。 ヒ素は、狭い範囲の低濃度で細胞生存率を高めることができた。 しかし、亜ヒ酸塩の濃度が臨界点に達するにつれて、細胞増殖が阻害され、細胞死が促進されるようになった。 この結果は、他の研究でも一貫して報告されている。 地質学的に異なる地域では、飲料水中のヒ素濃度が世界保健機構が推奨する基準値(0.01mg/L)を超えている。 ヒ素を含む水を飲む地域住民は、風土病のようなヒ素中毒に苦しんでいる。 風土病地域の各臓器(皮膚、肺、腎臓、膀胱、肝臓など)のがん発生率は、非風土病地域のそれよりも有意に高い。 ヒ素は国際がん研究機関(IARC)によりヒトに対する発がん性が指摘されており、(b)高濃度のヒ素は細胞増殖を抑制する。 臨床の現場では、化学療法の際にがん細胞を殺すためにヒ素化合物(As2O3、As2S2など)がよく使われる。 さらに、ヒ素は白血病や固形内臓新生物などのいくつかの癌の治療の第一選択薬となっている 。 また、ヒ素化合物は、最良の治療効果を得るために、他の薬剤と組み合わせて使用されることもある。 ヒ素は腫瘍の発生を誘導するだけでなく、がん細胞を死滅させる作用もあり、臨床治療の基本的な薬物である。 ヒ素は発がん性物質とがん抑制物質の2つの性質を持っています。 そこで、ヒ素の細胞増殖における双方向の役割を表す新しい概念「二相性効果」を提唱した
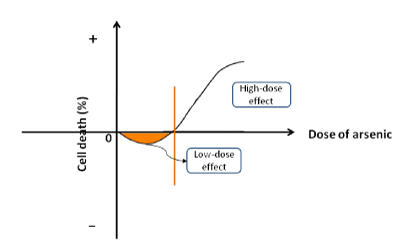
図1. 二相性効果の模式図。 ヒ素は低用量では細胞増殖を促進し、高濃度では細胞死を促進する
ヒ素の二面性を生み出す正確なメカニズムは何なのだろうか。 現在のところ、この問いに対する明確な答えはない。 しかし、現在得られているデータは、アポトーシスが重要な役割を担っていることを裏付けている。 アポトーシスは、組織構造を維持するために遺伝子が制御し、エネルギーを消費して自殺するプロセスである。 アポトーシスと抗アポトーシス能力のバランスは、細胞の生存率を決定するだけでなく、組織機能にも直接影響を与える。 これまで、アポトーシスは発癌と発癌抑制をつなぐ主要なメカニズムとして考えられてきた。 Inhibitor of apoptosis proteins (IAPs) は、細胞の生存を制御し、アポトーシスのカスケードをコントロールする強力な機能を持っています。 さらに、IAPs の発現は、NF-kappa B、FoxA2、C/EBP-beta などの複数の核内因子によって調節されていることが分かっています。 ヒ素とアポトーシスの関係については、慎重に調査する価値がある。 低用量のヒ素がアポトーシスを抑制し、細胞増殖を促進することを証明する証拠がもっと必要である。 発がんには、アポトーシスの抵抗性を克服する必要があることはよく知られている。 癌治療の中心戦略は、癌細胞のアポトーシスを誘導することである。 ヒ素は低濃度ではアポトーシスを抑制し、高濃度ではアポトーシスを促進するという仮説が妥当であろう。 また、IAPsとその制御ネットワークがヒ素の二面性を担っている可能性も推測されます。
ヒ素の二相性効果に関する研究は、がんの臨床治療において特別な意味を持ちます。 砒素化合物を他の薬と一緒に投与すると、砒素化合物の投与量を減らせることが多い。 砒素の二重性により、砒素化合物の薬効を評価しながら併用する必要がある。 このとき、がん細胞のアポトーシスを誘導するために、ヒ素の局所濃度を特定のレベルに維持する必要がある。 そうでなければ、砒素が癌細胞の増殖を促進する可能性がある。 治療効果がないどころか、逆の結果になってしまうのです。 したがって、特に他の薬剤との併用において、ヒ素の双方向の反応を考慮する必要があります。 ヒ素が腫瘍を抑制するための正確な閾値は? 閾値濃度に到達し、それを一定に保つために、どのように砒素を投与すればよいのか? 血中ヒ素濃度をモニタリングするための合理的なバイオマーカーは何か? 上記の疑問に対する答えは、今のところ出ていない。 また、ヒ素の生物学的特性は、毒性学に新たなトピックを提起している。 従来の毒性学の定義では、細胞を殺すこと、あるいは死亡率を上げることが毒性学的行動と考えられてきた。 しかし、がん細胞の増殖を促進させることも、体にとっては毒である。 つまり、低用量ヒ素の挙動も毒性学の一側面なのです。 逆毒性学とかリバース・トキシコロジーと定義できるかもしれません。 現在は、血中のヒ素濃度を推定し、治療効果を評価できる分子マーカーの研究を行っています。 白血病と固形癌では、必要とするヒ素医薬品の濃度が異なる可能性がある(4)。 様々な癌の治療におけるヒ素の真の役割を検証するためには、大きなサンプルでの臨床試験が必要である。 さらに、細胞の機能状態の定量化が現在の焦点である。
まとめると、ヒ素は細胞の成長に対して二相性の効果を持ち、低濃度では増殖、高濃度では抑制という形で現れる。 二相性のため、がん治療時にがん細胞を死滅させるためには、砒素の濃度の閾値を維持する必要がある。 そうでなければ、ヒ素はがん細胞の増殖を刺激し、逆効果を達成する可能性があります。 予備的研究により、抗アポトーシス分子IAPsファミリーとその制御ネットワークが、ヒ素の生物学において重要な役割を担っていることが明らかになった。
Declaration of interests
The authors have nothing to disclose.
Acknowledgements
This work was supported by “The National Natural Science Foundation of China”, project number 81773367.This work was supported by “The National Natural Science Foundation of China”.
- Yedjou C, Tchounwou P, Jenkins J, McMurray R (2010) Basic mechanisms of arsenic trioxide (ATO)-induced apoptosis in human leukemia (HL-60) cells.を参照のこと。 J Hematol Oncol 3: 28.
- Tseng CH, Chong CK, Tseng CP, Centeno JA (2007) Blackfoot disease in Taiwan: its link with inorganic arsenic exposure from drinking water.台湾におけるブラックフット病:飲料水からの無機ヒ素曝露との関連性. Ambio. 36: 82-84.
- Smith AH, Marshall G, Roh T, Ferreccio C, Liaw J, et al. (2018) Lung, bladder, and kidney cancer mortality after 40 years after arsenic exposure reduction.砒素曝露の減少による肺がん、膀胱がん、腎臓がんの死亡率。 Journal of the National Cancer Institute 110: 241-249.
- Gill H, Yim R, Lee HKK, Mak V, Lin SY, et al. (2018) 経口三酸化ヒ素ベースの復帰および維持レジメンで治療した再発急性前骨髄球性白血病の長期転帰。 15年間のプロスペクティブスタディ。 Cancer 124: 2316-2326.
- Varfolomeev E, Blankenship JW, Wayson SM, Fedorova AV, Kayagaki N, et al. (2007) IAP antagonists induce autoubiquitination of c-IAPs, NF-kappaB activation, and TNFalpha-dependent apoptosis.IAPはIAPの活性化、TNの活性化、およびNF-α依存性のアポトーシスを誘導する。 Cell 131: 669-681.
.