はじめに
60mL/min/1.73 m2未満の推定糸球体濾過量(eGFR)は、一般集団および高リスク集団において全死因および心血管死亡リスクの増大と関連していることがわかっています1,2。 eGFRが低下している人は、腎不全よりも心血管疾患が原因で死亡する可能性が高い1,3 eGFR
mL/min/1.73 m2の有病率は年齢とともに徐々に増加し、80歳以上では50%にもなる。
世界的な人口の高齢化を考えると、腎機能は今後ますます心血管疾患に影響を与えることが予測される。 さらに、65歳以上の高齢者における中程度の腎機能低下(eGFR 45〜59mL/min/1.73m2)の臨床的意義については議論が続いている。eGFR 6で死亡率が有意に高いことがわかった9が、eGFR 4でのみ、10-12 心血管系イベント(CVE)に関する結果はさらに一貫していない12,13。 このシナリオにより、年齢に応じた閾値、すなわち高齢者に軽度の減少が多く見られることから興味深いeGFR 8を提案する著者もいる。
結果の矛盾の一部は、クレアチニンの測定方法、eGFR推定式、または研究対象集団の特徴の違いによるものかもしれない。 さらに,冠動脈性心疾患(CHD)の発症率が低い地域の研究では,74歳以上の人が含まれていなかったり14,15,年齢層別の詳細な情報を提供していなかったりした。
この研究の目的は,CHD発症率が低い南ヨーロッパの集団において,60歳以上の人のeGFRと全死亡(ACM)と心疾患の発症率との年齢別の関連性を評価することであった18。
方法デザインおよび研究対象者
我々は、スペイン北東部のCosta de Ponent Primary Care Serviceの一部を構成する中央検査室のある40のプライマリーヘルスケアセンター(人口873 549人)に登録され、2010年1月1日から2011年12月31日にクレアチニン値を測定した1950年以前に生まれたすべての個人を含むレトロスペクティブ・コホート研究を実施した。 腎臓病ステージ5(eGFR<7330)の患者は除外した。データソース<9262>ベースラインの臨床データはプライマリケア電子カルテから取得した。ベースラインの心血管疾患については、2005年以降の心血管疾患による入院歴または血行再建術も考慮した。
腎機能評価
血清クレアチニン値は,同位体希釈質量分析標準法にトレーサブルな標準化ヤッホ補償速度法を用いて,単一の検査室で測定された。 eGFRは、慢性腎臓病疫学共同研究(CKD-EPI)のクレアチニン方程式19を用い、人種による補正は行わずに推定した。
eGFRをKDIGO 2012 Clinical Practice Guidelineに従って、15〜29、30〜44、45〜59、60〜89、90〜119の臨床カテゴリーに分類した20
共分散
年齢、性別、喫煙状況(喫煙なし、喫煙あり、以前喫煙あり)、高コレステロール血症(血清コレステロール>6.4 mmol/Lまたはスタチン治療),心血管危険因子(高血圧,糖尿病),心血管疾患診断歴(CHD,脳血管疾患,末梢動脈疾患,心不全)。
結果
死亡日のデータは,原因を特定せずに病院または行政登録から得た。CVEに関するすべてのエンドポイントは,スペイン北東部のCataloniaのすべての病院のデータを含む入院記録から入手した。 主要エンドポイントはACM,副次的エンドポイントはCHD(急性心筋梗塞,不安定狭心症,狭心症)および脳卒中(非出血性脳卒中,一過性脳虚血発作)を含むあらゆるCVEとした。 ハードCVE(急性心筋梗塞,非出血性脳卒中),CHD,脳卒中を別々に解析した。
参加者は指標日の1か月後から死亡,他の医療機関への移動,研究終了(2013年12月31日)まで追跡した。
研究計画書は地元の臨床研究倫理委員会(IDIAP Jordi Gol P11/43)から承認された。 研究倫理委員会が必要ないと判断したため、参加者からインフォームドコンセントを求めなかった。
統計解析
すべての変数を年齢群(60~74歳、75歳以上)別に解析した。 連続変数は平均値±標準偏差または中央値(非正規分布)として、カテゴリー変数は絶対頻度および相対頻度として記述される。 正規分布と非正規分布の連続変数の群間差は、それぞれStudent t検定とKruskall-Wallis検定で評価した。 カテゴリー変数にはカイ二乗検定を用い、eGFRカテゴリー間の線形傾向も検定した。 発症イベントは3年後のKaplan-Meier曲線で算出した。
各群内で、Cox比例ハザードモデルを用いて、連続変数としてのeGFRとACMのリスクとの関連についてハザード比(HR)を推定した。 Coxモデルにおいて,自由度4の線形スプラインを用いてeGFRの効果の線形性を検証した。 eGFR 120以上の個体の数が少なく(n = 14)、このポイント以上の推定値の精度が低下するため、これらの個体はさらなる分析から除外された。 また、Cox比例ハザードモデルを用いて、KDIGO 2012臨床カットオフポイントによって定義されたカテゴリー別eGFRとACMとの関連を検証した。 すべてのCVEについて、推定値に対する偶発的死亡の影響の可能性を考慮し、競合リスク生存法(Fine-Gray比例下位分布ハザード回帰)を用いて分析を行った。
経時的ハザードの比例性の仮定は、曝露変数(eGFR)に対してグラフ(シェーンフェルト残差)で評価された。
連続およびカテゴリー別eGFRのCox比例ハザードモデルは、年齢、性別、喫煙状況、高コレステロール血症、糖尿病、高血圧、心血管疾患(虚血性心疾患、脳血管、末梢動脈疾患、心不全)既往で調整された。 モデルはさらに,データがある治療法(スタチン系薬,レニン-アンジオテンシン系薬)について調整した。
CKD-EPIは幅広い年齢層(18~97歳)のサンプルを使って開発されたが,80歳以上の人はほとんどいなかった。 そこで、70歳以上のコミュニティベースのサンプルで特別に開発されたBerlin Initiative Study-1 Equation21を用いて感度分析を行った。
最終モデルはHosmer-Lemeshow検定と受信者動作特性曲線下面積を用いて検証された。 いずれの方法でも,打ち切りや競合事象を考慮した。
すべての統計解析はR version 3.2.3(R: a language and environment for statistical computing R Foundation for Statistical Computing, Vienna, Austria)を用いて行い,両側検定とP
RESULTS
138 040人の対象者のうち(73.この地域の60歳以上の全人口の1%),6797人が在宅療養中,509人がステージ5の腎臓病,501人がフォローアップを受けていたため除外された(補足資料の図1)。 年齢(P = 0.374)や性別(女性56.1%、55.1%、P
サンプル全体の年齢中央値は70歳で、参加者の56.1%が女性であった。 eGFR中央値は82.42 ;参加者の13.5%がeGFR表1),eGFR P
P mL/min/1.73 m2カテゴリの有病率…
試験母集団のベースライン特性。 年齢と推定糸球体濾過量カテゴリーによる層別化
| ALL | 90-119 mL | 60-89 mL | 45-59 mL | 30-44 mL | 15-29 mL | P全体 | P傾向 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 60〜74歳代olds | |||||||||||||||||||||
| Patients | 88 356 | 34 546 | 48 354 | 4257 | 986 | 213 | |||||||||||||||
| Age.Lights, y | 66.0 | 64.0 | 68.0 | 70.0 | 70.0 | 70.0 | |||||||||||||||
| 性別、女性 | 47 549 (53.8) | 19 927 (57.7) | 24 863 (51.4) | 2173 (51.0) | 489 (49.6) | 97 (45.5) | |||||||||||||||
| 喫煙 | |||||||||||||||||||||
| 吸わない | 54 452(61.6) | 21 525 (62.3) | 29 713 (61.4) | 2572 (60.4) | 532 (54.0) | 110 (51.6) | |||||||||||||||
| アクティブスモーカー | 10 458(11.8) | 4714(13.6) | 5189(10.7) | 422(9.91) | 107(10.9) | 26(12.6) | 107(10.8) | 107(11.8) | 114(10.8) | 104(11.82) | |||||||||||
| 元喫煙者 | 23 446(26.5) | 8307(24.0) | 13 452(27.8) | 1263(29.7) | 347(35.2) | 77(36.6) | 173(35.2)。2) | ||||||||||||||
| 高コレステロール血症 | 44 990(50.9) | 16 710(48.4) | 24 994(51.7) | 2529 (59.4) | 613(62.2) | 144(67.9) | |||||||||||||||
| 糖尿病 | 19 998(22.6) | 7950(23.0) | 10 226(21.1) | 1296(30.4) | 431(43.3) | 2878 | 431(41.1) 2878<678>2878<6751>2878<6751>199(41.27) | 95 (44.6) | 高血圧症 | 49 781 (56.0) | 430 (37.03) | 17 167 (49.7) | 28 226 (58.4) | 3346 (78.6) | 857 (86.9) | 185 (86.9) | 2878 | ||||
| 冠動脈疾患 | 6200 (7.02) | 1825 (5.28) | 3629 (7.51) | 527 (12.0) | 2829 (7.0) | 287 (8.0) | 2829 (9.9) | 287 (8.9) <2878> | 6752>280 (8.94) | 173(17.5) | 46(21.6) | 2878 | |||||||||
| 脳血管障害 | 4231(4.0.79) | 1286 (3.72) | 2428 (5.02) | 361 (8.48) | 120(12.2) | 36(16.9) | |||||||||||||||
| パッド | 1686(1.91) | 510(1.48) | 906(1.87) | 171(4.0) | 178(3.0) | 76(7.71) | 23(10.8) | 1891(2.14) | 453(1.31) | 1011(2.09) | 259(6.08) | 132 (13.4) | 36 (16.9) | ||||||||
| CVD*の既往 | 12 012 (13.6) | 3628 (10.9) | 132 (13.4) | 36 (16.8) | 232 (14.9) | 232 (14.9) | 132 (14.9) | 132 (14.9) | 6854 (14.2) | 1080 (25.4) | 361 (36.6) | 89 (41.8) | 39 392 (44.1) | 14 307 (41.4) | 22 025 (45.5) | 2341 (55.0) | 581 (58.9) | 138 (64.8) | |||
| RASD | 40 619(46.0) | 13 468(39.0.0) | 23 203 (48.0) | 3009 (70.7) | 787 (79.8) | 152 (71.4) | |||||||||||||||
| ≧ 75歳代olds | |||||||||||||||||||||
| Patients | 41 877 | 1768 | 27 971 | 8005 | 3449 | 684 | |||||||||||||||
| Age, y | 79.0 | 77.0 | 79.0 | 81.0 | 82.0 | 83.0 | |||||||||||||||
| 性別、女性 | 25 482(60.6歳。8) | 1004 (56.8) | 16 706 (59.7) | 5056 (63.2) | 2273 (65.9) | 443 (64.8) | |||||||||||||||
| 喫煙 | |||||||||||||||||||||
| 喫煙しない | 30 251(72.2) | 1202 (68.0) | 20 086 (71.8) | 5836 (72.9) | 2616 (75.8) | 511 (74.7) | |||||||||||||||
| アクティブスモーカー | 1866(4.0) | 1872 (4.0) | 3872 (4.0) | 2863 (4.0) | 2863 (4.0) | 1872 (4.046) | 126 (7.13) | 1278 (4.57) | 325 (4.06) | 113 (3.28) | 24 (3.51) | ||||||||||
| 元喫煙者 | 9760 (23.3) | 440 (24.0) | 1278 (3.06) | 440 (3.06) | 325 (3.099) | 6607(23.6) | 1844(23.0) | 720(20.9) | 149(21.8) | ||||||||||||
| 高コレステロール血症 | 20 705(49.4) | 798(45.9) | 148(21.4) | 13 621(48.7) | 4115(51.4) | 1823(52.9) | 348(50.9) | ||||||||||||||
| 糖尿病 | 11 889(28.9) | 586 (33.1) | 7587 (27.1) | 2309 (28.8) | 1161 (33.7) | 246 (36.0) | |||||||||||||||
| 高血圧症 | 30 563 (73.0) | 30 563 (33.0) | 1078 (61.0) | 19 310 (69.0) | 6562 (82.0) | 3018 (87.5) | 595 (87.0) | 2878 | |||||||||||||
| 冠状動脈性心臓病 | 5074(12.1) | 146 (8.26) | 3037 (10.9) | 1150 (14.4) | 603 (17.5) | 138 (20.2) | |||||||||||||||
| 脳血管障害 | 4567(10.9) | 171(9.67) | 2781(9.94) | 1034(12.9) | 486(14.6) 1034(13.6) | 1034(13.6) | 95 (13.9) | パッド | 2904 (6.0) | 2904 (6.93) | 49 (2.77) | 807 (2.89) | 327 (4.08) | 185 (5.36) | 49 (7.16) | ||||||
| 心不全 | 3275(7.82) | 90(5.09) | 1648(5.89) | 822(10.3) | 551(16.0) | 164(24.9) | 822(10.30) | ||||||||||||||
| CVDの既往* | 11 691(27.9) | 389(22.0) | 6900(24.7) | 2657(33.2) | 1419(41.0) | 389(22.2) | 389(22.0) | 390(22.0) 67521) | 326 (47.7) | 2878 | |||||||||||
| Statins | 19029 (45.0) | 1992 (45.04) | 747 (42.3) | 12 460 (44.5) | 3789 (47.3) | 1698 (49.2) | 335 (49.0) | ||||||||||||||
| RASD | 25 247 (60.3) | 824 (46.6) | 15 632 (55.9) | 5649 (70.6) | 2644 (76.7) | 498(72.8) | |||||||||||||||
CVD, cardiovascular disease; PAD, peripheral artery disease; RASD, renin-angiotensin system drugs.の略。
特に指定のない限り、データはNo.(%)または中央値で表す。 .
脳血管、PAD、および心不全を含む。
CoxモデルにおけるeGFRの関連を検証するため,両群ともeGFR = 80を基準(CKD-Prognostic Consortiumのメタ解析でも使用)6としたのは,これが集団におけるeGFR中央値であり,60~90は最も多くの人が含まれ臨床的に重要であることから,この区分にした。
追跡期間中央値は38.2ヶ月であった。 死亡6474例,CHDイベント1573例,脳血管イベント2236例が記録された。 すべての転帰は高齢群で有意に多かったが(P表2),脳卒中イベントはeGFRが15~29の人でやや少なかった
3年後のカプラン・マイヤー推定による年齢と推定糸球体ろ過率で層別した試験対象者の転帰. Log Rank Test(全体的なP)。 線形トレンド Wald検定(Pトレンド)
| すべて | 90-119 mL | 60-> | すべて89 mL | 45-59 mL | 30-44 mL | 15-29 mL | P全体 | P傾向 | ||
|---|---|---|---|---|---|---|---|---|---|---|
| 60-… 74歳以下 | ||||||||||
| 患者 | 88 356 | 34 546 | 48 354 | 4257 | 986 | 213 | ||||
| All-Japan原因による死亡率 % | 2.08 | 1.79 | 1.93 | 3.91 | 8.20 | 18.6 | ||||
| 任意のCVE、% | 2.09 | 1.51 | 2.26 | 3.78 | 5.60 | 7.8 | 7.94 | |||
| Hard CVE, % | 1.46 | 1.06 | 1.56 | 2.76 | 4.05 | 4.0.78 | ||||
| chd, % | 0.96 | 0.74 | 1.02 | 1.38 | 2.83 | 4.0 | 2倍 3.80 | |||
| ストローク、% | 1.16 | 0.79 | 1.27 | 2.44 | 2.88 | 3.0 | 3ヶ月 | 2ヶ月17 | ||
| ≧75-year-jpolds | ||||||||||
| Patients | 41 877 | 1768 | 27 971 | 8005 | 3449 | 684 | ||||
| All-cause deathality.を参照。 % | 9.88 | 10.5 | 7.89 | 11.7 | 17.8 | 28.5 | ||||
| 任意のCVE、% | 4.34 | 3.31 | 3.90 | 4.80 | 6.0 | 3.0 | 6.0%未満 | 3.077 | 8.35 | |
| Hard CVE, % | 3.24 | 2.22 | 2.90 | 3.75 | 4.90 | 5.70 | 4.80、 5.93 | |||
| chd, % | 1.69 | 1.30 | 1.48 | 1.92.77 | 2.86 | 5.41 | ||||
| ストローク、% | 2.77 | 2.74 | 2.13 | 2.49 | 3.17 | 4.00 | 3.34 | |||
CHD、冠動脈疾患;CVE、心血管イベント。
ACMと任意のCVEに関する両モデルでは,曝露変数(eGFR:データ示さず)に対して経時的なハザードの比例性が認められた。
eGFRとACMリスクの関連は両年齢群でU型パターンを示したが,高齢群ではより減衰していた(図1)。 一方,あらゆるCVEに対するHRは線形分布を示し,eGFRが高い方から低い方へ徐々にリスクが上昇した。このパターンは両年齢群で同様であり,他の心血管エンドポイントについても同様であった(補足資料の図2)。 すべてのアウトカムにおいて,75歳以上のHRはeGFR=60以下(図1),ACMではeGFR=55からeGFR=60の間,すべてのCVEではeGFR=50で有意となった。
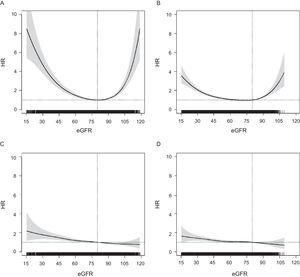
年齢別eGFR(連続変数)とACMのリスクとの関連 P値
eGFRの臨床カテゴリーでみると、いずれの年齢層でも60~89以下のeGFRカテゴリーでACMおよび任意のCVEリスクが徐々に上昇した(図2)。 ACMのリスク上昇は60~74歳では75歳以上よりもはるかに高く急であったが,CVEについては両年齢層でほぼ同様であり,75歳以上ではeGFR=45~59のカテゴリーで境界線上の有意差となった。 スタチンやレニン-アンジオテンシン系薬剤による治療をさらに調整しても、HRの値に変化はなかった(データは示さず)。 また,eGFRが90~119の人は,高齢者群では死亡リスクが高く,若年者群のみではあらゆるCVEのリスクが有意に低いことがわかった。 CHD,脳卒中,ハードCVEに関するモデルの結果は,any CVEに関するモデルと同様であった(補足資料の図3)。 eGFRの算出にBerlin Initiative Study-1 Equationを用いた感度解析でも差はなかった(補足資料の図4)。
最終モデルは、良好なキャリブレーションと識別性を示した(補足資料図5および補足資料の表)。
DISCUSSION
心血管系リスクの低い国の60歳以上の集団では,60~74歳でも75歳以上でも,ACMとあらゆるCVEリスクは他のリスク因子や心血管系疾患とは独立して,eGFRの低下とともに徐々に増加した。 しかし,高齢者におけるHRはeGFRが低い(eGFR=60以下)ときに有意となり,eGFR=45~59のカテゴリーでは,どのCVEでも境界線上で有意であった。 eGFRに関連した死亡リスクの増加は,60~74歳では75歳以上よりも高かったが,CVEリスクについては同程度であった。 さらに,eGFRと死亡率の関連はU字型パターンを示し,90から119のカテゴリーで死亡率が上昇し,75歳以上で高かった。
この研究集団では,年齢カテゴリーによってよく分化した2グループが定義され,そこではeGFRを持つ個人の数は
予想通り,心血管アウトカム発生率は非地中海諸国の高齢者の報告より低かったが,我々の地域では若年者より高かった22。 発症した脳血管イベントは冠動脈イベントよりも多く、これは高齢者の研究でも報告されている22
これまでの報告と同様に、両年齢層で連続変数としてのeGFRとACMの間にU字型の関係が観察された。 驚くべきことに,eGFR=90~119のカテゴリーで観察されたACMの過剰リスクは,高齢者においてより高かった。 このリスクの増加は、死亡に至る他の病気による二次的な筋肉の消耗による交絡を反映している可能性がある。これは、クレアチニンベースの推定式の既知の限界である19。 これはいくつかの過去の報告と一致している13,23,25が、他の報告では心血管死亡率6,12と心血管疾患についてはあまり顕著なU字型関係ではない15。したがって、クレアチニンベースの推定式の限界の影響をあまり受けないように見えるCVE発生は、心血管リスクに対するeGFRの予後効果についてより信頼できる指標になるかもしれない
高齢者における中程度のeGFR低下には臨床的意義について矛盾する根拠が存在する。 現在推奨されている式を用いてeGFR関連リスクを評価し、年齢区分で結果を比較した研究はほとんどない。
ACMについては、CKD-PCメタアナリシス6がeGFR 9で有意な調整後HRを報告し、60~69歳、70~79歳、80歳以上でも同様の所見を示している。 一方、80歳以上の高齢者では、Cardiovascular Health Study12でeGFR≦43で有意なHRが認められたのみであった。 南ヨーロッパでは、65歳以上のeGFR16と60〜74歳のeGFR15で死亡率が増加することが分かっている。35〜74歳で心血管疾患を持たない場合、eGFRはACMの境界有意予測因子であり14、eGFR=45〜59で有意にリスクが高くなることが分かっている。
心血管系死亡率については,65~74歳および75歳以上の群におけるHRはeGFRで有意であった6が,クレアチニンベースの式を用いたCardiovascular Health Studyでは,80歳代の患者では同様の関連を見いだせなかった12。 南欧では,eGFR16で心血管死亡,eGFR15とeGFR23で心血管疾患の発症リスクが上昇することが報告されている
本研究において,60~74歳と75歳以上の両群で,ACMとCVEいずれかのHRは,eGFR60~89以下の減少とともに着実に上昇した。 これまでの報告と同様に,HR値およびリスク勾配は高齢者群で低く,連続eGFRの分析では,HRはeGFR 6
で有意となった。現在のほとんどの国際ガイドラインでは,eGFR 18,20,26 のすべての個人を考慮している。本研究では,75歳以上の参加者の20%はeGFR = 45~59,そのうち74%はeGFR 50以上だった。 したがって、45~59歳の高齢者すべてを高リスクとみなすと、「有意な付加リスクなし」の多くの人が、心血管危険因子のより積極的な目標設定と治療にさらされることになる。 さらに、60~74歳におけるCHDイベントの相対リスクの11%増は、CHDの発生率が低い国においてeGFR=45~59のカテゴリーをCHDリスク相当とみなすには十分ではないかもしれない
長所と限界
我々の研究の大きな長所は、対象者が非常に多いことと、代表的な人口ベースのサンプルから抽出したことで、一次医療において管理している患者の真の状況を反映しているという事実である。 60歳未満のほぼ全員(93%)がCatalan Primary Health Care Systemに通院しており、高い割合でクレアチニン測定を行っていた。おそらくこれは、この集団において基本的な予防健康診断やその他の流行する慢性疾患のルーチンフォローアップの一部であるためであろう。 さらに,クレアチニン測定アッセイは,推奨されるように同位体希釈質量分析法を用いた基準法に校正され,中央研究所で行われたため,さらに変動が少なくなった。
この研究の結果は,さまざまな限界を考慮して解釈することも必要である。 第一に,eGFR値およびカテゴリーは,予後に関する疫学研究で通常行われる,1回の測定に基づいて割り当てられた。 回帰希釈バイアスのため,これはeGFRと目的のアウトカムとの真の関連を過小評価する可能性がある。 しかし、外来検査データベースからの低値のeGFR測定値は、高齢者では比較的安定していることが示されている27。第二に、新生物、腎毒性薬剤、感染症、臨床的併発事象など腎機能を修飾しうるいくつかの因子の影響を考慮していないことである。 このような影響は、対象患者数が多いため、最小限にとどめることができると考えている。 第三に、我々はCKD-EPI式を用いて血清クレアチニン測定値からeGFRを推定したが、eGFRが高いほど影響が大きいクレアチニンベースの推定式の限界は受け入れている。19 特にこの年齢層では白人の民族性が我々の集団では支配的だが、人種については補正しなかった。 さらに、高齢者におけるCKD-EPIの診断・予後判定については議論があり、新しい計算式が開発されているが、CKD-EPIは現在推奨されている手法であり20、プライマリケアで広く使用されている。 さらに、Berlin Initiative Study-1 Equationに従って計算されたeGFRを用いた感度分析でも、同様の結果が得られている。 第四に、尿中アルブミンの影響を評価することができなかった。eGFRとアルブミンはともにCKDの評価に推奨されているが、それぞれ独立した予後への影響を示しており1、今回示した結果は、高齢者におけるeGFRの心血管リスクへの影響とカットオフ値について貴重な情報を追加するものである。 第五に、データは電子カルテから得られたものであり、誤検出を排除することはできない。 プライマリーヘルスケアにおける心血管疾患のデータは、他の疾患よりも質が高く、我々の集団における疫学研究に適していることが示されている28,29。病院外での致命的なCVEは含まれていない。 特に、入院していない進行した腎臓病患者における脳卒中イベントが十分に検出されていない可能性があり、これらはより重症で併存疾患が多く、死亡に至った可能性が高い。 eGFRが45から80の患者における脳卒中イベントのパターンは他のCVEと同様であった。我々は軽度のCKDに焦点を当てたので、このことは我々の結果を無効にはしないと考えている。 第6に,モデルは心血管危険因子と疾患,スタチン治療とレニン-アンジオテンシン系薬剤で調整したが,CVE発生に影響する可能性のある他の併存疾患,薬剤,社会経済的要因では調整していない。 最後に、我々は死因に関するデータを入手できなかった。 全死因には、腎機能とは関係なく、他の加齢に伴う疾患、糖尿病、心不全など、感染症や転倒など、いくつかの病因が含まれている。 30
結論
結論として,CHD発症率の低い国に住む60歳以上の高齢者において,60~74歳および75歳以上の両群でeGFRの低下とともにACMおよびあらゆるCVEリスクの上昇が観察された。 しかし,HRはeGFR<7330>で有意となった。<9262>このプロジェクトは,経済・競争力省カルロス3世保健研究所(スペイン)の研究助成を受けた。 このプログラムは、技術・科学・イノベーション研究国家計画2008-2011の一部を構成し、欧州連合ERDF(欧州地域開発基金)資金(PI11/02220)との共同出資によるものです。 カルロス3世健康研究所を通じて経済競争力省(Red RedIAPP RD12/0007)、AGAUR(大学・研究助成金管理A)(2014 SGR 1225)(2014 SGR 902)を通じてERDF資金Generalitat de Catalunyaが提供されています。 M. GrauはMiguel Servet Grant (Carlos III Institute of Health, Ministry of Economy and Competitiveness, Spain) (PI12/03287) の助成を受けた。<7330>CONFLICTS OF INTEREST<9262>L.M.GrauはMiguel Servet Grant (スペイン経済競争省)の資金を受けた。 Pascual-BenitoはAlter社から講演料を受け取った。 また、A. Martínez-CastelaoはBoëhringer-Ingelheimからコンサルティングフィー/有料諮問委員会、およびBoëhringer-Ingelheimから講演料を受け取っています。
- –
eGFRが
mL/min/1.73m2の人は、心血管リスクが高いです。 eGFRの減少の有病率は年齢とともに徐々に増加し、80歳以上の人では50%にもなる。 高齢者ではより軽度な減少(eGFR 45〜59mL/min/1.73m2)が頻繁に見られるが、その臨床的意義については現在も議論が続いている。 さらに、CHDの発生率が低い地域での研究では、74歳以上の人は含まれていなかったり、年齢層別の詳細な情報は提供されていなかった。
- –
心血管系リスクの低い国に住む60歳以上の集団において、ACMおよびあらゆるCVEリスクは、60~74歳および75歳以上において、他のリスク因子や心血管系疾患とは独立して、eGFRの低下とともに徐々に増加しました。 しかし,高齢者におけるHRは,eGFRが60未満で有意となった。 eGFRに関連した死亡リスクの上昇は60歳から74歳の群では75歳以上の群よりも高かったが,CVEリスクについては同様であった