問題の定義
副甲状腺ホルモン(PTH)が無制限に過剰分泌されてカルシウムの恒常性が異常となるのが、原発性副甲状腺機能亢進症である。
頻度
一次性副甲状腺機能亢進症は女性に多く、その発生率は女性で10万人年あたり66人、男性で10万人年あたり25人である。 南カリフォルニアのKaiser Permanenteの350万人の登録者を対象とした大規模な研究では,発症率は時間の経過とともに変動していたが,大幅に減少することは見られなかった。 それどころか、原発性副甲状腺機能亢進症の有病率はこの集団で大幅に増加した。
病因
約85%の症例において、原発性副甲状腺機能亢進症は単一の腺腫によって引き起こされる。 15%の症例では、複数の腺腫または過形成のいずれかが関与している。 まれに、原発性副甲状腺機能亢進症は副甲状腺がんが原因である。 ほとんどの症例では、腺腫または過形成の病因はまだ不明である。 家族性の場合は、多発性内分泌腫瘍症候群(MEN 1またはMEN 2a)、副甲状腺機能亢進症(HPT-JT)症候群、家族性孤立性副甲状腺機能亢進症(FIHPT)のいずれかとして発症することがあります。 家族性低カルシウム血症や新生児重症副甲状腺機能亢進症もこの範疇に入る。 MEN1の分子遺伝学的基盤は、染色体バンド11q13に位置するMEN1遺伝子の不活性化変異である。 MEN 2a は、第 10 染色体上の Ret プロトオンコジーンの生殖細胞変異によって引き起こされる。
病態生理
腺腫による原発性副甲状腺機能亢進症では、細胞外カルシウムによる副甲状腺ホルモン産生への正常フィードバックが失われ、設定値が変化しているようである。 しかし、副甲状腺過形成による原発性副甲状腺機能亢進症ではそのようなことはない。 4121>
過剰な副甲状腺ホルモンによる慢性的な骨からのカルシウムの過剰吸収は、骨減少を引き起こすことがあります。 重症の場合は、遠位指骨の骨膜下吸収、遠位鎖骨の先細り、頭蓋骨の塩辛い外観、長骨の褐色腫瘍を特徴とする骨粗鬆症となることがある。 これは現在ではあまり見られない。 さらに、慢性的に尿中へのカルシウム排泄が増加するため、腎結石ができやすくなる。
副甲状腺機能亢進症のその他の症状は、高カルシウム血症そのものによるもので、副甲状腺機能亢進症に特化したものでない。 これらは、筋力低下、疲労、体積減少、吐き気と嘔吐、そして重症の場合は昏睡と死亡である。 精神神経症状は特によくみられ、うつ病、錯乱、または微妙な欠陥が含まれることがあるが、これらはしばしば特徴が乏しく、患者が気づかないこともある(または老化に起因することもある)。 カルシウムの増加は胃酸分泌を増加させ、副甲状腺機能亢進症の患者は消化性潰瘍疾患の有病率が高い可能性がある。 Ejlsmark-Svenssonらによる前向きコホート研究では、原発性副甲状腺機能亢進症患者において、QOLアンケート得点が、軽度の高カルシウム血症に比べ中等度-重度の高カルシウム血症に関連して有意に低かったことが報告されている。 しかし、QOLは、骨粗鬆症、腎石灰化、腎機能障害などの原発性副甲状腺機能亢進症の臓器関連症状の有無とは関連がないようであった。 このことは、高カルシウム血症がQOLを損なう主な要因であることを示唆している。
Clinical presentation
History
Primary hyperparathyroidismの臨床症候群は “bones, stone, abdominal groans, and psychic moans” と容易に記憶されるであろう。 1970年代初頭に血中カルシウムのルーチン測定が導入されると、原発性副甲状腺機能亢進症の最も一般的な臨床症状は、重度の骨疾患や腎結石から無症状の高カルシウム血症へと変化した。
原発性副甲状腺機能亢進症の骨格症状には、主に選択的な皮質骨の減少が含まれる。 骨・関節痛、偽痛風、軟骨石灰化症も報告されている。 副甲状腺機能亢進症の初期の臨床では、一部の患者は破骨細胞性骨吸収の増加を特徴とするosteitis fibrosa cysticaとして知られる特異なタイプの骨疾患を発症していた。 X線写真では、指骨の骨膜下吸収や塩・胡椒頭蓋と呼ばれる所見などが見られる。
腎症状としては、多尿、腎結石、高カルシウム尿症、まれに腎石灰化症がある。
消化器症状としては、漠然とした腹痛、食欲不振、吐き気、嘔吐、便秘、消化性潰瘍疾患、急性すい臓炎がある。
神経筋および心理学的症状としては、疲労、筋力低下、抑うつ、集中力の欠如、記憶障害、または微妙な欠陥が挙げられるが、これらはしばしば特徴が乏しく、患者が気づかないことがある。 これらの症状は加齢に起因することが多く、慢性疲労症候群や線維筋痛症と診断される患者もいる。
心血管系の症状としては、高血圧、徐脈、QT間隔の短縮、左心室肥大が挙げられる。
身体所見
身体検査所見は通常、非依存的である。 検査では筋力低下や抑うつがみられることがある。 まれに副甲状腺癌の可能性があるが、副甲状腺機能亢進症では触知可能な頸部腫瘤は通常期待できない。 以前に診断されていない甲状腺結節が、触知可能な結節の原因であることのほうがはるかに多いのである。
診断上の注意
副甲状腺ホルモン値の上昇を伴う高カルシウム血症の原因は、ほとんどない。 これらには、家族性良性(低カルシウム)高カルシウム血症(FHH)(関連疾患の項を参照)、リチウム誘発性高カルシウム血症、および三次性副甲状腺機能亢進症が含まれる。 副甲状腺機能亢進症患者の少数(すなわち、10~15%)は、副甲状腺ホルモン値が基準範囲内にあるが、血清カルシウム濃度が高い場合には不適切に高くなる。 患者のサブセットは、カルシウム値が正常で副甲状腺ホルモンが上昇している、いわゆる正常カルシウム血症型副甲状腺機能亢進症である。 しかしながら、この診断を考慮する際には、二次性副甲状腺機能亢進症の原因となりうるもの(例、カルシウム摂取量の低下、胃腸障害、腎不全、ビタミンD欠乏症、腎由来の高カルシウム尿症)はすべて除外する必要がある。 同定可能な二次的原因がなくカルシウム値が正常で副甲状腺ホルモン値が上昇している患者は、高カルシウム血症への進行を監視すべきである。
二次および三次副甲状腺機能亢進症は、一般に臨床的背景に基づき診断される。 がんによる高カルシウム血症は、副甲状腺ホルモン値が低いが、副甲状腺ホルモン関連ペプチド値が高い可能性がある。
ワークアップ
臨床検査
血清総カルシウム値とアルブミン値またはイオン化カルシウム値が測定されるべきである。 高カルシウム血症は、診断的検査を実施する前に2回以上記録されるべきである。
無傷の副甲状腺ホルモン値の検査は、診断の中核となるものである。 無傷の副甲状腺ホルモン値が高く、イオン化血清カルシウム値が高い場合は、原発性副甲状腺機能亢進症の診断となる。 FHHを除外するためには、24時間尿によるカルシウム測定が必要である。
より古い測定法では、副甲状腺ホルモンのC末端または中間領域のような副甲状腺ホルモン分子の断片を測定していた。 このような第一世代の測定法は、臨床の場では時代遅れと考えられています。 第二世代の副甲状腺ホルモン測定法は、世界的にインタクト副甲状腺ホルモン測定法と呼ばれ、第三世代の副甲状腺ホルモン測定法はホールまたはバイオインタクト副甲状腺ホルモン測定法と呼ばれ、2種類の異なる副甲状腺ホルモンのセグメントに対する抗体を使用します。 第2世代および第3世代の副甲状腺ホルモン測定法は、第1世代の測定法よりもはるかに臨床的に満足できるデータを出しているが、いくつかの研究で評価が続けられているいくつかの限界がある。
原発性副甲状腺機能亢進症のその他の検査所見には、軽度の高クロレミア性アシドーシス、低リン酸血症、軽度から中等度の尿中カルシウム排泄率の上昇がある。
ビタミンD値については、原発性副甲状腺機能亢進症を評価するにあたって測定する必要がある。 ビタミンD欠乏症(25-ヒドロキシビタミンD値が1ml当たり20ng未満)は二次性副甲状腺機能亢進症の原因となり、ビタミンD欠乏症の補充は副甲状腺ホルモン値を低下させるのに有効である。 ほとんどの研究で、血清25-ヒドロキシビタミンD貯蔵量を少なくとも37.5ng/mlに増やすことは、腎機能が正常な人の副甲状腺ホルモン抑制と二次性副甲状腺機能亢進症の予防に十分である(いくつかの研究では、貯蔵量を50ng/mlまで増やすことを示唆しているが)。
画像検査
画像検査は、原発性副甲状腺機能亢進症の診断(これは検査データに基づく)や外科療法を行うかどうかの判断(これは臨床基準に基づく)に使用されることはない。 画像検査は、外科的治療が決定された後に外科医を指導するために使用される。 副甲状腺の限定的な探査を試みる場合、局在的な検査が必要である。 原発性副甲状腺機能亢進症患者の初期評価における画像検査のその他の使用法は議論の余地がある(下記の外科的治療の選択を参照)
多くの患者に対して、関与した腺をすべて切除する副甲状腺完全探査を推奨することに変わりはない。 多くの外科医は、この外科的治療が選択された場合、画像検査は必要ないと考えている。
頸部の超音波検査は、異常な副甲状腺の位置を特定するための安全で広く使用されている技術である。 高い精度が得られるが、術者に依存し、報告されている精度は文献によって大きく異なる。 頸部超音波検査の利点のひとつは、初診時に臨床医が迅速に実施できることである。 臨床医が行う超音波検査の研究では、従来の放射線科の精度と比較して、75-80%付近の精度を示しています。 超音波検査は、核医学スキャンと同様に、多腺疾患の検出には信頼性がありません。
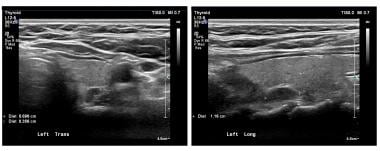 を示している。 ノギスマークが腺腫を表している。 腺腫は一般に均質で低エコーである。
を示している。 ノギスマークが腺腫を表している。 腺腫は一般に均質で低エコーである。 放射性同位元素で標識したセスタミビを用いた核医学スキャンもまた、広く用いられている技術である。 セスタミビは心臓の画像診断によく使われるが、副甲状腺腫に集積することが偶然に発見された。 この放射性核種は甲状腺と副甲状腺の組織に濃縮されるが、通常1時間以内に正常な甲状腺組織から洗い流される。 しかし、異常な副甲状腺組織には残留する。 下の画像を参照してください。
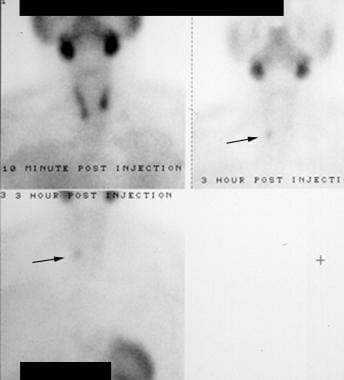 副甲状腺機能亢進症。 テクネチウム-99m(99mTc)セスタミビ放射性核種スキャン。 初期の画像(左上)は唾液腺と甲状腺の取り込みを示す。 後期画像(右と下)では甲状腺は消失しているが、右下甲状腺葉の領域に残存している(矢印)。 これは右副甲状腺腺腫であることが証明された。
副甲状腺機能亢進症。 テクネチウム-99m(99mTc)セスタミビ放射性核種スキャン。 初期の画像(左上)は唾液腺と甲状腺の取り込みを示す。 後期画像(右と下)では甲状腺は消失しているが、右下甲状腺葉の領域に残存している(矢印)。 これは右副甲状腺腺腫であることが証明された。 遅延画像では、異常な副甲状腺は持続的な活動の焦点として見られる。 孤立性腺腫を検出するスキャンの感度は文献により大きく異なるが、一般に60~90%と報告されている。 この検査の主な弱点は多腺性疾患の診断にある。 この場合、感度は約50%に低下する。 最近のセスタミビ検査のほとんどはSPECT(single-photon computed tomography:単一光子コンピュータ断層撮影法)を用いて行われている。 この技術(下の画像を参照)は、放射能の検出とCTスキャンの詳細な画像化を組み合わせたもので、標準的な平面画像(上に示すように)よりも優れた感度とより正確な解剖学的位置特定を可能にします。
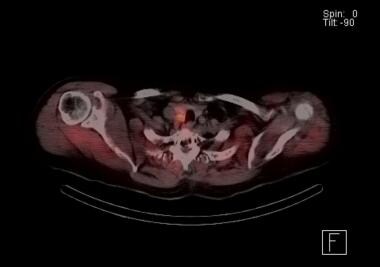 SPECTスキャンによるSestamibi副甲状腺スキャン。 オレンジ色は放射性核種が蓄積していることを示しています。 甲状腺葉のすぐ後ろに右側の副甲状腺腺腫が存在することを示す所見である。 この患者さんは、検査時に、右側に隣接して二重の腺腫があることが判明した。
SPECTスキャンによるSestamibi副甲状腺スキャン。 オレンジ色は放射性核種が蓄積していることを示しています。 甲状腺葉のすぐ後ろに右側の副甲状腺腺腫が存在することを示す所見である。 この患者さんは、検査時に、右側に隣接して二重の腺腫があることが判明した。 セスタミビ副甲状腺スキャンの大きな利点は、特に縦隔にある異所性の副甲状腺を検出することができる点である。
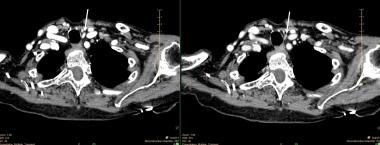
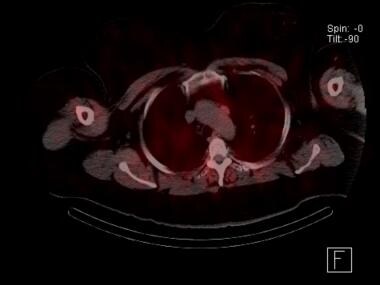 Sestamibi parathyroid scan with SPECT scan showing an ectopic mediastinal parathyroid adenoma adjacent to the aortic arc.大動脈弓に隣接する異所性の副甲状腺腫。 この患者は、頸部探査に失敗していた。 経胸壁、ロボットによる切除で治癒した。
Sestamibi parathyroid scan with SPECT scan showing an ectopic mediastinal parathyroid adenoma adjacent to the aortic arc.大動脈弓に隣接する異所性の副甲状腺腫。 この患者は、頸部探査に失敗していた。 経胸壁、ロボットによる切除で治癒した。 副甲状腺の位置確認に4次元(4D)CTスキャンを使用することが増えてきている。 この検査は無造作に行うことも、ダイナミック造影で行うことも可能である。 副甲状腺腺腫は血管が多いため造影剤で明るく強調され、その後すぐに造影剤が洗い流される。 四次元CTスキャンの研究では、88%という高い感度が示されている。 この記事を書いている時点で入手可能な最大のレトロスペクティブスタディは、全体の感度が79%であると報告している。 他の画像検査と同様に、4D-CTスキャンは単腺疾患(92~94%)よりも多腺疾患(43~67%)を検出する感度が低い。 一部の研究では、2相CTスキャンは、小さな腺腫、再手術、多腺疾患の場合を含め、副甲状腺の局在診断において4Dモダリティと同様に有効であり、患者の放射線被曝はより少ないと主張している。 ) しかし、二相法は放射線被曝量を低減させるが、これはおそらく最適な精度と引き換えになるものである。
 4D-CTスキャンで示された、小さな左下副甲状腺腺腫。 左図は造影初期に撮影された1枚の画像で、強い増強が認められます。 右は造影剤の急速な消失。 白矢印が腺腫を指している。
4D-CTスキャンで示された、小さな左下副甲状腺腺腫。 左図は造影初期に撮影された1枚の画像で、強い増強が認められます。 右は造影剤の急速な消失。 白矢印が腺腫を指している。 磁気共鳴画像法(MRI)はほとんどの施設で副甲状腺の位置確認にあまり使用されておらず、このモダリティに関する研究は一般的に小規模で、すべて造影剤が使用されている。 4D-CTスキャンと同様の概念で、MRIの感度を上げ、その有用性を拡大する可能性のある新しい技術が開発されている。
Dual-energy radiographic absorptiometryは、原発性副甲状腺機能亢進症における骨格病変を示すのに有用な手段である。 副甲状腺機能亢進症は、橈骨(遠位3分の1)の皮質骨に優先的に影響を及ぼすことに注意する。 重症の原発性副甲状腺機能亢進症では、骨格X線写真で頭蓋骨の塩析や指骨の骨膜下骨吸収などの病理学的変化を示す。
Thimmappaらの研究では、原発性副甲状腺機能亢進症の手術において、術中の副甲状腺測定(後述)の代わりに画像検査を用いて治癒を予測できることが示唆されている。 研究者らは以下のプロトコルを記述している.
-
外科医が行う超音波検査を含む2つの術前局所検査を行う
-
術前のビタミンDレベルを評価する。 この報告書では、2つの局在研究の間に強い裏付けがあり、術中の所見がこれらの研究と一致している一部の患者では、術中の副甲状腺検査は必要ないかもしれないと主張し、このプロトコルが採用された患者の治癒率は副甲状腺検査で達成したものと同じであると述べている。
処置
両側内頸静脈サンプリングは、異所性副甲状腺腺腫の位置確認に使用され、通常、標準画像診断が有用でない場合に外科的切除が失敗した症例で使用される。
治療
異常副甲状腺の外科的切除(外科的治療の詳細については以下を参照)は、原発性副甲状腺機能亢進症に対する唯一の永久的、治癒的治療法を提供するものである。 有症状の患者にはすべて外科的治療を行うべきであるというのが普遍的な意見である。 特に高齢者では、疲労が加齢や他の原因によるものと考えられ、無視されることが多い症状である。 無症状の患者の最適な管理については、いくつかの論争が存在する。
無症状の原発性副甲状腺機能亢進症の管理に関するガイドラインは、2013年に第4回無症状原発性副甲状腺機能亢進症に関する国際ワークショップで更新された。 手術の適応は以下の通りです :
-
血清カルシウム>基準範囲上限1mg/dL以上
-
骨密度Tスコア-2以下
> 骨密度Tスコア基準範囲上限-2以下
-
-
X線撮影または椎体骨折評価(VFA)で証明される椎体骨折
-
-
<1124>20-20ccのクレアンチニンクリアランス
20-20ccのクレアチン
60cc/分。4時間尿中カルシウム排泄量<1324>400mg/日、生化学的結石リスク分析により評価した結石リスクの増加。
X線検査、超音波検査により腎石症または腎石灰化症を有すること。 またはCTスキャン
年齢50歳未満
一部の臨床家は、原発性副甲状腺機能亢進症のすべての患者に外科治療を、手術に耐えられない患者にのみ修正を行うことを提唱しています。 彼らは、手術は一般的に忍容性が高く、このような治療は合併症(例:骨粗鬆症)を予防し、患者がしばしば自覚しない症状(例:疲労、軽いうつ病)を回復させることができると主張している。 さらに、無症状の患者をモニターすることは、費用がかかり、面倒である。 このような、より自由なアプローチは、米国臨床内分泌学者協会と米国内分泌外科医協会によって招集された専門家グループによって明確にされている。 彼らは、”…妥当な余命があり、手術や麻酔の危険因子が適切な無症状のPHPT患者には、手術療法を考慮し、推奨すべきである “と結論づけたのである。 この積極的なアプローチは、すべての副甲状腺摘出術と同様に、経験豊富でよく訓練された外科医がいるかどうかにかかっているはずである。
Sharataらによる米国のプライマリーケア提供者の調査研究によると、回答者のうち原発性副甲状腺機能亢進症の管理戦略にしっかり精通している人は少数派であることがわかった。 研究者らは、調査に回答した109人の臨床医のうち、無症状患者に対する外科的介入に関する全基準を熟知していたのは31%、観察中の患者に対する正しい監視検査を正確に特定できたのは34%であったことを発見した。 観察中の患者のうち、適切なサーベイランス検査を受けていたのは16%に過ぎなかった。
急性期における重症高カルシウム血症の管理
血清カルシウム上昇の軽減は、血管内容量が回復したら塩化ナトリウムおよびフロセミドなどのループ利尿薬を用いた血管内容量拡張により行うことができる。 カルシトニンおよびビスフォスフォネートの静脈内投与などの薬物は、外科的治療の前の一時的措置として使用されている
手術以外のケアおよび長期モニタリング
手術を受けない無症状の患者には、長期モニタリングが必要とされる。 推奨されるのは、副甲状腺機能亢進症の明白な徴候および症状を毎年評価すること、血清カルシウムおよびクレアチニン検査を毎年行うこと、骨密度(脊椎、股関節、前腕)評価を1~2年ごとに行うことである。
原発性副甲状腺機能亢進症の患者は、800~1000mgの適度な1日の元素別カルシウム摂取量および年齢と性別に応じたビタミンD摂取量を維持すべきである。 良好な水分補給の維持、定期的な運動活動への参加、固定化および特定の薬物(チアジド系薬剤、利尿薬、リチウムなど)の回避が望ましい。
閉経後女性におけるエストロゲン療法は、副甲状腺ホルモンを変えずに血清カルシウムをわずかに低下させる(0.5~1mg/dL)ことが明らかにされている。 エストロゲンはまた、腰椎および大腿骨頚部骨密度(BMD)にも有益な効果をもたらす。 しかし、エストロゲン補充に伴うリスクがあるため、原発性副甲状腺機能亢進症の治療のみを目的として使用すべきではない。
ラロキシフェンなどの選択的エストロゲン受容体モジュレーターは、エストロゲンで認められたのと同程度の血清カルシウムの減少を引き起こすことが示されている。
ビスフォスフォネート、特にアレンドロネートは原発性副甲状腺機能亢進症の患者の脊椎BMDおよび股関節BMDを改善することが明らかにされている。 副甲状腺ホルモン,カルシウム,24時間尿中カルシウムの有意な変化は報告されていない。 アレンドロネートなどのビスフォスフォネートによる治療は、原発性副甲状腺機能亢進症でBMDが低く、手術を受けられない、または受けない患者において検討できる
石灰化剤はカルシウム感知受容体を活性化し、副甲状腺細胞の機能を阻害する。 シナカルセットの治療により、副甲状腺ホルモン値の正常化を伴わない減少、血清カルシウムの減少、さらには正常化が認められたが、BMDの増加は認められなかった。
その他の治療
経皮アルコール注入、超音波エネルギーによるアブレーション、副甲状腺のその他の経皮アブレーション技術は、手術を受けられない患者または受けない原発性副甲状腺機能亢進症の患者の代替治療として提案されてきた。 4121>
外科的治療
原発性副甲状腺機能亢進症の患者の多くには、外科的治療を行うべきである。 歴史的な基準である標準的な手術アプローチは、すべての副甲状腺を同定し、すべての異常腺を除去する完全な頸部探査である。 原発性副甲状腺機能亢進症の約85%は、単一の腺腫が原因である。 したがって、副甲状腺をすべて評価するために頸部全摘術を受けた患者のほとんどは、不必要な郭清を我慢することになる。 副甲状腺をすべて摘出するのではなく、新しい手法である指示副甲状腺切除術が発展してきた。 この方法は、術前の画像検査によって異常な副甲状腺を特定するものである。
現代の画像診断技術では、副甲状腺の異常は70-80%の症例で術前に検出できる。 しかし、現在の画像検査では、複数の異常腺を検出するのに信頼できるものはない。 したがって,画像化された病変を切除した後,他の異常腺が存在しないことを確認するための追加の方法が必要である。 この目的のために、ほとんどの施設では術中副甲状腺ホルモン測定法を用いている。 副甲状腺ホルモンの血漿中半減期は約4分しかないため、病巣を切除するとすぐに値が下がる。 もし、同定された異常腺を切除しても値が下がらない場合は、手技を延長してさらに詳しく調べることができる。 しかし、術中の副甲状腺ホルモン測定は、通常、副甲状腺切除術を大量に行う施設でのみ利用できる。
少数の著者は、手持ちのプローブを使って異常腺で標識セスタミビを検出し、ラジオガイド副甲状腺切除術を提唱している。
Greeneらは、1998年から2008年にかけて、副甲状腺摘出術における外科医の両側探査と限定探査の使用傾向を調査した。 米国における副甲状腺手術の46%を占める256人の外科医(米国内分泌外科学会および米国外科学会の会員)を調査したところ、2008年には10%の外科医が両側頸部探査を、68%が限定的探査を、22%がこれら両方の探査法を診療で用いていた。 1998年の統計では、両側性、限局性、両方の探査を行う外科医はそれぞれ74%、11%、15%であった。 4121>
また、2008年に調査した一般外科医の半数は、術中に副甲状腺ホルモンをモニターしたことがなかったが、内分泌外科医では10%未満であったことも明らかにした。 さらに、「外科医のサブセットによって、手術量、両側頸部探査の適応、ケア、セスタミビに関する専門知識、治癒率や合併症率の認識に大きな差があった」。 Greeneと彼の共著者は、副甲状腺機能亢進症の外科的管理には多くの違いが存在するため、ベストプラクティスのガイドラインを定義する必要があるかもしれないと結論付けた
MEN 1などの家族性疾患に対して、副甲状腺全摘術は頸部胸腺切除と前腕への自家移植とともに行われる。 副甲状腺組織の一部を凍結保存することも推奨されています。
副甲状腺摘出術は通常、十分な忍容性がある。 主なリスクは反回喉頭神経の損傷と、副甲状腺をすべて切除したり血管を切ったりすることによる副甲状腺機能低下症である。 この手術には局所麻酔がうまく使われてきたが、特に術前に1つの腺腫を限局するような直接法では、全身麻酔が最もよく使われる。 高カルシウム血症(したがって脱水症)がひどい患者には、周術期に体液バランスを回復させることに特別な注意を払う必要がある。 手術室での適切なポジショニングを確保するため、頸部の可動性を評価する必要がある
すべての副甲状腺を確認する頸部全摘術のテクニック
この手術で最も重要なことは、4つの副甲状腺すべてを確認することと、すべての異常腺を摘出することである。 4腺の過形成の場合、3.5腺(亜全摘)の副甲状腺切除術が行われる。 最も正常と思われる約50~70mgの組織を残します。 再手術が必要な場合、非吸収性の縫合糸をタグとして残し、腺を識別する。
患者は横向きに置いたショルダーロールの上に首を伸ばし、ローンチェア位にされる。 この体位は、前頚部構造の完全な露出を可能にし、静脈の排出を改善する。
皮膚のしわに沿った低い横切開は、最高の美容的結果をもたらす。 切開の長さは、副甲状腺のすべての潜在的な位置を完全に探索できるように適切でなければならない。しかし、頸部皮膚フラップの弾性を考えると、通常2~5cmの切開で重要な構造を安全に同定することができる。 胸骨舌骨筋と胸骨甲状腺筋を正中線上で切り離し、甲状腺を露出させる。
しばしば、甲状腺葉を十分に動員するために中甲状腺静脈の結紮が必要となることがある。 甲状腺葉は総頸動脈から持ち上げられ、内側に引き込まれる。 下甲状腺動脈は、総頸動脈の前方および内側、甲状腺葉の後方にある乳輪組織を鈍的かつ鋭的に剥離した後に同定される。 次に反回神経を甲状腺下葉の下側と外側で確認する。
下甲状腺動脈と反回神経の交点は、上下のほとんどの副甲状腺がこの部分から2cm以内に位置しているので重要なランドマークである。 上側の副甲状腺は甲状腺葉の上3分の2の背側で、反回神経より後方に位置する。 下甲状腺は、位置があまり一定していませんが、通常、下甲状腺動脈の下で、反回喉頭神経の腹側に見つけることができます。 それらは通常、甲状腺の下葉から1cm以内にある。
時折、全ての副甲状腺が同定できないことがある。 そのような場合、ほとんどの副甲状腺は典型的な部位にあるため、まず通常の部位を再検査する。 副甲状腺がその場所に確認できない場合は、上・下副甲状腺の降下経路を考慮しながら、系統的に検索する。 それらは、特に下甲状腺静脈の分割、すなわち腺が上縦隔に引っ込むことを可能にする操作の後では、同定が困難な場合がある。 異所性下副甲状腺のもう一つの場所は、胸腺である。 下部の副甲状腺が見つからない場合は、頸部胸腺切除術を行い、安全に行える範囲で胸腺組織を縦隔から上方に挙げることができる
上部の副甲状腺は、通常甲状腺の上3分の2の背側にある。 時に、これらの腺は上甲状腺血管に隣接している。 他の場所としては、頚動脈鞘や食道または咽頭の後方(食道後面)がある。 最後に、上甲状腺と下甲状腺の両方が甲状腺の被膜の中に異常に位置することがある。 外科医によっては、前述の場所を徹底的に探した後、異常腺がない側の甲状腺葉切除術を行うこともある。 副甲状腺機能亢進症の最初の頸部探索では、一般的に胸骨正中切開は行うべきではない。
異常肥大した腺は、他の腺の正常サイズを確認した後に切除する。 切除の際、異常腺の被膜破裂を避けることは、手術部位への副甲状腺細胞の着床とその後の副甲状腺腫症に関連する可能性があるため重要である。 副甲状腺は、経験豊富な外科医であれば、外観と位置から同定することができる。 必要であれば、凍結切片検査により副甲状腺の同定を組織学的に確認する必要がある。 自己移植を伴う副甲状腺全摘術の場合、最初の移植が十分に機能しない場合に備えて、将来の自己移植のために副甲状腺組織を冷凍保存しておく必要がある
Technique for directed parathyroidectomy
多くの点で手術法は上記の副甲状腺完全探査の場合と同様である。 以下に相違点を記す。
手術前に異常腺の十分な画像診断を行うことは必須である。 また、術中に副甲状腺ホルモンを測定する段取りを確認する必要がある。 末梢静脈血のサンプリングラインを確立しておく必要がある。 多くの場合、遠位伏在静脈が最も便利なアクセスを提供する。
外科医によっては、術前の腺腫の位置に基づいて切開の位置を変更する者もいる。 筆者は、カラー切開の標準的な位置での小切開(すなわち、約2cm)を好んでいる。 この切開は、広範な検査が必要と判明した場合には容易に拡張できる。
皮膚切開の直前に副甲状腺ホルモン濃度の基準値を測定する。 腺腫の同定と剥離の後、切開前のレベルが描出される。 副甲状腺の操作により、副甲状腺ホルモン値は時に10倍以上の有意な上昇を示す。 副甲状腺を切除した後、切除後5分と10分に副甲状腺ホルモンの値を測定する。 適切な切除の基準は、副甲状腺ホルモンがベースラインレベルから切除後10分のレベルまで50%低下するか、副甲状腺ホルモンが切除前レベルから10分の時点で50%低下し、切除後レベルがベースラインレベルを下回るかのいずれかである。
最後の副甲状腺ホルモン値を処理している間は切開部を閉じてよいが、副甲状腺ホルモン測定結果が判明するまでは、患者を麻酔下に置き、無菌野を維持すべきである。
指示副甲状腺切除術がうまくいけば、これらの患者のほとんどは手術当日に安全に退院することができる。
合併症と術後ケア
副甲状腺全摘術の場合、術後の副甲状腺機能低下症と低カルシウム血症が懸念されるが、副甲状腺指示切除術と限定頸部探査では極めて稀である。 低カルシウム血症は両側副甲状腺探査術後、特に副甲状腺亜全摘術を行った場合に多く見られる。 血清カルシウムの最下点は通常、術後24~72時間後に起こる。 多くの患者が低カルシウム血症になるが、症状を呈する患者はほとんどいない。 一方、限定的な探査が行われた場合でも、副甲状腺切除術後の最初の数日間には、確認できる低カルシウム血症がないにもかかわらず、軽度の低カルシウム血症の症状が起こりうる。 このため、一部の開業医は術後に経口カルシウム補助剤を日常的に投与している。
副甲状腺手術後の低カルシウム血症は、カルシウムとリンが骨に急速に沈着するハングリーボーン症候群によるものと思われる。 これは、副甲状腺機能低下および正常な腺の感受性が回復するまでの一過性の、しかし時に重度の低カルシウム血症によって特徴づけられる。
副甲状腺機能低下が持続する場合は、カルシウムおよびビタミンDの経口補給が必要である。 クエン酸カルシウムまたは炭酸カルシウムは、元素状カルシウムとして1日4回、400~600mgから開始できる。 患者によっては、これよりかなり多くの量を必要とする。 カルシトリオールは1回0.5mcgを1日2回から開始し、必要に応じて増量する。 副甲状腺全摘術および自家移植が実施された患者は、一時的なカルシウム補給が必要となることが予想される
副甲状腺摘出術中に反回喉頭神経が切断された場合は、直ちに修復が必要である。 術中に反回神経が損傷していることは知られていないが、患者が新たな嗄声を発症したために機能障害が示唆される場合、ほとんどの患者は数週間から数ヵ月で神経機能を回復するため、最初は期待管理を選択する。 喉頭鏡検査は、機能障害と機能回復の両方を記録するために適応となる。
術後の生命を脅かす可能性のある緊急事態は、気管前腔に拡大した血腫の発生である。 この合併症を認識し、創を開いて血腫を排出することで直ちに治療しなければならない。 治療しない場合、喉頭浮腫は急速に進行し、気道閉塞を引き起こす可能性があります。 さらに、浮腫は気管内挿管を妨げることがあり、創の開放が挿管の試みに先行すべきである。
ほとんどの小さな血腫は治療を必要としない。 時折、扁平上皮下液溜まりが形成されることがあるが、これらは通常1回の吸引で十分な治療が可能である。 少数の症例では、吸引を繰り返す必要があるかもしれない。
治療成績
原発性副甲状腺機能亢進症の手術後の治癒率は専門家の手では非常に高く、約97-98%である。 治癒とは一般的に血清カルシウムが正常化したことと定義される。 しかし、副甲状腺ホルモン値は、20~40%の患者で術後に上昇することがある。 血清カルシウムが基準範囲内にとどまっている場合、この上昇状態は通常、疾患の持続を示唆するものではないが、再発のリスクが高いことを示唆している可能性がある。 原発性副甲状腺機能亢進症の患者の多くにはビタミンD欠乏症があり、補充することで副甲状腺ホルモン濃度の上昇を是正できる可能性がある。 また、副甲状腺摘出術後の副甲状腺ホルモンの孤立性上昇をカルシウムの補充が減少させるという弱いエビデンスもある。
副甲状腺摘出術後にQOLが改善することは、繰り返し示されている。 特に、「無症状」の患者でもQOLが改善することが分かっており、患者や臨床医が気づかないような軽い症状もあることが強調されている。
経過観察
患者は術後1~2週間後に受診し、血清カルシウム、25-ヒドロキシビタミンD値、副甲状腺ホルモン値が測定される。 ビタミンDの欠乏は、副甲状腺機能亢進症の患者に特によくみられる。
解析の結果、副甲状腺摘出術成功後の再発率は長期追跡で約10~15%であり、これは歴史的に考えられてきたよりもはるかに高いことが明らかになった。 そのため、年に一度のカルシウムと副甲状腺ホルモンの測定を行い、長期的なフォローアップを行うことが推奨される
。