目次
- 1 機能
- 2 鎖のしくみ
- 3 HIVとAIDS
- 4 構造の影響
- 5 PFVインタソーム結晶化
- 5.1 結晶化技術
- 5.2 結晶学的および精密化統計
- 6 全体構造& 構成要素
- 6.1 構造
- 6.2 インテグラーゼとDNAの相互作用
- 6.3 活性部位
- 7 インテグラーゼ阻害剤
- 7.1 Additional Resources
- 8 レトロウイルスインテグラーゼの3次元構造
Function
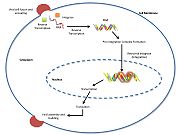
Retroviral IntegraseはウイルスDNAに結合して宿主細胞の染色体に挿入するレトロウイルス必須の酵素であり、レトロウイルスに感染したウイルスはDNAを除去する。 ヒト免疫不全ウイルス1型(HIV-1)の逆転写されたcDNAは、病原体の体力と毒性を高めるために、宿主細胞のゲノムに挿入される。 インテグラーゼはレトロウイルスの一種(HIVなど)が産生する酵素で、ウイルスが自分の遺伝物質を宿主細胞のDNAに組み込むのに利用される。 宿主の細胞機構は、組み込まれた遺伝物質からmRNA、そしてタンパク質を産生し、ウイルスを複製する。 インテグラーゼを阻害する薬剤がいくつか研究されているが、鎖の移動を阻害する作用のメカニズムは、まだ解明されていない。 しかし、Hareら(2010)は、レトロウイルスのインテグラーゼの構造的構成要素を決定した。 今後、レトロウイルスのインテグラーゼの完全な構造が解明され、その機能・酵素活性の制御が可能になれば、レトロウイルス病の進行を遅らせることができる可能性がある。 さらに、HIV-1インテグラーゼの研究は、新たな標的の発見や、抗ウイルス治療のためのファーマコフォアモデルの作成に貢献する可能性があります。
HIVインテグラーゼ阻害剤。 HIVインテグラーゼ阻害剤:ラルテグラビル(アイセントレス)は、現在、HIVインテグラーゼ阻害剤として承認されている。 ファージ・インテグラーゼについては、ファージ・インテグラーゼをご参照ください。
Strand-transfer inhibition actio
Caption
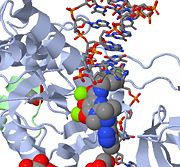
上記は、活性部位への結合からウイルスDNAの3’末端をブロックするMK-0518のJMOLイメージ図です。 MK-0518の金属キレート酸素原子が、活性部位に見られるマグネシウム陽イオンと相互作用していることに注目してください。
HIV integrase type 1は比較的新しい、新しい阻害剤の標的です。 2007年に、最初のHIV-1インテグラーゼ阻害剤であるRaltegravirが、HIV-1における併用療法としてFDAによって承認されました 。 鎖伝搬阻害剤は、ウイルスDNAの宿主染色体への協調的な統合を阻害することによって作用する。 ウイルスが宿主細胞に侵入した後、逆転写酵素がウイルスのssRNAをdsDNAに変換する。 このとき、インテグラーゼはウイルスDNAと複合体を形成し、統合前複合体(インタソーム)を形成する。 そして、統合前複合体は核内にシャペロンされ、そこで3’末端から2つのヌクレオチドが切り取られる。 次に、DNAは宿主のDNAに共有結合で組み込まれる。 鎖移行阻害剤は、このプロセスを阻害し、ウイルスDNAの宿主染色体への統合を阻止する。 鎖移行阻害剤は、レトロウイルスのインテグラーゼ活性部位に存在する金属イオン補因子と結合することで効果を発揮する。
HIVとAIDS

2010年には、2500万人以上の人々がAIDSで死亡しており、現在約3300万人がHIVとともに生きていると推定されています。 レトロウイルスインテグラーゼ阻害剤については、RaltegravirおよびRetroviral Integrase Inhibitor Pharmacokineticsをご参照ください。
Impact of Structure
HIV感染と病原性のメカニズムを理解する上で重要な特定の宿主細胞タンパク質の三次元構造がX線結晶構造解析から明らかになりました。 HIVプロテアーゼとインテグラーゼの構造は、多くの人命を救い、多くのHIV感染者のQOLを高めることに貢献した最高位の構造である。 プロテアーゼ阻害剤やインテグラーゼ阻害剤を開発するための構造ベースドラッグデザインに実装され、高活性抗レトロウイルス療法(HAART)の重要な構成要素として使用されている。
既存の抗レトロウイルス剤は、多くの患者の寿命を延ばすだけでなく、生活の質も向上させるが、病気を根絶することはできない。 インテグラーゼ阻害剤の研究では、他の抗レトロウイルス剤との併用でウイルスの適応を弱めることが示されており、他の薬剤に耐性を獲得した患者のサルベージ療法に使用できる可能性がある。 詳しくは、
- AIDS Before Protease Inhibitors & HIV Protease Inhibitorsをご覧ください。 A Breakthrough
- Treatments:Retroviral Integrase Inhibitor Pharmacokinetics References.
PFV Intasome Crystallization
HIV-1のウイルスDNA末端の模倣のために、Hareら(2010)は、組換えPFV integraseと二本鎖オリゴヌクレチドを用いて得られた、可溶性と完全機能性を有する試作フォームウイルス(PFV)インタゾームの準備物を利用した。
インテグラーゼ-DNA複合体の顕著な安定性は、in vitroの鎖移動反応を観察することによって決定され、その反応は脱タンパク化の移動の3つのモードに分類された。 (1)単一協調現象:直鎖化標的プラスミド、(2)複数協調現象:スミア、(3)ハーフサイト現象:オープンな円形DNAである。 さらに、PFVのインタソームの特徴を調べたところ、高イオン強度条件下で長時間インキュベートしても、タンパク質-タンパク質およびタンパク質-DNAの強い相互作用を示唆する構造的妥当性が示された。 包括的な結晶化アッセイにより、2.9オングストロームの分解能でX線を回折する結晶構造を得ることができた。 最終的に3次元構造が決定された。 この非対称ユニットには、ウイルスDNA分子が安定に結合した1つのインテグラーゼ2量体と、長方形の4量体を形成する対称性に結合した1対のインテグラーゼ2量体が含まれていた。 二量体の界面は、分子間のアミノ末端と触媒コアドメイン(内側サブユニット-外側サブユニット)相互作用によって安定化されている。
結晶化技術
タンパク質-DNA複合体は、完全長の野生型PFV INとウイルス末端を模した合成dsDNAを用いて形成した。 リザーバーは1.35M硫酸アンモニウム、25% (v/v) グリセロール、4.8% (v/v) 1,6-hexanediol および50mM 2-(N-morpholino) ethanesulphonic acid (MES) からなり、pH 6.5 に調整した。 また、タンパク質-DNA結晶をMK0518, GS9137, Mg(II), Mn(II)の存在下で浸漬させた。 結晶構造は分子置換法を用いて解いた。
Crystallographic and Refinement Statistics
Hare et al (2010) は7つの結晶構造についてのデータを発表している。 これらのデータには、PFV IN 複合体 (アポ型) と、Mg, Mn, Mg/MK0518, Mn/MK0518, Mg/GS9137, Mn/GS9137 に結合した複合体を含む 6 つの追加の構造が含まれている。 7つの構造はすべてP41212空間群に属している。
全体構造 & 構成要素
構造
組み立てられたPFVインタソームの全体構造は、二量体-二量体インターフェースを持つ二つのドメイン構造に基づく四量体モデルである。 これまでのインタソームモデルでは、類似しているがより柔軟な構造が描かれていたが、PFVインタソームは高い制約を受けていることが示されている。 Hareら(2010)は、相同性モデリングを用いて、特にHIV-1インテグラーゼでは、ドメイン間リンカーが短いことが柔軟性の要因である可能性を提唱している。 4量体の内側サブユニットは、全体の4量体化とウイルスのDNA結合に関与している。 外側サブユニットの触媒コアドメインは支持体として働くと考えられるが、アミノ末端およびカルボキシ末端ドメインは電子密度分布図では未解明であるため、その機能はまだ確定していない。 触媒コアドメインとカルボキシ末端ドメインのリンカーは、その長さの大部分において伸長した構造をとり、内側サブユニットのアミノ末端ドメインと触媒コアドメインのリンカーと平行に位置している。 ドメイン間リンカー ドメイン間リンカー(CCD-CTDリンカーとNTD-CCDリンカー)がインタソームの両半分を結合し、一対のカルボキシ末端ドメインが両方の内側触媒コアドメインと相互作用することによって、構造がさらに安定化される。
インテグラーゼとDNAの相互作用
強いタンパク質-DNA相互作用は末端6ヌクレオチド内に存在する。 各カルボキシ末端ドメインは両方のウイルスDNA分子のホスホジエステル骨格と相互作用している。 さらに、アミノ末端ドメイン-エクステンションドメインとアミノ末端ドメインは、対向する触媒コアドメインの活性部位でウイルスDNAと相互作用する。
活性部位
活性部位カルボン酸はAsp 128、Asp 185、Glu 221の側鎖である。
- .
- .
インテグラーゼ阻害剤
| 名称 | ブランド | 企業 | 特許 | 備考 |
| Raltegravir | Isentress | Merck & Co.Ltd. (米国) | – | MK-0518としても知られています。 MK-0518のイソプロピルおよびメチル-オキサジアゾールは、Pro 214およびTyr 212の側鎖との疎水性およびスタッキング相互作用に関与し、PFVインタソーム活性部位内でこの薬物を安定化させる。 このような薬物結合の相互作用により、反応性の3’ウイルスDNA末端がPFVインタソームの活性部位から変位する。 MK-0518が活性部位に結合した後、反応性の3’水酸基はPFVインタソームの活性部位から6オングストローム以上離れている。 Raltegravirは、2007年10月12日に、成人のHIV感染症の治療において、他の抗HIV薬との併用でFDAから承認されました。 本薬は、FDAから承認された最初のインテグラーゼ阻害剤である。 |
| Elvitegravir | – Gilead Science | GS-9137 キノロン基とイソプロピル基を介してPFVインタソームのPro 214と相互作用する。 キノロン系抗生物質のコア構造を共有し、実験段階にある。 治療経験者を対象としたエルビテグラビルの第Ⅱ相試験を終了。 治療経験者を対象とした第III相試験が進行中。 また、抗レトロウイルス療法を受けたことのない人を対象としたelvitegravirの第II相試験が進行中である。 この試験では、現在GS9350と呼ばれているNorvirに代わるブースト剤としての評価も行われる予定です。 エルビテグラビルは、過去に他の抗HIV薬を服用したことのあるHIV陽性患者に有望である。 | – | HIV感染症に対する使用を目的とした第2世代のインテグラーゼ阻害剤である。 最初に発売されたインテグラーゼ阻害剤であるraltegravirと比較して、HIVの酵素であるインテグラーゼを4倍長く阻害することができる点で優れている。 暴露前予防薬(PrEP)として使用することが検討されている。 |
「レトロウイルス インテグラーゼ阻害剤の薬物動態」も参照。