グリコーゲンやデンプンは、メガダルトンサイズのグルコースポリマーで、ほとんどの生物において容易に利用できるエネルギーや炭素化合物の主要な貯蔵場所となっています。 哺乳類では、グルコースの取り込みと利用は厳密に制御されている。 グルコースの正常な取り扱いにおける欠陥は、グリコーゲン貯蔵病や糖尿病など、ヒトの様々な病態に関連しており、高血糖の持続は、疾患の早期発症や重症化に相関している。 グリコーゲンの代謝経路には、いくつかの酵素が関与しており、中でもグリコーゲン合成酵素はa(1,4)-結合型グルカンの伸長を、グリコーゲンホスホリラーゼは分解を触媒している。 この30年間、グリコーゲンやマルトデキストリンホスホリラーゼの生化学的、構造学的研究により、グリコーゲンの分解に関する多くの情報が得られてきた。 これらの研究により、グリコーゲンホスホリラーゼの制御は、ホルモンの制御により絶妙に調整された共有結合および非共有結合のアロステリズムの魅力的な例であることが示されている。 現在、グリコーゲンのプロセシングに直接関与する酵素の3次および4次構造を記述する情報が、実質的にすべて入手可能である。 グリコーゲン合成酵素は、ADP/UDP-グルコースをグルコース供与体として、![]() -(1,4)-結合したグルコース残基をポリマーの非還元末端に連続して付加することによりグリコーゲンの伸長を触媒するが、意外にも構造情報は殆ど報告されていない。
-(1,4)-結合したグルコース残基をポリマーの非還元末端に連続して付加することによりグリコーゲンの伸長を触媒するが、意外にも構造情報は殆ど報告されていない。
今回、アグロバクテリウム・ツメファシエンス(AtGS)由来のグリコーゲン合成酵素の結晶構造を、アポ型とADP存在下の両方で2.3Å分解能で決定した。 データはID29で収集され、構造はSAD法(単波長異常分散法)とそれに続く密度修正手順で解かれた。 このタンパク質は、グリコーゲンホスホリラーゼやGT-Bスーパーファミリーの他の糖転移酵素の構造と同様に、2つの「ロスマンフォールド」ドメイン(図81)からなる非対称ユニットで二量体として見いだされた。 両ドメインの間の深い裂け目は触媒中心を含んでいる。 哺乳類(GT3ファミリー)と細菌(GT5)のグリコーゲン合成酵素の大きな違いは、GT3酵素だけがリン酸化と非共有結合のアロステリック調節により厳密に制御されていることである。 GT3、GT5およびグリコーゲンホスホリラーゼの配列間の構造に基づく多重配列アラインメントによると、ヒトのグリコーゲン合成酵素の制御的リン酸化部位は、おそらく細菌のグリコーゲン合成酵素の非制御的GT-Bコア以外の25残基N末および120残基C末挿入部に位置していることがわかった。 以前、突然変異誘発研究により、GT3酵素に保存されている2つのArgクラスターが、リン酸化Ser/Thr残基と非共有結合活性化物質Glc-6Pのアロステリックサイトの一部であることが同定された。 AtGSの同等の残基は、反応中心から離れたC末端ドメインの一端に位置しており、長距離の制御効果を示している
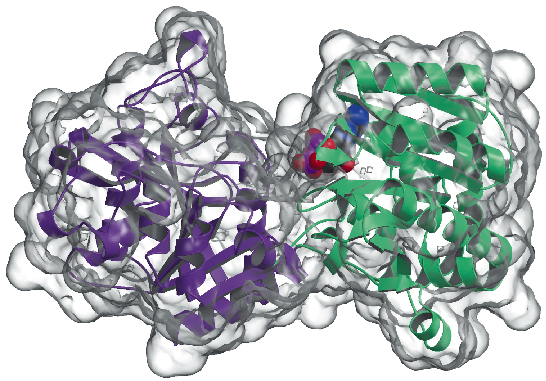
Fig: グリコーゲン合成酵素の構造:溶媒にアクセス可能な面を透明で表現している。 結合したADP分子(VDWボールとして描かれている)に注意。
AtGSの構造は、配列の同一性が低い(〜14%)にもかかわらず、グリコーゲン/マルトデキストリンホスホリラーゼ(GT35ファミリー)のコア構造(図82a)と著しいトポロジー的類似性を示している。 AtGSの各ロスマンフォールドドメインの構造は、他のどのヌクレオチド依存性糖転移酵素よりもGT35ファミリーのリン酸化酵素の構造に著しく近いことがわかる。 グリコーゲン合成酵素とホスホリラーゼはまた、その触媒部位において強い類似性を示す(図82b)。 ADPリボースとピリドキサール基は、AtGSではADPの遠位リン酸、ホスホリラーゼでは無機リン酸基と同じように、同等の位置にある。 さらに、基質のグルコース部位と相互作用する重要なアミノ酸も保存されている。 したがって、グリコーゲン合成酵素とホスホリラーゼの触媒機構はおそらく類似しており、構造の微妙な変化により全体的な機能特性の違いが説明できる。
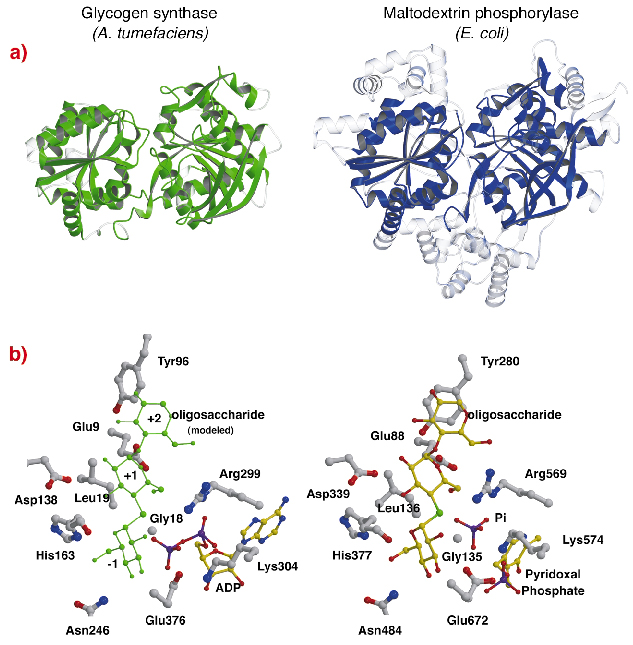
Fig. 82:グリコーゲンホスホリラーゼとの相性。 (a)構造アライメント後、AtGSと大腸菌マルトデキストリンホスホリラーゼMalPの同等残基を重ね合わせ、実線で表した(非アライメント領域は透明)、(b) AtGSとMalPの触媒部位を表した。
グリコーゲン合成は単に分解性リン酸化の反転であるという最初の提案は、LeloirがGlc-1-PやグリコーゲンホスホリラーゼではなくUDP-Glcとグリコーゲン合成酵素が多糖の伸長を担うことを示したので欠陥であることが証明された 。 しかし、我々の研究は、グルコース-グリコーゲンの相互変換における反対の独立した反応は、密接に関連した相同酵素によって触媒されることを実証している
。