L’immunofluorescenza (IF) è un approccio morfologico comune usato per determinare la distribuzione di componenti subcellulari. Gli anticorpi coniugati con coloranti fluorescenti sono richiesti nel saggio IF. L’anticorpo riconosce specificamente l’antigene legandosi all’epitopo del bersaglio, e il fluoroforo sarà rilevato sotto un microscopio a fluorescenza. Quindi, i componenti subcellulari possono essere visualizzati in uno sfondo scuro. L’IF può anche essere usato come un metodo alternativo di analisi semiquantitativa per monitorare l’espressione dell’interesse.
Ci sono tre tipi di IF: IF diretto, IF indiretto e IF combinato.
L’IF diretto utilizza un singolo anticorpo primario che è coniugato con un colorante fluorescente.
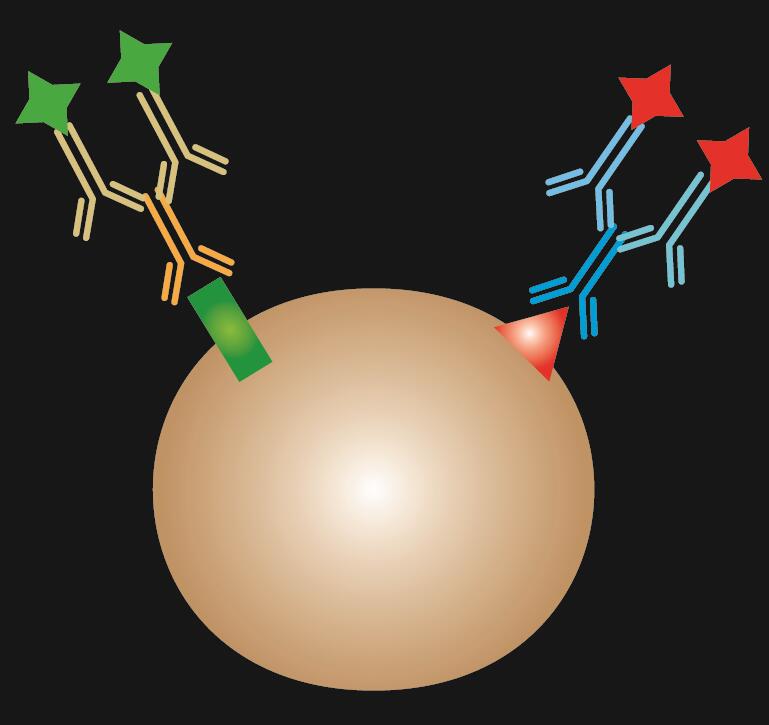
L’IF indiretto utilizza due anticorpi per la colorazione: un anticorpo primario che si lega specificamente all’epitopo e un anticorpo secondario abbinato coniugato con un colorante fluorescente.
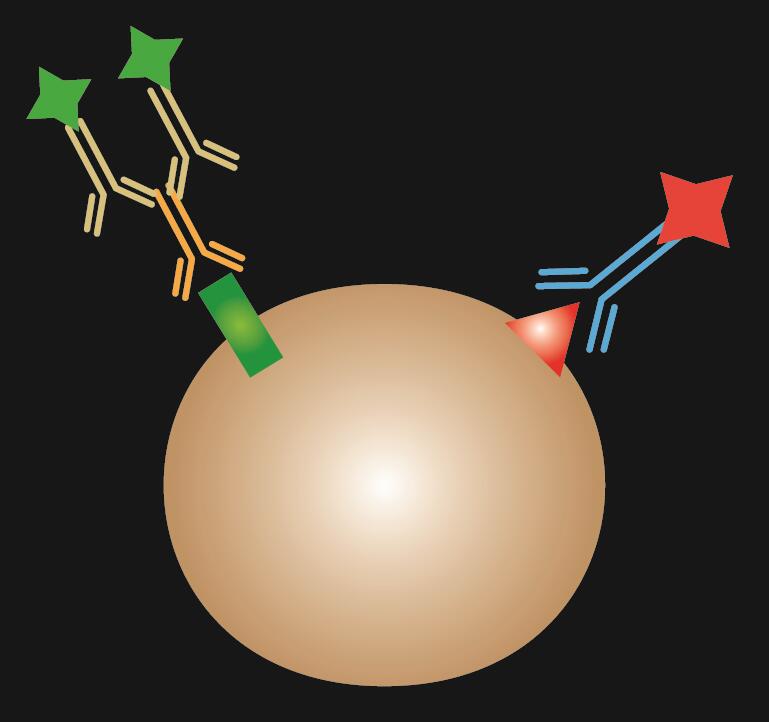
L’IF combinato è una combinazione di colorazione IF diretta e indiretta.
Tabella 1. Confronto tra IF diretto, indiretto e combinato.
| Tipo di IF | Diretto | Indiretto | Combinato |
|---|---|---|---|
| Schema | 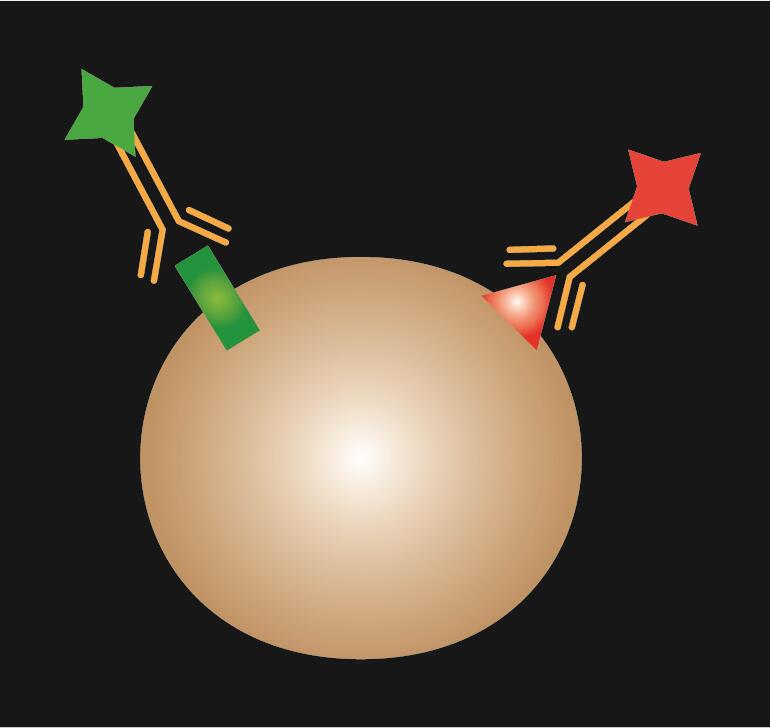 |
 |
 |
| Svantaggi |
|
|
|
| Svantaggi |
|
|
|
Tra i tre tipi di IF, il metodo IF indiretto è il più popolare.
L’approccio IF può essere usato su sezioni di tessuto, linee cellulari coltivate e cellule individuali. Il processo di IF è simile all’immunoistochimica (IHC).
- Raccolta e fissazione dei campioni
I campioni devono essere fissati rapidamente dopo la rimozione del tessuto, ed è meglio eseguire la prefissazione attraverso l’infusione del cuore con formaldeide al 4% o paraformaldeide in piccoli animali come i roditori. Si raccomanda che i tessuti non siano più spessi di 10 mm e che il volume del fissativo sia almeno 15-20 volte più grande del volume del tessuto. La fissazione è molto importante per mantenere la morfologia e la struttura delle cellule così come l’integrità dell’antigene. Pertanto, le soluzioni di fissazione devono essere scelte attentamente in base ai diversi antigeni e campioni di tessuto.
Tabella 2. Strategia di fissazione per antigeni parziali.
| Antigene | Soluzione di fissazione | Condizione di fissazione |
|---|---|---|
| Proteina maggiore | 95~100% alcool 4% paraformaldeide |
3~10 min a 37℃ 4~24 ore a 4℃ |
| Enzima | Acetone | 15 min a RT |
| Ormone | Alcool al 95% più 1~5% di acido acetico glaciale | 30 min a 4℃ |
| Globulina immunitaria | Alcool al 95% Carbonio tetracloruro di carbonio |
10 min a 37℃ poi 15 min a 4℃ |
| Proteina fibrosa | 95% alcool più 1~5% acido acetico glaciale | 10 min a 37℃ poi 15 min a 4℃ |
| Virus | Acetone Tetracloruro di carbonio Alcool |
5~10 min a RT poi 30~60 min a 4℃ |
| Polisaccaride e batteri | Acetone 10% formaldeide Metanolo |
3~10 min a RT poi 30~60 min a 4℃ |
| Lipoide | 10% formaldeide | 3~10 min a RT |
| Cellula coltivata | Riscaldata 4% paraformaldeide | 15~20 min a RT |
- Deidratazione e inclusione
La disidratazione è necessaria nella preparazione di sezioni di tessuto per i seguenti motivi:
1. Sezione di paraffina: La paraffina è immiscibile con l’acqua.
2. Sezione congelata: I cristalli di ghiaccio congelati distruggerebbero la morfologia delle cellule.
La disidratazione viene sempre eseguita immergendo il tessuto in una soluzione di etanolo a gradiente crescente o in una soluzione di saccarosio.
Di conseguenza, i campioni di tessuto possono essere incorporati aggiungendo cera di paraffina fusa per le sezioni di paraffina, mentre il composto OCT viene aggiunto per le sezioni congelate. Questo passaggio fornisce una durezza adeguata per i campioni di tessuto morbido e permette al tessuto di essere tagliato facilmente.
- Sezione e colorazione
I tessuti incorporati possono essere sezionati in fette sottili con microtomo o microtomo di congelamento. Lo spessore delle fette dovrebbe essere deciso in base al diametro cellulare e allo scopo del test IF. Fette più sottili (≤ 10 micron) sono suggeriti per montare direttamente su vetrini adesivi prima della colorazione, in quanto sono facili da essere accoltellato in più fasi di lavaggio. Fette più spesse (10 ~ 30 um) otterrà immagini migliori utilizzando il metodo libero galleggiante, come l’anticorpo primario potrebbe penetrare anche se entrambi i lati della fetta. E sezioni galleggianti liberi sono montati su vetrini dopo la colorazione. Sezioni flottanti di piccoli tessuti come la radice dei gangli dorsali del mouse (DRG) sono difficili da eseguire e facile da perdere campione. Pertanto, metodo sezione bastone è raccomandato su alcuni campioni di tessuto di piccole dimensioni. Le fasi di colorazione dovrebbero essere eseguite al buio quando è coinvolto un anticorpo coniugato con un colorante fluorescente.
Ricerca di protocolli IF:
- Sezione a bastoncino
- Sezione flottante
- Cellule coltivate
- Immagini e analisi
La segnalazione positiva è virtualizzata sotto un microscopio fluorescente in uno sfondo scuro. La posizione di interesse è determinata di solito dalla co-colorazione di una proteina di cui è nota la posizione. In alternativa, la quantità di cellule positive o l’intensità di fluorescenza della segnalazione positiva potrebbe essere misurata per un’analisi quantitativa. Per esempio, l’intensità di fluorescenza più forte si riferisce a un’alta espressione relativa della proteina bersaglio.
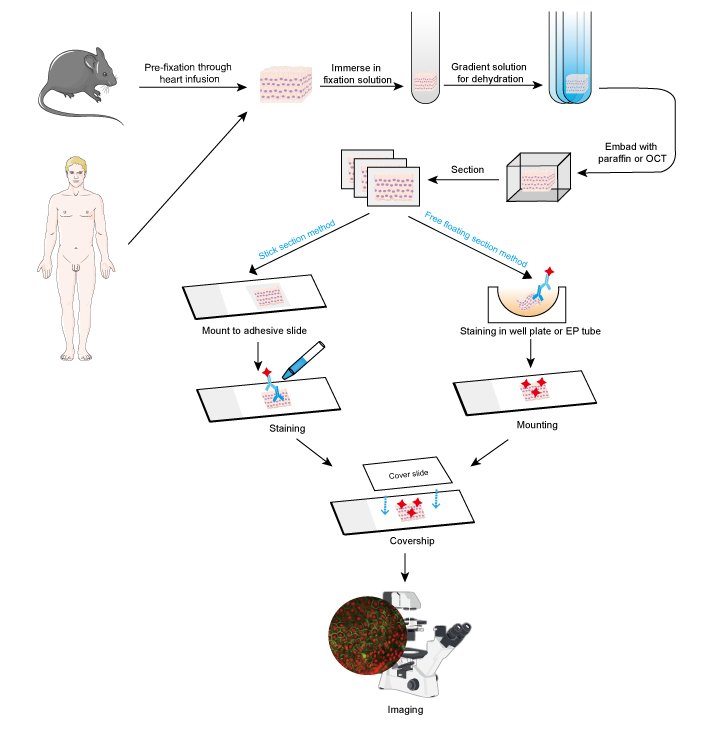
Figura 1. Flusso di lavoro di IF su sezioni di tessuto.
IF e IHC sono entrambi potenti approcci per l’analisi morfologica con importanti applicazioni diagnostiche e prognostiche. Diverse differenze devono essere preoccupate nella vostra ricerca:
Tabella 3. Confronto tra IHC e IF
| IHC | IF | |
|---|---|---|
| Metodo di marcatura | Cromogenico | Fluorescente |
| Fase di lavorazione | Più come substrato richiesto | Meno |
| Immagine |
|
|
| Microscopio | Microscopio ottico | Microscopio fluorescente |
| Stabilità | Stabile per anni | Meno stabile a causa del photobleaching |
| Esempio (ippocampo di topo) |
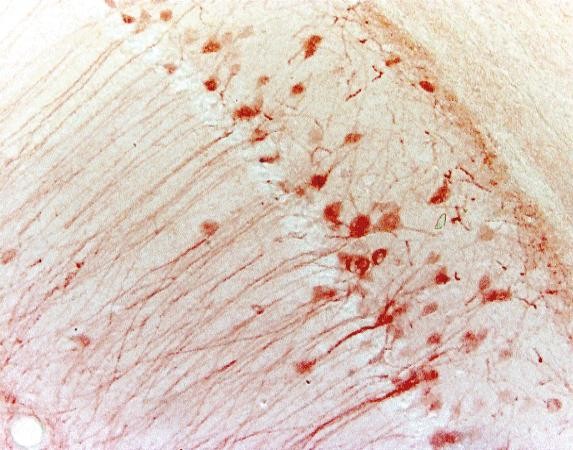 |
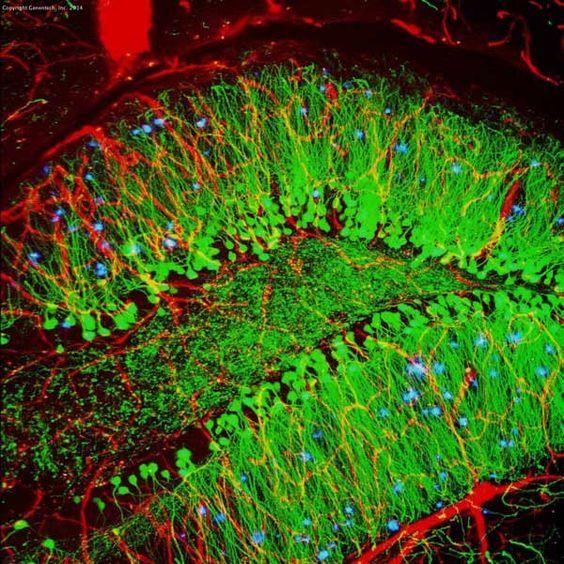 |